
Neptunio
Antecedentes
SOS Children produjo este sitio web para las escuelas, así como este sitio web video sobre África . Apadrina un niño para hacer una diferencia real.
| Neptunio | ||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
93 Np | ||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||
| Apariencia | ||||||||||||||||||||||||||||||||||||||||
metálico plateado  | ||||||||||||||||||||||||||||||||||||||||
| Propiedades generales | ||||||||||||||||||||||||||||||||||||||||
| Nombre, símbolo, número | neptunio, Np, 93 | |||||||||||||||||||||||||||||||||||||||
| Pronunciación | / n ɛ p tj U n yo ə m / Nep- TEW--nee əm | |||||||||||||||||||||||||||||||||||||||
| Categoría Elemento | actínidos | |||||||||||||||||||||||||||||||||||||||
| Grupo, período, bloque | n / a, 7, F | |||||||||||||||||||||||||||||||||||||||
| Peso atómico estándar | (237) | |||||||||||||||||||||||||||||||||||||||
| Configuración electrónica | [ Rn ] 5f 4 6d 1 7s 2 2, 8, 18, 32, 22, 9, 2 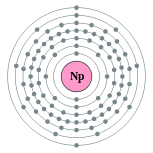 | |||||||||||||||||||||||||||||||||||||||
| Historia | ||||||||||||||||||||||||||||||||||||||||
| Descubrimiento | Edwin McMillan y Philip H. Abelson (1940) | |||||||||||||||||||||||||||||||||||||||
| Propiedades físicas | ||||||||||||||||||||||||||||||||||||||||
| Fase | sólido | |||||||||||||||||||||||||||||||||||||||
| Densidad (cerca rt) | 20,45 g · cm -3 | |||||||||||||||||||||||||||||||||||||||
| Punto de fusion | 910 K , 637 ° C, 1179 ° F | |||||||||||||||||||||||||||||||||||||||
| Punto de ebullicion | 4273 K, 4000 ° C, 7232 ° F | |||||||||||||||||||||||||||||||||||||||
| Calor de fusión | 3.20 kJ · mol -1 | |||||||||||||||||||||||||||||||||||||||
| El calor de vaporización | 336 kJ · mol -1 | |||||||||||||||||||||||||||||||||||||||
| Capacidad calorífica molar | 29.46 J · mol -1 · K -1 | |||||||||||||||||||||||||||||||||||||||
| Presión del vapor | ||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||
| Propiedades atómicas | ||||||||||||||||||||||||||||||||||||||||
| Estados de oxidación | 7, 6, 5, 4, 3 ( óxido anfótero) | |||||||||||||||||||||||||||||||||||||||
| Electronegatividad | 1,36 (escala de Pauling) | |||||||||||||||||||||||||||||||||||||||
| Energías de ionización | Primero: 604.5 kJ · mol -1 | |||||||||||||||||||||||||||||||||||||||
| Radio atómico | 155 pm | |||||||||||||||||||||||||||||||||||||||
| Radio covalente | 190 ± 13:00 | |||||||||||||||||||||||||||||||||||||||
| Miscelánea | ||||||||||||||||||||||||||||||||||||||||
| Estructura cristalina | ortorrómbica 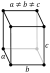 | |||||||||||||||||||||||||||||||||||||||
| Ordenamiento magnético | paramagnético | |||||||||||||||||||||||||||||||||||||||
| La resistividad eléctrica | (22 ° C) 1,220 μΩ · m | |||||||||||||||||||||||||||||||||||||||
| Conductividad térmica | 6,3 W · m -1 · K -1 | |||||||||||||||||||||||||||||||||||||||
| Número de registro del CAS | 7439-99-8 | |||||||||||||||||||||||||||||||||||||||
| La mayoría de los isótopos estables | ||||||||||||||||||||||||||||||||||||||||
| Artículo principal: Los isótopos de neptunio | ||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||
El neptunio es un elemento químico con el símbolo Np y número atómico 93. La metal radiactivo, el neptunio es la primera elemento transuránicos, y pertenece a la actínidos serie. Su más estable isótopo , 237 Np, es un subproducto de reactores nucleares y el plutonio de producción, y que puede ser utilizado como un componente en equipo de detección de neutrones. Neptunio también se encuentra en cantidades traza en uranio minerales debido a la transmutación reacciones.
Historia
La tabla periódica de Dmitri Mendeleev publicado en la década de 1870 mostró un "-" en su lugar después de uranio similar a varios otros lugares por lo que los elementos no descubiertos puntuales. Además, una publicación de 1913 de los isótopos radiactivos conocidos por Kasimir Fajans muestra el lugar vacío después de uranio.
Los informes falsos de descubrimiento
En 1934, Odolen Koblic extrae una pequeña cantidad de material del agua de lavado de asado pechblenda. Asumió la muestra fue de elemento 93, y lo llamó bohemium, pero después de ser analizado, resultó que la muestra era una mezcla de tungsteno y vanadio . También en 1934, Enrico Fermi intentó bombardear uranio con neutrones para producir elementos 93 y 94 . También tuvo éxito, pero había descubierto, sin saberlo, la fisión nuclear . En 1938, Horia Hulubei, un físico rumano; y Yvette Cauchois, un químico francés; afirmó haber descubierto el elemento 93 a través de la espectroscopia en minerales. Llamaron a su elemento sequanium, pero la afirmación se opuso en su momento porque el neptunio se cree que se producen exclusivamente artificialmente. Sin embargo, como el neptunio se produce en la naturaleza, es posible que Hulubei y Cauchois de hecho descubrir neptunio.
Descubrimiento real
La búsqueda para el elemento 93 en minerales fue gravado por el hecho de que las predicciones sobre las propiedades químicas del elemento 93 se basa en una tabla periódica que carecía de la serie de los actínidos, y por lo tanto coloca debajo de torio hafnio, protactinio debajo de tántalo, tungsteno y uranio a continuación. Esta tabla periódica sugirió que el elemento 93, en ese momento a menudo llamado eka-renio, debe ser similar al manganeso o renio. Con esta idea errónea de que era imposible aislar el elemento 93 a partir de minerales, aunque neptunio fue encontrado más tarde en el mineral de uranio, en 1952.
Enrico Fermi cree que el bombardeo de uranio con neutrones y posterior desintegración beta daría lugar a la formación de elemento 93. separación química de los nuevos elementos formados a partir del material de uranio con vida media bajo dado, y, por lo tanto, Fermi anunció el descubrimiento de un nuevo elemento en 1934, aunque esto fue pronto resultó ser errónea. Pronto se especuló y más tarde demostrado que la mayoría del material es creado por la fisión nuclear del uranio por neutrones. Pequeñas cantidades de neptunio tenían que ser producidas en Los experimentos de Otto Hahn en finales de 1930, como resultado de la descomposición de 239 U. Hahn y sus colegas confirmaron experimentalmente las propiedades de producción y químicas de 239 U, pero no tuvieron éxito en aislar y detectar el neptunio.
El neptunio (llamado así por el planeta Neptuno , el siguiente planeta fuera de Urano , después de que el uranio fue nombrado) fue descubierto por Edwin McMillan y Philip H. Abelson en 1940 en el Berkeley Laboratorio de Radiación de la Universidad de California, Berkeley. El equipo produjo el neptunio isótopo 239 Np (2,4 días de media vida ) mediante el bombardeo de uranio con neutrones de movimiento lento. Fue la primera Elementos transuránicos produce sintéticamente y la primera serie de los actínidos Elementos transuránicos descubrió.
Aparición
El isótopo más estable de neptunio es 237 Np, con una vida media a dos millones de años. Por lo tanto, todo el neptunio primordial debería haber decaído por ahora. Sin embargo, pequeñas cantidades de neptunio isótopos neptunio-237 a través de neptunio-240, se encuentran de forma natural como productos de desintegración de reacciones de transmutación en minerales de uranio.
Artificial 237 Np se produce a través de una reacción de 237 NPF 3 con el líquido de bario o de litio en alrededor de 1200 ° C y más a menudo se extrae de pasado barras de combustible nuclear en cantidades kilogramo como un subproducto en plutonio de producción.
- 2 NPF 3 + 3 Ba → 2 Np + 3 BaF2
Por peso, neptunio-237 descargas son alrededor del 5% tan grande como las descargas de plutonio y de aproximadamente 0,05% de los vertidos de combustible nuclear gastado. Sin embargo, incluso esta fracción todavía asciende a más de cincuenta toneladas por año.
Características
Plateado en apariencia, neptunio de metal es químicamente bastante reactiva y se encuentra en al menos tres alótropos :
- α-neptunio, ortorrómbica, la densidad de 20,45 g / cm 3
- β-neptunio (por encima de 280 ° C), tetragonal, la densidad (313 ° C) 19,36 g / cm 3
- γ-neptunio (por encima de 577 ° C), cúbico, densidad (600 ° C) 18 g / cm 3
El neptunio tiene la gama más grande de cualquier líquido elemento, 3363 K, entre el punto de fusión y punto de ebullición. Es el más denso de todos los actínidos y el quinto más denso de todos los elementos presentes en la naturaleza. El neptunio tiene ningún papel biológico. No se absorbe por el tracto digestivo. Cuando se inyecta en el cuerpo, se acumula en huesos, que se libera lentamente desde.
Isótopos
19 neptunio radioisótopos se han caracterizado, con ser el más estable 237 Np con una vida media de 2,14 millones de años, 236 Np con una vida media de 154.000 años, y 235 Np con una vida media de 396,1 días. Todos los restantes isótopos radiactivos tienen vidas medias que son menos de 4,5 días, y la mayoría de ellos tienen vidas medias que son menos de 50 minutos. Este elemento también tiene 4 estados de la meta, con el ser más estable 236m Np (t ½ 22,5 horas).
Los isótopos de neptunio varían en peso atómico de 225.0339 u (225 Np) a 244.068 u (244 Np). El primario modo de decaimiento antes del isótopo más estable, 237 Np, es captura de electrones (con una buena cantidad de emisión alfa), y el modo primario después de que se emisión beta. El primario productos de desintegración antes 237 Np son elemento 92 ( de uranio ) (isótopos emisión alfa produce elemento 91, protactinio , sin embargo) y los productos primarios después de son elemento 94 ( plutonio ) isótopos.
237 Np es fisionable. 237 Np finalmente se desintegra para formar bismuto -209 y talio -205, a diferencia de la mayoría de los núcleos pesados comunes que decaen hacer isótopos de plomo. Este cadena de desintegración se conoce como el serie neptunio.
Síntesis
Químicamente, el neptunio se prepara mediante la reducción de la NPF 3 con bario o vapor de litio a aproximadamente 1200 ° C. La mayoría Np se produce en las reacciones nucleares:
- Cuando una 235 U átomo de captura un neutrón, se convierte a un estado excitado de 236 U. Alrededor del 81% de los núcleos excitados 236 U se someten a la fisión, pero la decadencia resto al estado fundamental de 236 U emitiendo la radiación gamma. Adicional captura de neutrones crea 237 U, que tiene una vida media de 7 días y por lo tanto rápidamente decae a 237 Np través desintegración beta. Durante la desintegración beta, el emocionado 237 U emite un electrón, mientras que el atómico interacción débil convierte un neutrón a un protón , creando así 237 Np.
- 237 U también se produce a través de un ( n , 2n) reacción con 238 U. Esto sólo ocurre con los neutrones muy energéticos.
- 237 Np es el producto de desintegración alfa de 241 Am.
Isótopos más pesados de descomposición neptunio rápidamente, y isótopos más ligeros de neptunio no pueden ser producidos por captura de neutrones, por lo que la separación química de neptunio desde enfría combustible nuclear gastado da casi puro 237 Np.
Química

Este elemento tiene cuatro iónicos estados de oxidación mientras que en solución:
- Np 3+ (púrpura pálido), análoga a la rara Pm ión de tierras 3+
- Np 4+ (amarillo-verde)
- NpO +
2 (verde-azul) - NpO 2+
2 (rosa pálido)
Neptunio (III) de hidróxido no es soluble en agua y no se disuelve en exceso de álcali. Neptunio (III) es susceptible a la oxidación en contacto para formar neptunio de aire (IV).
Neptunio formas tri- y tetra haluros tales como NPF 3, NPF 4, NPCL 4, NpBr 3, NpI 3, y óxidos de las diversas composiciones tales como se encuentran en el uranio de oxígeno del sistema, incluyendo Np 3 O 8 y NpO 2.
Hexafluoruro de neptunio, NPF 6, es volátil como hexafluoruro de uranio.
El neptunio, como protactinio , uranio , plutonio y americio forma fácilmente un dioxo lineal neptunyl núcleo (NpO 2 n +), en sus 5+ 6+ y estados de oxidación, que fácilmente complejos con ligandos O-donantes duros como OH -, NO2 -, NO 3 - y SO 4 2- para formar complejos aniónicos solubles que tienden a ser fácilmente móvil con bajas afinidades para el suelo.
- NpO 2 (OH) 2 -
- NpO 2 (CO 3) -
- NpO 2 (CO 3) 2 3-
- NpO 2 (CO 3) 3 5-
Aplicaciones
Precursor en la producción de plutonio-238
237 Np es irradiado con neutrones para crear 238 Pu, un emisor alfa para radioisótopo generadores térmicos para satélites y aplicaciones militares. 237 Np capturará un neutrón para formar 238 Np y desintegración beta con una vida media de dos días para 238 Pu.
238 Pu también existe en cantidades considerables en el combustible nuclear gastado, pero tendría que ser separado del otro isótopos de plutonio.
Aplicaciones de Armas
El neptunio es fisionable, y teóricamente podría ser utilizado como combustible en un reactor de neutrones rápidos o de un arma nuclear , con un masa crítica de alrededor de 60 kilogramos. En 1992, la Departamento de Energía de Estados Unidos desclasificó la afirmación de que el neptunio-237 "se puede utilizar para un dispositivo nuclear explosivo". No se cree que un arma real nunca ha sido construido usando el neptunio. A partir de 2009, la producción mundial de neptunio-237 por reactores comerciales fue más de 1000 masas críticas al año, pero para extraer el isótopo de elementos combustibles irradiados sería una empresa industrial.
En septiembre de 2002, investigadores de la Laboratorio Nacional de Los Alamos creó brevemente la primera nuclear conocida masa crítica mediante el neptunio en combinación con conchas de uranio enriquecido ( U-235), el descubrimiento de que la masa crítica de una esfera desnuda de neptunio-237 "se extiende de pesos kilogramo en los altos de los años cincuenta a los sesenta bajas", demostrando que "se trata de una materia tan buena como bomba U-235. "El Gobierno Federal de los Estados Unidos hizo planes en marzo de 2004 mover suministro de neptunio separado de Estados Unidos a un sitio de disposición de residuos nucleares en Nevada.
Aplicaciones de la física
237 Np se utiliza en dispositivos para la detección de alta energía (MeV) neutrones.
Papel en los residuos nucleares
El neptunio-237 es la más móvil de los actínidos en el profunda entorno repositorio geológico. Esto hace que sea y sus predecesores, tales como americio-241 candidatos de interés para la destrucción de transmutación nuclear. El neptunio se acumula en los detectores de humo de los hogares ionización cámaras comerciales de la descomposición de la (típicamente) 0.2 microgramo de americio-241 presente inicialmente como una fuente de radiación ionizante. Con una vida media de 432 años, el americio 241 en un detector de humo incluye aproximadamente 3% de neptunio después de 20 años, y aproximadamente 15% después de 100 años.
Debido a su larga vida media, neptunio se convierte en el principal contribuyente de la radiación total en 10.000 años. Como no está claro lo que ocurre con la contención en ese lapso de tiempo, una extracción del neptunio sería minimizar la contaminación del medio ambiente si se podría movilizar los residuos nucleares después de varios miles de años.
Literatura
- Guía de los Elementos - Edición Revisada, Albert Stwertka, (Oxford University Press, 1998) ISBN 0-19-508083-1
- Lester R. Morss, Norman M. Edelstein, Jean Fuger (Hrsg.): La Química de la actínidos y transactinide Elementos, Springer-Verlag, Dordrecht 2006, ISBN 1-4020-3555-1.
- Ida Noddack (1934). "Über das Element 93" Zeitschrift für Angewandte Chemie 47 (37):. 653. doi: 10.1002 / ange.19340473707. http://www.chemteam.info/Chem-History/Noddack-1934.html.
![\ Mathrm {^ {238} _ {\ 92} U \ + \ ^ {1} _ {0} n \ \ longrightarrow \ ^ {239} _ {\ 92} U \ \ xrightarrow [23 \ min] {\ beta ^ -} \ ^ {239} _ {\ 93} Np \ \ xrightarrow [2,355 \ d] {\ beta ^ -} \ ^ {239} _ {\ 94} Pu}](../../images/2301/230111.png)
![\ Mathrm {^ {235} _ {\ 92} U \ + \ ^ {1} _ {0} n \ \ longrightarrow \ ^ {236} _ {\ 92} UM \ \ xrightarrow [120 \ ns] {} \ ^ {236} _ {\ 92} U \ + \ \ gamma}](../../images/2301/230112.png)
![\ Mathrm {^ {236} _ {\ 92} U \ + \ ^ {1} _ {0} n \ \ longrightarrow \ ^ {237} _ {\ 92} U \ \ xrightarrow [6,75 \ d] {\ beta ^ -} \ ^ {237} _ {\ 93} Np}](../../images/2301/230113.png)
![\ Mathrm {^ {237} _ {\ 93} Np \ + \ ^ {1} _ {0} n \ \ longrightarrow \ ^ {238} _ {\ 93} Np \ \ xrightarrow [2,117 \ d] {\ beta ^ -} \ ^ {238} _ {\ 94} Pu}](../../images/2301/230115.png)
