
Xenón
Sabías ...
SOS cree que la educación da una mejor oportunidad en la vida para los niños en el mundo en desarrollo también. SOS Children trabaja en 45 países africanos; puede ayudar a un niño en África ?
| Xenón | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
54 Xe | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Apariencia | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
gas incoloro, exhibiendo un brillo azul cuando se coloca en un campo eléctrico de alta tensión  Las líneas espectrales de xenón | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propiedades generales | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Nombre, símbolo, número | xenón, Xe, 54 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Pronunciación | / z ɛ n ɒ n / ZEN -on o / z yo n ɒ n / ZEE -no | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Categoría metálico | gases nobles | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Grupo, período, bloque | 18 (gases nobles) , 5, p | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Peso atómico estándar | 131.293 (6) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Configuración electrónica | [ Kr ] 5s 2 4d 10 5p 6 2, 8, 18, 18, 8 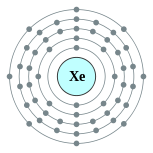 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Historia | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Descubrimiento | William Ramsay y Morris Travers (1898) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Primer aislamiento | William Ramsay y Morris Travers (1898) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propiedades físicas | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Fase | gas | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Densidad | (0 ° C, 101,325 kPa) 5,894 g / L | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Líquido densidad en pb | 3,057 g · cm -3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Punto de fusion | (101,325 kPa) 161,4 K , -111,7 ° C, -169.1 ° F | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Punto de ebullicion | (101,325 kPa) 165,03 K, -108.12 ° C, -162.62 ° F | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Punto Triple | 161.405 K (-112 ° C), 81,6 kPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Punto crítico | 289,77 K, 5.841 MPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Calor de fusión | (101,325 kPa) 2.27 kJ · mol -1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| El calor de vaporización | (101,325 kPa) 12,64 kJ · mol -1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Capacidad calorífica molar | 5 R / 2 = 20.786 J · mol -1 · K -1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Presión del vapor | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propiedades atómicas | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Estados de oxidación | 0, 1, 2, 4, 6, 8 (Rara vez más de 0) (Débilmente ácida óxido) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Electronegatividad | 2,6 (escala de Pauling) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Energías de ionización | Primero: 1170,4 kJ · mol -1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Segundo: 2046,4 kJ · mol -1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Tercero: 3099,4 kJ · mol -1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Radio covalente | 140 ± 21:00 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Van der Waals radio | 216 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Miscelánea | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Estructura cristalina | cara cúbica centrada  | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ordenamiento magnético | diamagnético | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Conductividad térmica | 5,65 × 10 -3 W · m -1 · K -1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Velocidad del sonido | (Líquido) 1090 m / s; (Gas) 169 m · s -1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Número de registro del CAS | 7440-63-3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| La mayoría de los isótopos estables | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Artículo principal: Los isótopos de xenón | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
El xenón es un elemento químico con el símbolo Xe y número atómico 54. Es un, pesado, incoloro e inodoro gas noble , que se produce en la atmósfera de la Tierra en cantidades traza. Aunque generalmente no reactivo, el xenón puede someterse a unas pocas reacciones químicas tales como la formación de hexafluoroplatinate xenón, la primera compuesto de gas noble que se sintetiza.
De origen natural se compone de xenón ocho isótopos estables. Hay también más de 40 isótopos inestables que se someten la desintegración radiactiva. Las proporciones de isótopos de xenón son una herramienta importante para el estudio de la historia temprana del Sistema Solar . Radioactivo xenon-135 se produce a partir yodo-135 como resultado de la fisión nuclear , y actúa como el más significativo absorbente de neutrones en reactores nucleares.
Xenón se utiliza en lámparas de flash y lámparas de arco, y como anestesia general. La primera diseño de láser excimer utilizado un xenón molécula de dímero (Xe 2) como su medio emisor de láser, y los primeros láser diseños utilizan lámparas de flash de xenón como bombas. Xenon también se está utilizando para buscar hipotética débilmente partículas masivas de interacción y como el propulsor para propulsores de iones en nave espacial.
Historia
Xenon fue descubierto en Inglaterra por el químico escocés William Ramsay y el químico Inglés Morris Travers, el 12 de julio de 1898, poco después de su descubrimiento de los elementos de criptón y neón . Encontraron xenón en el residuo sobrante de la evaporación de los componentes aire líquido. Ramsay sugirió el nombre de xenón para este gas del griego palabra ξένον [xenón], la forma singular neutro de ξένος [xenos], que significa "extranjero (er)", "extraño (r)", o "invitado". En 1902, Ramsay estima la proporción de xenón en la atmósfera de la Tierra como una parte en 20 millones. El símbolo actual de xenón es Xe, sin embargo, históricamente, también fue escrito como X.
Durante la década de 1930, el ingeniero estadounidense Harold Edgerton comenzó a explorar estroboscópico tecnología de luz para la fotografía de alta velocidad. Esto le llevó a la invención de la lámpara de flash de xenón, en el que la luz se genera mediante el envío de una breve corriente eléctrica a través de un tubo relleno de gas xenón. En 1934, Edgerton fue capaz de generar destellos tan breves como uno microsegundo con este método.
En 1939, el médico estadounidense Albert R. Behnke Jr. comenzó a explorar las causas de la "borrachera" en buzos de aguas profundas. Él probó los efectos de la variación de las mezclas respirables a sus súbditos, y descubrió que esto causó a los buzos a percibir un cambio en profundidad. A partir de sus resultados, se deduce que el gas xenón podría servir de anestésico. Aunque toxicólogo ruso Nikolay V. Lazarev parecer estudió anestesia de xenón en 1941, el primer informe publicado confirmando la anestesia de xenón fue en 1946 por el investigador médico estadounidense John H. Lawrence, quien experimentó con ratones. Xenon se utilizó por primera vez como un anestésico quirúrgico en 1951 por el anestesiólogo estadounidense Stuart C. Cullen, quien operó con éxito en dos pacientes.
Xenon y los otros gases nobles fueron durante mucho tiempo considerado para ser completamente químicamente inerte y no es capaz de formar compuestos . Sin embargo, mientras enseñaba en el Universidad de Columbia Británica, Neil Bartlett descubrió que el gas hexafluoruro de platino (PTF 6) era un potente agente oxidante que puede oxidar el gas de oxígeno (O 2) para formar hexafluoroplatinate Dioxigenil (O 2 + [PtF 6] -). Desde O 2 y xenón tienen casi la misma primera potencial de ionización, Bartlett dio cuenta de que el hexafluoruro de platino también podría ser capaz de oxidar xenón. El 23 de marzo de 1962, que mezcló los dos gases y produjo el primer compuesto conocido de un gas noble, hexafluoroplatinate xenón. Bartlett cree su composición sea Xe + [PtF 6] -, aunque el trabajo posterior ha revelado que era probablemente una mezcla de diversas sales que contiene xenón. Desde entonces, muchos otros compuestos de xenón se han descubierto, junto con algunos compuestos de la noble gases de argón , criptón , y el radón , incluyendo fluorohydride argón (Harf), criptón difluoruro (KrF 2), y fluoruro de radón. Para 1971, se conocen más de 80 compuestos de xenón.
Características

( animada versión)
Xenon tiene número atómico 54; es decir, su núcleo contiene 54 protones . En temperatura y presión normales, el gas xenón puro tiene una densidad de 5.761 kg / m 3, aproximadamente 4,5 veces la densidad superficial de la atmósfera de la Tierra, 1.217 kg / m3. Como un líquido, el xenón tiene una densidad de hasta 3,100 g / ml, con la densidad máxima que ocurre en el punto triple. En las mismas condiciones, la densidad de xenón sólido, 3,640 g / cm 3, es mayor que la densidad media de granito , 2,75 g / cm 3. Uso gigapascales de presión, el xenón se ha visto obligado a una fase metálica.
Cambios de xenón sólidos de cara cúbica centrada (FCC) para Cerrar hexagonal lleno (hcp) fase de cristal bajo presión y comienza a girar metálico a aproximadamente 140 GPa, sin cambio de volumen notable en la fase hcp. Es completamente metálico a 155 GPa. Cuando metalizado, el xenón se ve azul cielo, ya que absorbe la luz roja y transmite otras frecuencias visibles. Tal comportamiento es inusual para un metal y se explica por la relativamente pequeña anchura de las bandas de electrones en xenón metálico.
El xenón es un miembro de las cero- valencia elementos que se llama noble o inertes los gases . Es inerte a la mayoría de las reacciones químicas comunes (tales como la combustión, por ejemplo) debido a que el exterior valencia cáscara contiene ocho electrones. Esto produce una configuración estable de energía, mínimo en el que los electrones externos están estrechamente vinculados. Sin embargo, el xenón puede haber oxidado por poderosos agentes oxidantes, y muchos compuestos de xenón se han sintetizado.
En un lleno de gas tubo, xenón emite una azul o resplandor lavenderish cuando el gas es excitado por descarga eléctrica. Xenon emite una banda de líneas de emisión que abarcan todo el espectro visual, pero las líneas más intensas se producen en la región de la luz azul, que produce la coloración.
Ocurrencia y producción
Xenon es una rastrear gas en la atmósfera de la Tierra , que se produce a los 87 ± 1 partes por billón (nL / L), o aproximadamente 1 parte por 11,5 millones, y también se encuentra en los gases emitidos por algunos fuentes de agua mineral.
Xenon se obtiene comercialmente como un subproducto de la separación de aire en oxígeno y nitrógeno . Después de esta separación, realizado generalmente por destilación fraccionada en una planta de doble columna, el oxígeno líquido producido contendrá pequeñas cantidades de criptón y xenón. Por los pasos de destilación fraccionada adicionales, el oxígeno líquido puede ser enriquecido para contener 0,1-0,2% de una mezcla de criptón / xenón, que se extrae ya sea a través de la adsorción sobre gel de sílice o por destilación. Finalmente, la mezcla de criptón / xenón se puede separar en criptón y xenón a través de destilación. Extracción de un litro de xenon de la atmósfera requiere 220 vatios-hora de energía. La producción mundial de xenón en 1998 se estima en 5.000-7.000 m 3. Debido a su baja abundancia, el xenón es mucho más caro que los precios nobles ligeros gases aproximados para la compra de pequeñas cantidades en Europa en 1999 fueron 10 € / L para el xenón, 1 € / L para el criptón, y 0,20 € / L para neón; el argón mucho más abundantes cuesta menos de un centavo por litro.
Dentro del Sistema Solar, la fracción nucleon de xenón es 1,56 × 10 -8, para una abundancia de aproximadamente una parte en 630.000 de la masa total. El xenón es relativamente rara en el Sun ambiente 's, en la Tierra , y en asteroides y cometas . El planeta Júpiter tiene una inusual abundancia de xenón en su ambiente; alrededor de 2,6 veces más que el Sol Esta alta abundancia permanece sin explicación y puede haber sido causado por una acumulación temprana y rápida de planetesimales-pequeñas, subplanetary cuerpos antes de la disco presolar comenzó a calentarse. (De lo contrario, el xenón no habría sido atrapado en los hielos planetesimal.) El problema del xenón terrestre baja puede potencialmente ser explicado por unión covalente de xenón a oxígeno dentro de cuarzo , por lo tanto reduciendo la emisión de gases de xenón a la atmósfera.
A diferencia de los gases nobles de menor masa, el Normal proceso de nucleosíntesis estelar dentro de una estrella no forma xenón. Elementos más masivas que hierro-56 tiene un coste de energía neta para producir través de la fusión, lo que no hay ganancia de energía para una estrella al crear xenón. En lugar de ello, se forma xenón durante supernova explosiones, por el proceso de captura de neutrones lentos ( s-proceso) de gigantes rojas estrellas que han agotado el hidrógeno en sus núcleos y entrado en el rama gigante asintótica, en clásica nova explosiones y de la desintegración radiactiva de los elementos como el yodo , el uranio y el plutonio .
Isótopos y estudios isotópicos
Naturalmente xenón que ocurre es de ocho estables isótopos , la mayor parte de cualquier elemento con la excepción de estaño , que tiene diez. Xenon y el estaño son los únicos elementos a tener más de siete isótopos estables. Los isótopos 124 y 134 Xe Xe se predicen a someterse doble desintegración beta, pero esto nunca se ha observado por lo que se consideran ser estable. Además de estas formas estables, hay más de 40 isótopos inestables que han sido estudiados. El de más larga vida de estos isótopos es 136 Xe, que se ha observado que someterse a doble desintegración beta con una vida media de 2,11 x 10 21 yr. 129 Xe es producido por decaimiento beta de 129 I , que tiene una vida media de 16 millones de años, mientras 131m Xe, 133 Xe, 133m Xe, y 135 Xe son algunos de los fisión productos tanto de 235 U y 239 Pu , y por lo tanto utilizarse como indicadores de explosiones nucleares.
Los núcleos de las dos de la cuadra isótopos de xenón, 129 y 131 Xe Xe, tienen cero no intrínseca momentos angulares ( espines nucleares, apto para resonancia magnética nuclear). Los espines nucleares se pueden alinear más allá de los niveles de polarización ordinarias por medio de la luz polarizada circularmente y rubidio vapor. La resultante giro polarización de xenón núcleos puede superar el 50% de su máximo valor posible, superando con creces el valor de equilibrio dictado por el Distribución de Boltzmann (típicamente 0,001% del valor máximo en temperatura ambiente, incluso en los más fuertes imanes ). Dicha alineación no equilibrio de giros es una condición temporal, y se llama hiperpolarización. El proceso de hiperpolarizar el xenón se llama bombeo óptico (aunque el proceso es diferente de bombeo de un láser).
Debido a que un Xe núcleo 129 tiene una espín de 1/2, y por lo tanto un cero eléctrico momento cuadrupolar, el 129 Xe núcleo no experimenta ninguna interacciones cuadrupolares durante las colisiones con otros átomos, y por tanto su hiperpolarización puede mantenerse durante largos períodos de tiempo, incluso después de que el rayo láser se ha apagado y el vapor de álcali removidos por condensación en una habitación superficie -temperatura. Girar polarización de 129 Xe puede persistir de varios segundos para los átomos de xenón disueltos en la sangre a varias horas en la fase gaseosa y varios días en xenón sólido profundamente congelado. En contraste, 131 Xe tiene un valor de espín nuclear de 3/2 y una diferente de cero cuadrípolos momento, y tiene T 1 tiempos de relajación en el milisegundo y segundo rangos.
Algunos isótopos radiactivos de xenón, por ejemplo, 133 y 135 Xe Xe, son producidos por neutrones irradiación de materiales fisionables dentro reactores nucleares. 135 Xe es de considerable importancia en la operación de reactores de fisión nuclear. 135 Xe tiene un enorme sección transversal de neutrones térmicos, 2,6 × 10 6 graneros, por lo que actúa como un absorbente de neutrones o " veneno "que puede retrasar o detener la reacción en cadena después de un período de funcionamiento. Esto fue descubierto en los reactores nucleares más antiguos construidos por la American Proyecto Manhattan para plutonio producción. Disposiciones Afortunadamente los diseñadores habían hecho en el diseño para aumentar la reactividad del reactor (el número de neutrones por fisión que se encienden a la fisión de otros átomos combustible nuclear). 135 Xe envenenamiento reactor jugó un papel importante en el desastre de Chernobyl . Un apagado o disminución de la potencia de un reactor pueden resultar en acumulación de 135 Xe y conseguir el reactor en el pozo de yodo.
Bajo condiciones adversas, concentraciones relativamente altas de isótopos radiactivos de xenón se pueden encontrar que emana de los reactores nucleares debido a la liberación de productos de fisión de agrietado barras de combustible, o la fisión del uranio en agua de refrigeración.
Debido a que el xenón es un trazador de dos isótopos padres, las proporciones de isótopos de xenón en meteoritos son una poderosa herramienta para el estudio de la formación del sistema solar. La método yodo-xenón de citas da el tiempo transcurrido entre nucleosíntesis y la condensación de un objeto sólido a partir de la nebulosa solar. En 1960, el físico John H. Reynolds descubierto que ciertos meteoritos contenían una anomalía isotópica en la forma de una sobreabundancia de xenon-129. Dedujo que esta era una producto de la desintegración radiactiva de yodo-129. Este isótopo se produce lentamente por espalación de rayos cósmicos y la fisión nuclear , pero se produce en cantidad sólo en las explosiones de supernovas. A medida que la vida media de 129 que es relativamente corto en una escala de tiempo cosmológica, sólo 16 millones de años, esta demostrado que sólo un corto tiempo había pasado entre la supernova y el tiempo de los meteoritos habían solidificado y atrapado el 129 I. Estos dos eventos (supernovas y solidificación de la nube de gas) se infiere que ha sucedido durante la historia temprana del Sistema Solar , como el isótopo 129 que probablemente fue generada antes de la formación del Sistema Solar, pero no mucho antes, y sembraron el gas solar nublar con isótopos de una segunda fuente. Esta fuente supernova también puede haber causado el colapso de la nube de gas solar.
De una manera similar, las relaciones isotópicas de xenón como 129 Xe / 130 Xe y 136 Xe / 130 Xe son también una herramienta poderosa para la comprensión de la diferenciación planetaria y la desgasificación temprano. Por ejemplo, El atmósfera de Marte muestra una abundancia de xenón similar a la de la Tierra: 0,08 partes por millón, sin embargo Marte muestra una mayor proporción de 129 Xe que la Tierra o el Sol Como este isótopo es generado por la desintegración radiactiva, el resultado puede indicar que Marte perdió la mayor parte de su atmósfera primordial, posiblemente dentro de los primeros 100 millones de años después se formó el planeta. En otro ejemplo, el exceso de 129 Xe encuentra en dióxido de carbono de gases así desde Nuevo México se creía que era de la decadencia de los gases derivados del manto pronto después de la formación de la Tierra.
Compuestos
Después del descubrimiento de Neil Bartlett en 1962 que el xenón puede formar compuestos químicos, un gran número de compuestos de xenón se han descubierto y descrito. Compuestos de xenón Casi todos conocidos contienen el átomos electronegativo flúor o de oxígeno.
Haluros

Tres fluoruros son conocidos: XeF 2, XeF 4, y XeF 6. XeF se teoriza a ser inestable. Los fluoruros son el punto de partida para la síntesis de casi todos los compuestos de xenón.
El sólido, difluoride cristalina XeF2 se forma cuando una mezcla de flúor y los gases de xenón se expone a la luz ultravioleta. Luz ordinaria es suficiente. Calentamiento a largo plazo de XeF 2 a altas temperaturas bajo un catalizador NIF 2 produce XeF 6. La pirólisis de XeF 6 en presencia de NaF produce XeF alta pureza 4.
Los fluoruros de xenón se comportan como dos aceptores y donantes de fluoruro de fluoruro, formando sales que contienen cationes tales como XeF + y Xe
2 F +
3, y aniones tales como XeF -
5, XeF -
7, y XeF 2-
8. El verde, Xe paramagnético +
2 está formado por la reducción de XeF 2 por el gas xenón.
XeF 2 también es capaz de formar complejos de coordinación con iones de metales de transición. Más de 30 de tales complejos se han sintetizado y caracterizado.
Considerando que los fluoruros de xenón están bien caracterizados, los otros haluros no se conocen, la única excepción es el dicloruro, XeCl 2. Dicloruro de xenón se divulga para ser un compuesto endotérmico, cristalino incoloro que se descompone en los elementos a 80 ° C, formada por la irradiación de alta frecuencia de una mezcla de xenón, flúor, y silicio o tetracloruro de carbono . Sin embargo, la duda se ha planteado si XeCl 2 es un compuesto real y no meramente un van der Waals molécula que consta de débilmente unidos átomos de Xe y Cl 2 moléculas. Los cálculos teóricos indican que la molécula lineal XeCl 2 es menos estable que el van der Waals complejo.
Óxidos y oxohaluros
Tres óxidos de xenón son conocidos: trióxido de xenón (Xeo 3) y tetróxido de xenón (Xeo 4), ambos de los cuales son peligrosamente agentes oxidantes y explosivos potentes, y dióxido de xenón (Xeo 2), que fue reportado en el 2011 con un número de coordinación de cuatro. Xeo 2 formas cuando tetrafluoruro de xenón se vierte sobre hielo. Su estructura cristalina puede permitir a sustituir al silicio en minerales de silicato. El catión XeOO + ha sido identificado por espectroscopia de infrarrojo en estado sólido de argón .
Xenon no reacciona con el oxígeno directamente; el trióxido está formado por la hidrólisis de XeF 6:
- XeF 6 + 3 H 2 O → Xeo 3 + 6 HF
Xeo 3 es ligeramente ácida, disolución en álcali para formar sales xenate inestables que contienen el HXeO -
4 anión. Estas sales inestables fácilmente desproporcionada en gas xenón y sales Perxenato, que contiene el Xeo 4-
6 anión.
Perxenato de bario, cuando se trata con concentrado de ácido sulfúrico , produce tetróxido de xenón gaseoso:
- Ba 2 Xeo 6 + 2 H 2 SO 4 → 2 BaSO4 + 2 H2O + Xeo 4
Para evitar la descomposición, el tetróxido de xenón así formada se enfría rápidamente para formar un sólido de color amarillo pálido. Explota anterior -35,9 ° C en xenón y gas oxígeno.
Un número de oxifluoruros xenón son conocidos, incluyendo XeOF 2, XeOF 4, Xeo 2 F 2, y Xeo 3 F 2. XeOF 2 se forma por la reacción de DE 2 con gas xenón a bajas temperaturas. También puede ser obtenida mediante la hidrólisis parcial de XeF 4. Se desproporciona a -20 ° C en XeF 2 y Xeo 2 F 2. XeOF 4 está formado por la hidrólisis parcial de XeF 6, o la reacción de XeF 6 con Perxenato de sodio, Na 4 Xeo 6. La última reacción también produce una pequeña cantidad de Xeo 3 F 2 XeOF 4 reacciona con. CsF para formar el XeOF -
5 de aniones, mientras que XeOF 3 reacciona con los fluoruros de metales alcalinos KF, RbF y CsF para formar el XeOF -
4 anión.
Otros compuestos
Recientemente, ha habido un interés en compuestos de xenón donde xenón está unido directamente a un elemento menos electronegativo que el flúor o oxígeno, en particular de carbono . Grupos aceptores de electrones, tales como grupos con sustitución de flúor, son necesarias para estabilizar estos compuestos. Numerosos tales compuestos se han caracterizado, incluyendo:
- C 6 F 5 xe + -N≡C-CH3, donde C 6 F 5 es el grupo pentafluorofenilo.
- [C 6 F 5] 2 Xe
- C 6 F 5 xe-X, donde X es CN, F, o Cl.
- R-C = C-Xe +, donde R es C 2 F -
5 o terc-butilo. - C 6 F 5 -XeF +
2 - (C 6 F 5 Xe) 2 Cl +
Otros compuestos que contienen xenón unido a un elemento menos electronegativo incluyen F-Xe-N (SO 2 F) 2 y F-Xe-BF 2. Este último se sintetiza a partir tetrafluorborato Dioxigenil, O 2 BF 4, a -100 ° C.
Un ion de xenón inusual que contiene es la tetraxenonogold (II) catión, AuXe 2+
4, que contiene Xe-Au bonos. Este ion se produce en el compuesto AuXe 4 (Sb 2 F 11) 2, y es notable en que tienen enlaces químicos directos entre dos átomos notoriamente no reactivos, xenón y de oro , con el xenón actúa como un ligando de metal de transición.
En 1995, M. Räsänen y compañeros de trabajo, los científicos en el Universidad de Helsinki en Finlandia , anunció la preparación de dihidruro de xenón (HXeH), y más tarde de xenón hidruro-hidróxido (HXeOH), hydroxenoacetylene (HXeCCH), y otras moléculas que contienen Xe. En 2008, Khriachtchev et al. Informó la preparación de HXeOXeH por el fotólisis del agua dentro de una matriz de xenón criogénico. Moléculas deuterados, HXeOD y DXeOH, también se han producido.
Clatratos y excimers
Además de los compuestos de xenón donde forma un enlace químico , el xenón puede formar clatratos-sustancias donde los átomos de xenón son atrapados por el red cristalina de otro compuesto. Un ejemplo es hidrato de xenón (Xe • 5,75 H 2 O), donde los átomos de xenón ocupan vacantes en un entramado de moléculas de agua. Este clatrato tiene un punto de fusión de 24 ° C. La deuterado versión de este hidrato también se ha producido. Tal hidratos clatratos pueden ocurrir naturalmente en condiciones de alta presión, como en el lago Vostok debajo de la Antártica capa de hielo. Formación del clatrato se puede utilizar para destilar fraccionadamente xenón, argón y criptón.
Xenon también puede formar compuestos fullereno endohedral, donde un átomo de xenón está atrapado dentro de una molécula de fullereno. El átomo de xenón atrapado en el fullereno se puede controlar a través de 129 Xe resonancia magnética (RMN) nuclear. Usando esta técnica, las reacciones químicas en la molécula de fullereno pueden ser analizados, debido a la sensibilidad de la desplazamiento químico del átomo de xenón a su entorno. Sin embargo, el átomo de xenón también tiene una influencia electrónica en la reactividad del fulereno.
Mientras átomos de xenón están en su estado de energía de tierra, se repelen entre sí y no formar un enlace. Cuando los átomos de xenón se energiza, sin embargo, pueden formar una excimer (dímero excitado) hasta que los electrones vuelven a la estado fundamental. Esta entidad se forma porque el átomo de xenón tiende a llenar su más externa shell electrónico, y puede hacer brevemente esto añadiendo un electrón de un átomo de xenón vecino. El tiempo de vida típico de un excimer xenón es 1.5 ns, y los libera de decaimiento fotones con longitudes de onda de alrededor de 150 y 173 nm. Xenon también puede formar excímeros con otros elementos, tales como la halógenos bromo , cloro y flúor .
Aplicaciones
Aunque xenón es rara y relativamente caro de extraer de la atmósfera de la Tierra , tiene un número de aplicaciones.
La iluminación y la óptica
Lámparas de descarga de gas
Xenón se utiliza en dispositivos emisores de luz de xenón llamadas lámparas de flash, que se utilizan en flashes fotográficos y lámparas estroboscópicas; para excitar el medio activo en láseres que luego generan luz coherente; y, ocasionalmente, en lámparas bactericidas. El primero de estado sólido láser , inventado en 1960, fue bombeado por una lámpara de flash de xenón, y el láser utilizado al poder fusión por confinamiento inercial también son bombeados por lámparas de flash de xenón.



Continuo, arco corto, alta presión lámparas de arco de xenón tienen una temperatura de color que se aproxima estrechamente la luz del sol del mediodía y se utilizan en simuladores solares. Es decir, el cromaticidad de estas lámparas se aproxima mucho a una climatizada radiador de cuerpo negro que tiene una temperatura próxima a la observada desde el dom Después de que se introdujeron por primera vez durante la década de 1940, estas lámparas comenzaron a reemplazar la vida más corta lámparas de arco de carbono en los proyectores de cine. Se emplean en típico 35 mm, IMAX y el nuevo proyectores digitales sistemas de proyección de cine, automotriz Faros HID, de gama alta linternas "tácticas" y otros usos especializados. Estas lámparas de arco son una excelente fuente de longitud de onda corta ultravioleta radiación y tienen intensas emisiones en el corto infrarrojos, que se utiliza en algunos sistemas de visión nocturna.
Las células individuales en una pantalla de plasma utilizar una mezcla de xenón y neón que se convierte en un plasma usando electrodos. La interacción de este plasma con los electrodos genera ultravioleta fotones , que luego excitar el revestimiento de fósforo en la parte frontal de la pantalla.
Xenon se utiliza como un "gas de arranque" en lámparas de sodio de alta presión. Tiene la más baja la conductividad térmica y la más baja potencial de ionización de todos los gases nobles no radiactivos. Como un gas noble, que no interfiera con las reacciones químicas que se producen en la lámpara de operación. La baja conductividad térmica minimiza las pérdidas térmicas en la lámpara mientras que en el estado de funcionamiento, y el bajo potencial de ionización hace que el tensión de ruptura del gas a ser relativamente baja en el estado frío, lo que permite que la lámpara se inicie más fácilmente.
Láseres
En 1962, un grupo de investigadores de la Laboratorios Bell descubrió la acción del láser en xenón, y más tarde se encontró que la ganancia del láser se mejoró mediante la adición de helio al medio de acción láser. La primera láser excimer utilizado un xenón dímero (Xe 2) energizado por un haz de electrones para producir emisión estimulada a una radiación ultravioleta de longitud de onda de 176 nm. Cloruro de xenón y fluoruro de xenón también se han utilizado en excimer (o, más exactamente, exciplejo) láser. El láser excimer de cloruro de xenón se ha empleado, por ejemplo, en ciertos usos dermatológicos.
Médico
Anestesia
Xenon se ha utilizado como una anestesia general. Aunque es caro, máquinas de anestesia que pueden entregar xenón están a punto de aparecer en el mercado europeo, debido a los avances en la recuperación y reciclaje de xenón han hecho que sea económicamente viable.
Xenon interactúa con muchos receptores diferentes y canales iónicos y como muchos anestésicos inhalatorios teóricamente multimodales estas interacciones es probable complementaria. Xenon es una glicina-sitio de alta afinidad Antagonista del receptor de NMDA. Sin embargo, el xenón se distingue de otros antagonistas del receptor de NMDA usados clínicamente en su falta de neurotoxicidad y la capacidad de su inhibir la neurotoxicidad de ketamina y óxido nitroso. A diferencia de la ketamina y el óxido nitroso, el xenón no estimula un flujo de salida de la dopamina núcleo accumbens. Al igual que el óxido nitroso y el xenón ciclopropano activa el canal en el dominio de potasio de dos poros TREK-1. También implicado en acciones anestésicas UNA TAREA-3 canal relacionado es insensible a xenón. Xenón inhibe los receptores nicotínicos de acetilcolina alfa4beta2 que contribuyen a la analgesia medular mediada. El xenón es un inhibidor eficaz de la membrana plasmática Ca2 + ATPasa. Xenón inhibe Ca + ATPasa mediante la unión a un poro hidrófobo dentro de la enzima y la prevención de la enzima de asumir conformaciones activas.
El xenón es un inhibidor competitivo de 5HT3 de serotonina. Aunque ni anestesia ni antinociceptivo esta actividad reduce la anestesia-emergente náuseas y vómitos.
Xenon tiene una concentración alveolar mínima (MAC) del 72% a los 40 años, por lo que es un 44% más potente que el N 2 O como anestésico. Por lo tanto, se puede utilizar en concentraciones con el oxígeno que tiene un menor riesgo de hipoxia. Desemejante el óxido nitroso (N 2 O), el xenón no es un gas de efecto invernadero y por lo que también es visto como amigable con el medio ambiente. Xenon ventila a la atmósfera está siendo devuelto a su fuente original, así que no hay impacto ambiental es probable.
Neuroprotector
Xenon induce cardioprotección robusto y neuroprotección a través de una variedad de varios mecanismos de acción. A través de su influencia en el Ca2 +, K +, KATP \ HIF y NMDA xenón antagonismo es neuroprotector cuando se administra antes, durante y después de las lesiones isquémicas. El xenón es un antagonista de alta afinidad en la glicina en el receptor NMDA site.Xenon es cardioprotector en condiciones de isquemia-reperfusión mediante la inducción de preacondicionamiento farmacológico no isquémica. El xenón es cardioprotector mediante la activación de PKC-epsilon y aguas abajo de p38-MAPK. Imita xenón neuronal precondicionamiento isquémico mediante la activación de los canales de potasio sensibles ATP. Xenon reduce alostéricamente la inhibición mediada por la activación del canal ATP independiente de la subunidad receptor1 sulfonilurea, aumentando KATP tiempo y la frecuencia de canal abierto. Xenon upregulates factor inducible por hipoxia 1 alfa (HIF1A).
Gas xenón se añadió como un ingrediente de la mezcla ventilación para un bebé recién nacido en Hospital St. Michael, de Bristol, Inglaterra, cuya vida chances fueron de otra manera muy comprometida, y fue un éxito, lo que lleva a la autorización de ensayos clínicos para casos similares. El tratamiento se realiza simultáneamente con el enfriamiento de la la temperatura corporal a 33,5 ° C.
Imaging
Emisión gamma de la radioisótopo 133 Xe de xenón se puede utilizar para la imagen el corazón, los pulmones, y el cerebro, por ejemplo, por medio de sola tomografía computarizada por emisión de fotón. 133 Xe también se ha utilizado para medir el flujo de sangre.
Xenon, particularmente hiperpolarizado 129 Xe, es un agente de contraste útil para imágenes por resonancia magnética (MRI). En la fase de gas, que se puede utilizar para la imagen del espacio vacío tales como cavidades en una muestra porosa o los alvéolos en los pulmones. Hiperpolarización hace 129 Xe mucho más detectable a través imágenes por resonancia magnética y se ha utilizado para los estudios de los pulmones y otros tejidos. Se puede utilizar, por ejemplo, para rastrear el flujo de gases dentro de los pulmones. Debido a que el xenón es soluble en agua y también en disolventes hidrófobos, que se puede utilizar para diversos tejidos blandos de vida de imagen.
Espectroscopía de RMN
Debido capa de electrones del átomo grande, flexible exterior, la RMN cambios de espectro en respuesta a las condiciones circundantes, y por lo tanto puede ser utilizado como una sonda para medir las circunstancias químicos alrededor del átomo de xenón. Por ejemplo xenón disuelve en agua, xenón disuelto en disolvente hidrófobo, y xenón asociado con ciertas proteínas se pueden distinguir por RMN.
Xenón hiperpolarizado puede ser utilizado por superficie-químicos. Normalmente, es difícil de caracterizar las superficies utilizando RMN, ya que las señales de la superficie de una muestra se verán abrumados por las señales de los de largo más numerosos núcleos atómicos en el grueso. Sin embargo, espines nucleares en superficies sólidas pueden ser polarizados de forma selectiva, por transferrering polarización de espín a ellos de gas xenón hiperpolarizado. Esto hace que las señales de superficie lo suficientemente fuertes como para medir, y los distingue de las señales a granel.
Otro
En energía nuclear aplicaciones, el xenón se utiliza en cámaras de burbujas, sondas, y en otras áreas en las que un alto peso molecular que es deseable y naturaleza inerte. Un subproducto de armas nucleares de prueba es la liberación de xenón radiactivo-133 y xenón-135. La detección de estos isótopos se utiliza para controlar el cumplimiento nuclear tratados de prohibición de pruebas, así como para confirmar las explosiones de ensayos nucleares por parte de estados como Corea del Norte .

Xenón líquido está siendo utilizado en calorímetros para las mediciones de rayos gamma, así como un medio para detectar hipotética partículas masivas de interacción débil, o WIMPs. Cuando un WIMP colisiona con un núcleo de xenón, debería, en teoría, despojar un electrón y crear una primaria de centelleo. Mediante el uso de xenón, esta explosión de energía, entonces se podía distinguir fácilmente a partir de eventos similares causados por partículas tales como los rayos cósmicos. Sin embargo, el experimento XENON en el Gran Sasso Laboratorio Nacional en Italia y el ZEPLIN-II y III-ZEPLIN experimentos en el Boulby Laboratorio Subterráneo en el Reino Unido hasta el momento no han logrado encontrar ningún WIMPs confirmados. Incluso si no se detectan WIMPs, los experimentos servirán para limitar las propiedades de la materia oscura y algunos modelos de física. El detector de corriente en la instalación de Gran Sasso ha demostrado una sensibilidad comparable a la de los mejores detectores criogénicos, y se espera la sensibilidad ser aumentado por una orden de magnitud en 2009.
Xenon es el preferido propulsor para ion propulsión de nave espacial debido a su baja por potencial de ionización peso atómico, y su capacidad para ser almacenados como un líquido a cerca de temperatura ambiente (a alta presión) aún ser fácilmente convertido de nuevo en un gas para alimentar el motor. La naturaleza inerte de xenón hace que sea amigable con el medio ambiente y menos corrosivo para un motor de iones que otros combustibles, como el mercurio o el cesio . Xenon fue utilizado por primera vez para los motores de iones satélite durante la década de 1970. Fue empleado más tarde como un propulsor para del JPL sonda Deep Space 1, de Europa SMART-1 nave espacial y para los tres motores de propulsión de iones en la NASA nave espacial Dawn.
Químicamente, los compuestos perxenate se utilizan como agentes oxidantes en la química analítica . difluoruro de xenón se usa como un reactivo de ataque para el silicio , en particular en la producción de sistemas microelectromecánicos (MEMS). El fármaco anticanceroso 5-fluorouracilo puede ser producido por reacción de difluoruro de xenón con uracilo. Xenon también se utiliza en la cristalografía de proteínas. Aplicado a presiones de 0,5 a 5 MPa (5 a 50 atm) para un cristal de proteína, átomos de xenón se unen predominantemente en cavidades hidrófobas, a menudo la creación de una alta calidad,, derivado de átomo pesado isomorfa, que puede ser utilizado para resolver el problema de la fase.
Precauciones
Muchos contiene oxígeno- compuestos de xenón son tóxicos debido a sus fuertespropiedades oxidantes y explosiva debido a su tendencia a descomponerse en el xenón plus elemental de oxígeno diatómico (O2), que contiene enlaces químicos mucho más fuertes que los compuestos de xenón.
Gas de xenón se puede mantener de manera segura en recipientes de vidrio sellado normales o de metal en temperatura y presión estándar. Sin embargo, se disuelve fácilmente en la mayoría de los plásticos y caucho, y se escapará gradualmente desde un recipiente sellado con tales materiales. El xenón es no tóxico, aunque se disuelve en la sangre y pertenece a un grupo selecto de sustancias que penetran en la barrera sangre-cerebro, causando leve a quirúrgico completo anestesia por inhalación en altas concentraciones con oxígeno.
A 169 m / s, la velocidad del sonido en el gas xenón es más lenta que en el aire debido a la velocidad media más lenta de los átomos de xenón pesados en comparación con las moléculas de nitrógeno y oxígeno. Por lo tanto, el xenón reduce las frecuencias resonantes de la tracto vocal cuando se inhala. Esto produce una característica rebajado timbre de voz, un efecto opuesto a la voz de alta timbred causada por la inhalación de helio . Al igual que el helio, xenón no satisface la necesidad del cuerpo de oxígeno. Xenon es a la vez de un simple asfixiante y un anestésico más potente que el óxido nitroso; en consecuencia, muchas universidades ya no permiten que el truco de voz como una demostración de química general. Como xenón es caro, el gas hexafluoruro de azufre, que es similar al xenón en peso molecular (146 frente a 131), se utiliza generalmente en este truco, y es un asfixiante sin ser anestésico.
Es posible respirar de forma segura gases pesados tales como xenón o hexafluoruro de azufre cuando están en una mezcla con oxígeno; el oxígeno que comprende al menos 20% de la mezcla. Xenon a una concentración de 80% junto con 20% de oxígeno produce rápidamente la inconsciencia de la anestesia general (y se ha utilizado para este, como se discutió anteriormente). La respiración se mezcla de gases de diferentes densidades muy eficaz y rápida para que los gases más pesados se purgan junto con el oxígeno, y no se acumulan en la parte inferior de los pulmones. Hay, sin embargo, el peligro asociado con cualquier gas pesado en grandes cantidades: puede sentarse de forma invisible en un recipiente, y si una persona entra en un recipiente lleno de un gas inodoro e incoloro, que puede encontrarse respirarlo sin saberlo. Xenon rara vez se utiliza en cantidades suficientemente grandes para que esto sea una preocupación, aunque el potencial de peligro existe cualquier momento un tanque o recipiente de xenón se mantiene en un espacio sin ventilación.
