
Masa molecular
Sabías ...
SOS Children, una organización benéfica educación , organizó esta selección. Infantil SOS es la mayor donación de caridad del mundo niños huérfanos y abandonados de la oportunidad de la vida familiar.
La masa molecular (abreviado Mr) de una sustancia , anteriormente también llamado peso molecular y abreviado como MW, es la masa de una molécula de esa sustancia, con relación a la unidad de masa atómica unificada u (igual a 1/12 de la masa de un átomo de carbono-12). Esto es distinto de la masa molecular relativa de una molécula, que es la relación de la masa de esa molécula a 1/12 de la masa de carbono 12 y es un número adimensional. Masa molecular relativa se abrevia con el Sr.
Definición
Existen diversas interpretaciones de esta definición. Muchos químicos utilizan masa molecular como sinónimo de masa molar , difiriendo sólo en las unidades (vea masa molecular promedio inferior). Una interpretación más estricta no equivale los dos, como la masa de una única molécula no es el mismo que el promedio de un conjunto. Un mol de moléculas pueden contener una variedad de masas moleculares debido a naturales isótopos , por lo que la masa media por lo general no es idéntica a la masa de cualquier molécula individual. La diferencia numérica real puede ser muy pequeño cuando se consideran pequeñas moléculas y la masa molecular de la isotopomer más común en cuyo caso el error sólo es importante para los físicos y un pequeño subconjunto de los químicos altamente especializados; sin embargo, siempre es más correcta, precisa y consistente de usar masa molar en los cálculos estequiométricos a granel. El tamaño de este error se vuelve mucho más grande al considerar las moléculas más grandes o menos abundantes isotopomers. La masa molecular de una molécula que pasa a contener isótopos más pesados que la molécula de promedio en la muestra puede diferir de la masa molar por varias unidades de masa.
Masa molecular media
La masa molecular media (a veces abreviado como masa media) es otra variación en el uso de la masa molecular plazo. La masa molecular media ponderada es la abundancia media (promedio) de las masas moleculares en una muestra. Esto es a menudo más cerca de lo que se quiere decir cuando "masa molecular" y "masa molar" se utilizan como sinónimos y pueden haber derivado de acortamiento de este término. La masa molecular media y la masa molar de una sustancia particular en una muestra particular, son de hecho numéricamente idénticos y se pueden interconvertir por el número de Avogadro . Cabe señalar, sin embargo, que la masa molar es casi siempre una figura calculado derivado de la pesos atómicos estándar, mientras que la masa molecular media, en los campos que necesitan el término, es a menudo una figura específica medida a una muestra. Por lo tanto, a menudo varían desde uno es teórico y el otro es experimental. Muestras específicas pueden variar significativamente de la composición isotópica de esperar debido a las desviaciones reales de la Tierra Media abundancias isotópicas.
Calcular la masa molecular
La masa molecular se puede calcular como la suma de las masas isotópicas individuales (como se encuentra en una tabla de isótopos) de todos los átomos en cualquier molécula . Esto es posible porque las moléculas son creados por las reacciones químicas que, a diferencia reacciones nucleares, tienen muy pequeña energías de unión en comparación con el masa en reposo de los átomos ( 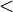 10 -9) y por lo tanto crear un defecto de masa despreciable. Tenga en cuenta que el uso de promedio masas atómicas derivan de los pesos atómicos estándar que se encuentran en una tabla periódica estándar dará como resultado una masa molecular media, mientras que la utilización de masas isotópicas dará lugar a una masa molecular coherente con la interpretación estricta de la definición, es decir, la de una sola molécula. Tenga en cuenta que cualquier molécula dada puede contener cualquier combinación dada de isótopos, lo que puede haber múltiples masas moleculares para cada compuesto químico.
10 -9) y por lo tanto crear un defecto de masa despreciable. Tenga en cuenta que el uso de promedio masas atómicas derivan de los pesos atómicos estándar que se encuentran en una tabla periódica estándar dará como resultado una masa molecular media, mientras que la utilización de masas isotópicas dará lugar a una masa molecular coherente con la interpretación estricta de la definición, es decir, la de una sola molécula. Tenga en cuenta que cualquier molécula dada puede contener cualquier combinación dada de isótopos, lo que puede haber múltiples masas moleculares para cada compuesto químico.
La medición de la masa molecular
La masa molecular también se puede medir directamente mediante espectrometría de masas . En la espectrometría de masas, la masa molecular de una molécula pequeña por lo general se presenta como el monoisotopic masa, es decir, la masa de la molécula que contiene sólo el isótopo más común de cada elemento. Tenga en cuenta que esto también difiere sutilmente de la masa molecular en que la elección de isótopos se define y por lo tanto es una sola masa molecular específico de los muchos posibles. Las masas utilizadas para calcular la masa molecular monoisotópico se encuentran en una tabla de masas isotópicas y no se encuentran en una tabla periódica típico. La masa molecular media es de uso frecuente para las moléculas más grandes ya que es poco probable que se compone exclusivamente de la isótopo más abundante de cada elemento de moléculas con muchos átomos. Una masa molecular media teórica se puede calcular utilizando la pesos atómicos estándar que se encuentran en una tabla periódica típica, ya que no es probable que sea una distribución estadística de átomos que representan los isótopos en toda la molécula. Sin embargo, esto puede diferir de la verdadera masa molecular media de la muestra debido a las variaciones naturales (o artificial) en las distribuciones isotópicas.
Ejemplo: Normal Masa Molecular frente masa molecular frente de masa molar
La masa molar de una sustancia es la masa de 1 mol (la unidad SI para la cantidad base SI cantidad de la sustancia, teniendo el símbolo n) de la sustancia. Esto tiene un valor numérico que es la masa molecular media de las moléculas en la sustancia multiplicado por la constante de Avogadro aproximadamente 6.022 * 10 23. Las unidades más comunes de masa molar son g / mol porque en esas unidades el valor numérico es igual a la masa molecular media en unidades de u.
Factor de conversión de masa molecular media de masa molar:
- masa molar = Media molecular masa * (6.022 * 10 -23 g / u) * (6.022 * 10 23 / mol)
- o
- masa molar en g / mol = masa molecular media en u
(Tenga en cuenta que estas relaciones son verdaderas para valores teóricos y experimentales, pero no entre los valores experimentales y teóricos. La masa molar es más a menudo teórica y medio de masa molecular es más a menudo experimental)
La masa atómica promedio de los recursos naturales de hidrógeno es 1,00794 u y la de naturales de oxígeno es 15,9994 u; Por lo tanto, la masa molecular de los recursos naturales de agua con la fórmula H 2 O es (2 × 1,00794 u) + u = 15,9994 18,01528 u. Por lo tanto, uno mol de agua tiene una masa de 18.01528 gramos. Sin embargo, la masa exacta de hidrógeno-1 (la más común de hidrógeno isótopo ) es 1,00783, y la masa exacta de (el isótopo más común de oxígeno) de oxígeno-16 es 15.9949, por lo que la masa de la molécula más común de agua es 18,01056 u . La diferencia de 0,00472 U o 0,03% proviene del hecho de que el agua natural contiene trazas de moléculas de agua que contienen, oxígeno-17, oxígeno-18 o hidrógeno-2 ( Deuterio) átomos. Aunque esta diferencia es trivial en los cálculos de química mayor, puede resultar en un completo fracaso en situaciones en que el comportamiento de los asuntos moléculas individuales, como en la espectrometría de masas y de la física de partículas (en donde la mezcla de isótopos no actúa como un promedio).
También hay situaciones en las que las distribuciones isotópicas no son típicos, como con agua pesada se utiliza en algunos reactores nucleares que se enriquecieron artificialmente con deuterio. En estos casos, los valores computados de masa molar y masa molecular media, que se deriva en última instancia de la pesos atómicos estándar, no será la misma que la masa molar real o masa molecular media de la muestra. En este caso la masa de deuterio es 2,0136 U y la masa molecular media de esta agua (suponiendo 100% de enriquecimiento de deuterio) es (2 × 2,0136 u) + 15,9994 20,0266 u = u. Esta es una diferencia muy grande de error del ~ 11% de la masa molecular promedio esperado basado en los pesos atómicos estándar. Además, la masa molecular más abundante es en realidad ligeramente menor que la masa molecular media ya que el oxígeno-16 sigue siendo el más común. (2 × 2,0136 u) + 15.9949 u = 20,0221 u. Aunque este es un ejemplo artificial extrema, la variación natural en las distribuciones isotópicas ocurren y son medibles.
