
Cesio
Antecedentes
Los artículos de esta selección escuelas se han organizado por tema currículo gracias a voluntarios SOS. Con Infantil SOS se puede elegir a apadrinar a los niños en más de cien países
| Cesio | ||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
55 Cs | ||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||
| Apariencia | ||||||||||||||||||||||||||||||||||
oro plateado  | ||||||||||||||||||||||||||||||||||
| Propiedades generales | ||||||||||||||||||||||||||||||||||
| Nombre, símbolo, número | cesio, Cs, 55 | |||||||||||||||||||||||||||||||||
| Pronunciación | / s yo z yo ə m / VER -zee-əm | |||||||||||||||||||||||||||||||||
| Categoría metálico | de metal alcalino | |||||||||||||||||||||||||||||||||
| Grupo, período, bloque | 1 (metales alcalinos) , 6, s | |||||||||||||||||||||||||||||||||
| Peso atómico estándar | 132.9054519 (2) | |||||||||||||||||||||||||||||||||
| Configuración electrónica | [ Xe ] 6s 1 2, 8, 18, 18, 8, 1  | |||||||||||||||||||||||||||||||||
| Historia | ||||||||||||||||||||||||||||||||||
| Descubrimiento | Robert Bunsen y Gustav Kirchhoff (1860) | |||||||||||||||||||||||||||||||||
| Primer aislamiento | Carl Setterberg (1882) | |||||||||||||||||||||||||||||||||
| Propiedades físicas | ||||||||||||||||||||||||||||||||||
| Fase | sólido | |||||||||||||||||||||||||||||||||
| Densidad (cerca rt) | 1,93 g · cm -3 | |||||||||||||||||||||||||||||||||
| Líquido densidad en mp | 1,843 g · cm -3 | |||||||||||||||||||||||||||||||||
| Punto de fusion | 301,59 K , 28,44 ° C, 83,19 ° F | |||||||||||||||||||||||||||||||||
| Punto de ebullicion | 944 K, 671 ° C, 1240 ° F | |||||||||||||||||||||||||||||||||
| Punto crítico | 1938 K, 9,4 MPa | |||||||||||||||||||||||||||||||||
| Calor de fusión | 2.09 kJ · mol -1 | |||||||||||||||||||||||||||||||||
| El calor de vaporización | 63,9 kJ · mol -1 | |||||||||||||||||||||||||||||||||
| Capacidad calorífica molar | 32.210 J · mol -1 · K -1 | |||||||||||||||||||||||||||||||||
| Presión del vapor | ||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||
| Propiedades atómicas | ||||||||||||||||||||||||||||||||||
| Estados de oxidación | 1 (Fuertemente óxido básico) | |||||||||||||||||||||||||||||||||
| Electronegatividad | 0,79 (escala de Pauling) | |||||||||||||||||||||||||||||||||
| Energías de ionización | Primero: 375.7 kJ · mol -1 | |||||||||||||||||||||||||||||||||
| Segundo: 2234,3 kJ · mol -1 | ||||||||||||||||||||||||||||||||||
| Tercero: 3400 kJ · mol -1 | ||||||||||||||||||||||||||||||||||
| Radio atómico | 265 pm | |||||||||||||||||||||||||||||||||
| Radio covalente | 244 ± 23:00 | |||||||||||||||||||||||||||||||||
| Van der Waals radio | 343 pm | |||||||||||||||||||||||||||||||||
| Miscelánea | ||||||||||||||||||||||||||||||||||
| Estructura cristalina | centrada en el cuerpo cúbico  | |||||||||||||||||||||||||||||||||
| Ordenamiento magnético | paramagnético | |||||||||||||||||||||||||||||||||
| La resistividad eléctrica | (20 ° C) 205 nΩ · m | |||||||||||||||||||||||||||||||||
| Conductividad térmica | 35.9 W · m -1 · K -1 | |||||||||||||||||||||||||||||||||
| Expansión térmica | (25 ° C) 97 m · m -1 · K -1 | |||||||||||||||||||||||||||||||||
| El módulo de Young | 1,7 GPa | |||||||||||||||||||||||||||||||||
| Módulo de volumen | 1,6 GPa | |||||||||||||||||||||||||||||||||
| Dureza de Mohs | 0.2 | |||||||||||||||||||||||||||||||||
| Dureza Brinell | 0,14 MPa | |||||||||||||||||||||||||||||||||
| Número de registro del CAS | 7440-46-2 | |||||||||||||||||||||||||||||||||
| La mayoría de los isótopos estables | ||||||||||||||||||||||||||||||||||
| Artículo principal: Los isótopos de cesio | ||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||
Cesio o cesio es un elemento químico con el símbolo de Cs y número atómico 55. Es un plateado-dorado metal blando, alcalino con un punto de 28 ° C (82 ° F), lo que hace que sea uno de los cinco metales elementales que son líquidos a la fusión (o casi) temperatura ambiente. El cesio es un metal alcalino y tiene propiedades físicas y químicas similares a las de rubidio y potasio . El metal es extremadamente reactivo y pirofórico, que reacciona con el agua, incluso a -116 ° C (-177 ° F). Es el menos elemento electronegativo que tiene un isótopo estable, cesio-133. El cesio se extrae principalmente de polucita, mientras que la radioisótopos, especialmente cesio-137, un productos de fisión, se extraen de los residuos producidos por reactores nucleares.
Dos químicos alemanes, Robert Bunsen y Gustav Kirchhoff, descubrió el cesio en 1860 por el método recientemente desarrollado de espectroscopia de llama. Las primeras aplicaciones de pequeña escala para el cesio eran como un " getter "en tubos de vacío y en células fotoeléctricas. En 1967, una frecuencia específica de la espectro de emisión de cesio-133 fue elegido para ser utilizado en la definición de la por el segundo Sistema Internacional de Unidades. Desde entonces, cesio ha sido ampliamente utilizado en los relojes atómicos.
Desde la década de 1990, la mayor aplicación del elemento ha sido tan formiato de cesio para los fluidos de perforación. Cuenta con una amplia gama de aplicaciones en la producción de electricidad, la electrónica, y en química. El isótopo radiactivo cesio-137 tiene una vida media de unos 30 años y se utiliza en aplicaciones médicas, medidores industriales, y la hidrología. Aunque el elemento es sólo ligeramente tóxico, es un producto peligroso, como un metal y sus radioisótopos presentan un alto riesgo sanitario en caso de vertido en el medio ambiente.
Características
Propiedades físicas

El cesio es un muy suave (tiene la dureza más bajo de todos los elementos, 0.2 Mohs), muy dúctil, pálido metal dorado, que se oscurece en presencia de trazas de oxígeno . Tiene un punto de fusión de 28,4 ° C (83,1 ° F), por lo que es uno de los pocos metales elementales que son líquidos cerca temperatura ambiente. El mercurio es el único metal elemental con un punto de fusión más bajo que conocida de cesio. Además, el metal tiene una bastante bajo punto de ebullición , 641 ° C (1186 ° F), la más bajo de todos los metales distintos del mercurio. Sus compuestos se queman con un color azul o violeta.

Formas de cesio aleaciones con otros metales alcalinos, así como con el oro , y amalgamas con mercurio. A temperaturas inferiores a 650 ° C (1202 ° F), aleaciones con cobalto , hierro , molibdeno , níquel , platino , tántalo o tungsteno . Se forma bien definida compuestos intermetálicos con antimonio , galio , indio y torio , que son fotosensible. Se mezcla con los otros metales alcalinos (excepto con el litio), y la aleación con un distribución molar de 41% de cesio, 47% de potasio , y 12% de sodio tiene el punto de fusión más bajo de cualquier aleación metálica conocida, a -78 ° C (-108 ° F). Unos amalgamas se han estudiado: CSHG 2 es negro con un metálico púrpura lustre, mientras que CSHG es de color dorado, también con un brillo metálico.
Propiedades químicas
Cesio metal es altamente reactivo y muy pirofórico. Además de encender espontáneamente en el aire, reacciona explosivamente con agua incluso a bajas temperaturas, más que otros miembros de la primera grupo de la tabla periódica . La reacción con agua sólida se produce a temperaturas tan bajas como -116 ° C (-177 ° F). Debido a su alta reactividad, el metal se clasifica como una material peligroso. Se almacena y enviado en hidrocarburos saturados secos, tales como aceite mineral. Del mismo modo, debe ser manejado bajo gas inerte tal como argón . Sin embargo, una explosión de agua de cesio es a menudo menos potente que una explosión -agua de sodio con una cantidad similar de sodio. Esto es porque cesio estalla instantáneamente al contacto con el agua, dejando poco tiempo para la acumulación de hidrógeno. Cesio se puede almacenar en vacío sellada vidrio de borosilicato ampollas. En cantidades de más de alrededor de 100 gramos (3,5 oz), el cesio se envía en recipientes de acero inoxidable herméticamente cerrados.
La química de cesio es similar a la de otros metales alcalinos, pero es más estrechamente similar a la de rubidio , el elemento por encima de cesio en la tabla periódica. Algunas pequeñas diferencias surgen del hecho de que tiene una mayor masa atómica y es más electropositivo que otros (no radiactivos) metales alcalinos. El cesio es el elemento químico más estable electropositivo. El ion de cesio también es más grande y menos "difícil" que los de los más ligeros metales alcalinos .
Compuestos

La gran mayoría de los compuestos de cesio contiene el elemento como el catión Cs +, que se une iónicamente a una amplia variedad de aniones . Una excepción notable es proporcionada por el caeside anión (Cs -). Otras excepciones incluyen los varios subóxidos (véase la sección sobre los óxidos de abajo).
Volviendo a los compuestos más normales, las sales de Cs + son casi invariablemente incoloro menos se colorea el propio anión. Muchas de las sales simples son higroscópico, pero menos que las correspondientes sales de los metales alcalinos más ligeros. La fosfato, acetato, carbonato , halogenuros, óxido, nitrato y sulfato de sales son solubles en agua. Sales dobles son a menudo menos soluble, y la baja solubilidad del sulfato de cesio de aluminio es explotada en la purificación de Cs de sus minerales. La sal doble con antimonio (tales como CsSbCl 4), bismuto , cadmio , cobre , hierro , y plomo también son poco soluble.
Hidróxido de cesio (CsOH) es higroscópico y una muy fuerte base. Es rápido graba la superficie de semiconductores tales como silicio . CsOH ha sido considerada previamente por los químicos como la "base fuerte", lo que refleja el relativamente débil atracción entre el gran Cs + iones y OH -.; de hecho es el más fuerte base de Arrhenius , pero un número de compuestos que no puede existir en solución acuosa, tal como n-butil-litio y amida de sodio, son más básicas.
Una mezcla estequiométrica de cesio y oro va a reaccionar para formar Auride cesio.
Complejos
Al igual que todos los cationes metálicos, Cs + forma complejos con Lewis basa en la solución. Debido a su gran tamaño, Cs + generalmente adopta números de coordinación superior a seis-coordinación, que es típico de los cationes de metales alcalinos más ligeros. Esta tendencia ya es evidente por el 8-coordinación en CsCl, vs el motivo halita adoptada por los otros cloruros de metales alcalinos. Su número de alta coordinación y suavidad (tendencia a formar enlaces covalentes) son la base de la separación de Cs + a partir de otros cationes, como se practica en la remediación de desechos nucleares, donde Cs + 137 se separa de grandes cantidades de no radiactivo K +.
Haluros
Cloruro de cesio (CsCl) cristaliza en el sencillo sistema cristalino cúbico. También llamada la "estructura de cloruro de cesio", este motivo estructural se compone de un primitiva red cúbica con una base de dos átomos, cada uno con un óctuple coordinación; los átomos de cloro se encuentran en los puntos de la red en los bordes del cubo, mientras que los átomos de cesio se encuentran en los agujeros en el centro de los cubos. Esta estructura se comparte con CsBr y CsI, y muchos otros compuestos que no contienen Cs. En contraste, la mayoría de los otros haluros alcalinos adoptan el cloruro de sodio estructura (NaCl). La estructura CsCl se prefiere porque Cs + tiene un radio iónico de 174 pm y Cl - 181 pm.
Óxidos
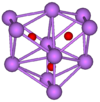
Más que los otros metales alcalinos, cesio forma numerosos compuestos binarios con oxígeno . Cuando cesio quema en el aire, el superóxido CsO 2 es el producto principal. Lo normal " óxido de cesio (Cs 2 O) forma amarillo-naranja cristales hexagonales, y es el único de óxido de la anti- CdCl tipo 2. Se vaporiza a 250 ° C (482 ° F), y se descompone al cesio metálico y el peróxido de Cs 2 O 2 a temperaturas superiores a 400 ° C (752 ° F). Aparte de la superóxido y la ozónido CsO 3, varios colores brillantes subóxidos También se han estudiado. Estos incluyen Cs 7 O, Cs 4 O, Cs 11 O 3, Cs 3 O (verde oscuro), CSO, Cs 3 O 2, así como Cs 7 O 2. Este último se puede calentar bajo vacío para generar Cs 2 O. Los compuestos binarios con azufre , selenio y teluro también existen.
Isótopos
Cesio tiene un total de 39 conocidos isótopos que van en su número de masa (es decir, número de nucleones en su núcleo) de 112 a 151. Varios de ellos se sintetizan a partir de elementos más ligeros por el proceso de captura de neutrones lentos ( S-proceso) dentro de las estrellas viejas, así como en el interior de supernova explosiones ( R-proceso). Sin embargo, la única estable isótopo es de 133 Cs, que tiene 78 neutrones . A pesar de que tiene una gran spin nuclear (7/2 +), estudios de resonancia magnética nuclear se puede hacer con este isótopo a una frecuencia de resonancia de 11,7 MHz.

El radiactivo 135 Cs tiene una vida media muy larga de alrededor de 2,3 millones de años, mientras 137 Cs y 134 Cs tienen vidas medias de 30 y dos años, respectivamente. 137 Cs se descompone a una corta vida 137m Ba por desintegración beta, y luego al bario no radiactivo, mientras que 134 Cs se transforma en 134 Ba directamente. Los isótopos con números de masa de 129, 131, 132 y 136, tienen medios tiempos entre un día y dos semanas, mientras que la mayoría de los otros isótopos tienen una vida media de unos pocos segundos a fracciones de segundo. Hay por lo menos 21 metaestable isómeros nucleares. Aparte de 134m Cs (con una vida media de poco menos de 3 horas), todos son muy inestables y decaen con vidas medias de unos pocos minutos o menos.
El isótopo 135 Cs es una de las productos de fisión de larga vida de uranio que se forman en reactores nucleares. Sin embargo, su rendimiento de los productos de fisión se reduce en la mayoría de los reactores debido a que su predecesor, 135 Xe, es un muy potente veneno de neutrones y transmuta con frecuencia a estable 136 Xe antes de que pueda decaer a 135 Cs.
Debido a su desintegración beta (a 137m Ba), 137 Cs es un fuerte emisor de la radiación gamma. Su vida media hace que sea el director productos de fisión vivido mediano junto con 90 Sr-ambos son responsables de radioactividad de el combustible nuclear gastado tras varios años de enfriamiento de hasta varios cientos de años después de su uso. Por ejemplo 137 Cs junto con 90 Sr actualmente generan la mayor fuente de radiactividad generada en el área alrededor de la catástrofe de Chernóbil . No es factible disponer de 137 Cs a través captura de neutrones (debido a la baja tasa de captura) y como resultado se le debe permitir a decaer.
Casi todos cesio producido a partir de la fisión nuclear viene de desintegración beta de origen más productos de fisión ricos en neutrones, pasando por diversos isótopos de yodo y de xenón. Debido a que el yodo y xenón son volátiles y pueden difundirse a través de combustible nuclear o el aire, el cesio radiactivo se crea a menudo lejos del lugar original de la fisión. Con el inicio de las pruebas de armas nucleares en todo 1945, 137 Cs se libera en la atmósfera y luego regresó a la superficie de la tierra como un componente de lluvia radiactiva.
Aparición

El cesio es un elemento relativamente raro ya que se estima en un promedio de aproximadamente 3 partes por millón en el La corteza terrestre. Esto la convierte en la 45a más abundante de todos los elementos, la 36ª de todos los metales. Sin embargo, es más abundante que elementos tales como antimonio, cadmio, estaño y tungsteno, y dos órdenes de magnitud más abundante que el mercurio o plata , pero 3,3% tan abundantes como el rubidio -con la que es tan estrechamente asociado químicamente.
Debido a su gran iónica radio, cesio es uno de los " elementos incompatibles ". Durante magma cristalización, cesio se concentra en la fase líquida y cristaliza pasado. Por lo tanto, los mayores depósitos de cesio son zona cuerpos de mineral de pegmatita formadas por este proceso de enriquecimiento. Debido a que el cesio no sustituye potasio tan fácilmente como lo hace el rubidio, los minerales evaporíticos alcalinos silvita (KCl) y carnalita (KMgCl 3 · 6H 2 O) puede contener sólo 0,002% de cesio. En consecuencia, Cs se encuentra en algunos minerales. Cantidades porcentuales de cesio pueden encontrar en berilo (Sea 3 Al 2 (SiO 3) 6) y Avogadrita ((K, Cs) BF 4), hasta 15% en peso de Cs 2 O en el mineral estrechamente relacionado Pezzottaite (Cs (2 Sé Li) Al 2 Si 6 O 18), hasta el 8,4% en peso de Cs 2 O en el raro mineral londonite ((Cs, K) Al 4 Be 4 (B, BE) 12 O 28), y menos en el más extendido rhodizite. El mineral única fuente económica importante para el cesio es polucita Cs (AlSi 2 O 6), que se encuentra en pocos lugares del mundo en pegmatitas zonificadas, y se asocia con las más importantes comercialmente litio minerales lepidolita y petalita. Dentro de las pegmatitas, el gran tamaño de grano y la fuerte separación de los minerales crean mineral de alta calidad para la minería.
Una de las fuentes más importantes y más ricas del mundo del metal es el Mina Tanco en Bernic Lago en Manitoba, Canadá. Los depósitos no se estima que contienen 350.000 toneladas métricas de mineral polucita, que representan más de dos tercios de la base de reserva del mundo. Aunque el contenido estequiométrico de cesio en polucita es 42,6%, las muestras polucita puros de este depósito contienen sólo alrededor del 34% de cesio, mientras que el contenido promedio es de 24% en peso. Polucita comercial contiene más del 19% de cesio. La Bikita depósito pegmatita en Zimbabwe está minada por su petalita, pero también contiene una cantidad significativa de polucita. Cantidades notables de polucita también se extraen en la Karibib Desert, Namibia . Al ritmo actual de la producción minera mundial de 5 a 10 toneladas métricas por año, las reservas durarán durante miles de años.
Producción
La extracción de mineral de polucita es un proceso selectivo y se lleva a cabo a pequeña escala en comparación con la mayoría de las operaciones de minería de metal. El mineral se tritura, ordenadas a mano, pero no suele concentrarse, y después se muele. El cesio se extrae de polucita principalmente por tres métodos: la digestión ácida, alcalina de descomposición, y de reducción directa.
En la digestión ácida, la roca polucita silicato se disolvió con ácidos fuertes tales como clorhídrico (HCl), sulfúrico (H 2 SO 4), bromhídrico (HBr), o (HF) fluorhídrico. Con ácido clorhídrico, una mezcla de cloruros solubles se produce, y las sales dobles de cloruro de cesio insoluble se precipita en forma de cloruro de antimonio de cesio (Cs 4 SBCL 7), cloruro de cesio yodo (Cs 2 ICl), o hexachlorocerate de cesio (Cs 2 (CeCl 6)). Después de la separación, la sal doble de precipitado puro se descompone, y puro CsCl se obtiene después de evaporar el agua. El método que utiliza ácido sulfúrico produce el doble sal insoluble directamente como cesio alumbre (csal (SO 4) 2 · 12H 2 O). La sulfato de aluminio en ella se convierte en el insoluble óxido de aluminio por tostación el alumbre con carbono , y el producto resultante es lixiviado con agua para producir una solución Cs 2 SO 4.
El tostado de polucita con carbonato de calcio y cloruro de calcio rendimientos silicatos de calcio insoluble y soluble de cloruro de cesio. La lixiviación con agua o diluir el amoníaco (NH 4 OH) produce entonces una solución diluida de cloruro de (CsCl). Esta solución se puede evaporar para producir cloruro de cesio o se transforma en alumbre de cesio o carbonato de cesio. Aunque la reducción no es comercialmente factible, directa del mineral con el potasio, sodio o calcio en el vacío puede producir de cesio de metal directamente.
La mayor parte de la cesio extraído (como sales) se convierte directamente en formiato de cesio (HCOO - Cs +) para aplicaciones tales como la extracción de petróleo. Para abastecer el mercado en desarrollo, Cabot Corporation construyó una planta de producción en 1997 en la mina Tanco cerca Bernic Lago en Manitoba, con una capacidad de 12.000 barriles (1,900 m3) por año de solución de formiato de cesio. Los compuestos comerciales de menor escala primaria de cesio son de cloruro de cesio y su nitrato.
Alternativamente, cesio metal puede obtenerse a partir de los compuestos purificados derivados de la mena. De cloruro de cesio, y los otros haluros de cesio, así, se pueden reducir de 700 a 800 ° C (1292 a 1472 ° F) con calcio o de bario , seguido por destilación del metal de cesio. De la misma manera, el aluminato, carbonato, hidróxido o pueden reducirse de magnesio . El metal también puede ser aislado por electrólisis de cesio fusionado cianuro (CSCN). Excepcionalmente cesio puro y libre de gas se puede hacer por la descomposición térmica a 390 ° C (734 ° F) de cesio azida CSN 3, que se produce a partir de sulfato de cesio acuoso y azida de bario. En aplicaciones de vacío, cesio dicromato puede hacerse reaccionar con zirconio metal formador de cesio puro sin otros productos gaseosos.
- Cs 2 Cr 2 O 7 + 2 Zr → 2 Cs + 2 ZrO2 + Cr 2 O 3
El precio de un 99,8% de cesio puro (del metal) en 2009 fue de alrededor de US $ 10 por gramo ($ 280 por onza), pero sus compuestos son significativamente más baratos.
Historia

En 1860, Robert Bunsen y Gustav Kirchhoff descubrió cesio en el agua mineral de Dürkheim, Alemania. Debido a las líneas azules brillantes en su espectro de emisión, que eligió un nombre derivado de la palabra caesius latín, que significa cielo azul. Cesio fue el primer elemento que se descubrió espectroscópicamente , sólo un año después de la invención de la espectroscopio por Bunsen y Kirchhoff.
Para obtener una muestra pura de cesio, 44.000 litros (9.700 imp gal; 12 000 US gal) de agua mineral tuvo que ser evaporó para producir 240 kilogramos (530 libras) de solución salina concentrada. Los metales de tierras alcalinas se precipitaron ya sea como sulfatos o oxalatos, dejando el metal alcalino en la solución. Después de la conversión a los nitratos y la extracción con etanol , se obtuvo una mezcla libre de sodio. De esta mezcla, el litio se precipitó por carbonato de amonio. El potasio, rubidio y cesio forman sales insolubles con cloroplatínico ácido, pero estas sales muestran una ligera diferencia en la solubilidad en agua caliente. Por lo tanto, el cesio y rubidio menos soluble en hexacloroplatinato ((Cs, Rb) 2 PtCl 6) podría obtenerse cristalización fraccionada. Después de la reducción de la hexacloroplatinato con hidrógeno , cesio y rubidio podría ser separados por la diferencia en la solubilidad de sus carbonatos en alcohol. El proceso dio 9,2 gramos (0,32 onzas) del cloruro de rubidio y 7,3 gramos (0,26 oz) de cloruro de cesio de los primeros 44.000 litros de agua mineral.
Los dos científicos utilizaron el cloruro de cesio así obtenida para estimar el peso atómico del nuevo elemento en 123,35 (en comparación con el actualmente aceptado uno de 132,9). Trataron de generar cesio elemental por electrólisis de cloruro de cesio fundido, pero en lugar de un metal, obtuvieron una sustancia homogénea azul, que "ni bajo el ojo desnudo ni bajo el microscopio" mostró el menor rastro de sustancia metálica ", y como resultado, asignaron como subchloride (Cs 2 Cl). En realidad, el producto era probablemente una mezcla coloidal del cloruro de metal y cesio. La electrólisis de la solución acuosa de cloruro de mercurio con un ánodo produjo una amalgama de cesio que fácilmente se descompone en las condiciones acuosas. El metal puro finalmente fue aislado por el químico alemán Carl Setterberg mientras trabajaba en su doctorado con Kekulé y Bunsen. En 1882, produjo cesio metálico por electrólisis cianuro de cesio, y evitando así los problemas con el cloruro.
Históricamente, el uso más importante para el cesio ha sido en la investigación y el desarrollo, principalmente en los campos de química y eléctrica. Existían muy pocas aplicaciones para el cesio hasta la década de 1920, cuando llegó a ser usado en la radio tubos de vacío. Tenía dos funciones; como un getter, se elimina el exceso de oxígeno después de la fabricación, y como un recubrimiento sobre la climatizada cátodo, aumentó su conductividad eléctrica. Cesio no llegó a ser reconocido como un metal industrial de alto rendimiento hasta la década de 1950. Aplicaciones de cesio radioactivo incluidos células fotoeléctricas, tubos fotomultiplicadores, componentes ópticos de espectrofotómetros de infrarrojos, catalizadores para varias reacciones orgánicas, cristales para contadores de centelleo, y, en generadores de energía magnetohidrodinámicas.
Desde 1967, la Sistema Internacional de Medidas ha basado su unidad de tiempo, el segundo, en las propiedades de cesio. El Sistema Internacional de Unidades (SI) define el segundo como 9,192,631,770 ciclos de la radiación, que corresponde a la transición entre dos hiperfina los niveles de energía de la estado fundamental del cesio-133 átomo . La 13ª Conferencia General de Pesas y Medidas de 1967 define un segundo como: "la duración de 9,192,631,770 ciclos de luz de microondas absorbidas o emitidas por la transición hiperfina de cesio-133 átomos en su estado fundamental perturbado por campos externos".
Aplicaciones
La exploración petrolera
El mayor uso final actual de cesio radiactivo se encuentra en basado formiato de cesio- fluidos de perforación para la industria petrolera extractiva. Las soluciones acuosas de formiato de cesio (HCOO - Cs +) -integrada por reacción de hidróxido de cesio con ácido fórmico -fueron desarrolló a mediados de la década de 1990 para su uso como perforación de pozos petroleros y fluidos de terminación. La función de formiato de cesio como un fluido de perforación es para lubricar las brocas, para traer detritos de la roca a la superficie, y para mantener la presión en la formación durante la perforación del pozo. Como fluido de terminación, que ayuda a la colocación de hardware de control después de la perforación, pero antes de la producción, la función de formiato de cesio es para mantener la presión.
La alta densidad de la salmuera de formiato de cesio (hasta 2,3 g · cm -3, o 19,2 libras por galón), junto con la naturaleza relativamente benigna de la mayoría de los compuestos de cesio, reduce la necesidad de sólidos de alta densidad en suspensión tóxicos en el fluido de perforación -a significativa tecnológica, la ingeniería y la ventaja medioambiental. A diferencia de los componentes de muchos otros líquidos pesados, formiato de cesio es relativamente favorable al medio ambiente. La salmuera de formiato de cesio se puede mezclar con formiatos de potasio y sodio para disminuir la densidad de los fluidos hacia abajo a la del agua (1,0 g · cm -3, o 8,3 libras por galón). Además, es biodegradable y recuperable, y puede ser reciclado, que es importante en vista de su elevado coste (aproximadamente 4.000 dólares por barril en 2001). Formiatos alcalinos son seguras de manejar y no dañan la formación productora o metales de fondo de pozo como sus alternativas corrosivo, salmueras de alta densidad (como bromuro de zinc ZnBr 2 soluciones), a veces lo hacen; también requieren menos los costos de limpieza y eliminación.
Los relojes atómicos


Basado Cesio- relojes atómicos observan transiciones electromagnéticas en el estructura hiperfina de cesio-133 átomos y utilizarlo como punto de referencia. El primer reloj de cesio precisa fue construido por Louis Essen en 1955 en el Laboratorio Nacional de Física del Reino Unido. Desde entonces, se han mejorado en varias ocasiones durante el último medio siglo, y constituyen la base para el tiempo compatible con los estándares y mediciones de frecuencia. Estos relojes de frecuencia medida con un error de 2 a 3 partes en 10 14, lo que correspondería a una exactitud de medición de tiempo de 2 nanosegundos por día, o un segundo en 1.400.000 años. Las últimas versiones tienen una precisión mejor que 1 parte en 10 15, lo que significa que estarían fuera por unos 2 segundos desde el extinción de los dinosaurios hace 65 millones de años, y ha sido considerado como "la realización más precisa de una unidad que la humanidad ha logrado todavía."
Relojes de cesio también se utilizan en las redes que supervisan el calendario de transmisiones de teléfonos celulares y el flujo de información en Internet.
Energía eléctrica y electrónica
Vapor de cesio generadores termoiónicas son dispositivos de baja potencia que convierten la energía térmica en energía eléctrica. En los dos electrodos convertidor de tubo de vacío, que neutraliza la carga espacial que se acumula cerca del cátodo, y al hacerlo, mejora el flujo de corriente.
Cesio también es importante para su propiedades fotoemisor por la cual la luz energía se convierte en el flujo de electrones. Se utiliza en células fotoeléctricas PORQUE cátodos a base de cesio como el compuesto intermetálico K 2 CSSB tienen una baja tensión de umbral para la emisión de electrones . La gama de dispositivos fotoemisora utilizando cesio incluye dispositivos de reconocimiento óptico de caracteres, tubos fotomultiplicadores, y tubos de cámara de vídeo. Sin embargo, germanio , rubidio, selenio, silicio, telurio, y varios otros elementos pueden sustituir de cesio en materiales fotosensibles.
Yoduro de cesio (CSI) bromuro (CsBr) y fluoruro de cesio (LCR) cristales se emplean para escintiladores en contadores de centelleo ampliamente utilizados en la exploración mineral y la investigación de física de partículas, ya que son muy adecuados para la detección de gamma y La radiación de rayos X. Cesio, siendo un elemento pesado, proporciona una buena potencia de frenado, lo que contribuye a una mejor detectividad. Compuestos de cesio también pueden proporcionar una respuesta más rápida (LCR) y ser menos higroscópico (CSI).
Vapor de cesio se utiliza en muchos común magnetómetros. El elemento también se utiliza como una patrón interno en espectrofotometría. Al igual que otros metales alcalinos , cesio tiene una gran afinidad por el oxígeno y se utiliza como un " getter "en tubos de vacío. Otros usos del metal incluyen alta energía láseres , lámparas de incandescencia de vapor y vapor rectificadores.
Fluidos de centrifugación
Debido a su alta densidad, las soluciones de cloruro de cesio, sulfato de cesio, y cesio trifluoroacetato (Cs (O 2 CCF 3)) se utilizan comúnmente en la biología molecular de gradiente de densidad ultracentrifugación. Esta tecnología se aplica principalmente para el aislamiento de partículas virales , subcelular orgánulos y fracciones, y ácidos nucleicos a partir de muestras biológicas.
Química y uso médico

Existen relativamente pocas aplicaciones químicas para el cesio. El dopaje con compuestos de cesio se utiliza para mejorar la eficacia de varios catalizadores de iones metálicos utilizados en la producción de productos químicos, tales como ácido acrílico, antraquinona, óxido de etileno, metanol , anhídrido ftálico, estireno, monómeros de metacrilato de metilo, y diversas olefinas . También se utiliza en la conversión catalítica de dióxido de azufre en trióxido de azufre en la producción de ácido sulfúrico .
Fluoruro de cesio disfruta uso nicho en química orgánica como base, o como una fuente anhidra de ion fluoruro. Sales de cesio sustituyen a veces sales de potasio o sodio en la síntesis orgánica, tales como ciclación, esterificación, y polimerización.
Las aplicaciones nucleares e isotópicas
El cesio-137 es una muy común radioisótopo utilizado como una gamma-emisor en aplicaciones industriales. Sus ventajas incluyen una vida media de aproximadamente 30 años, su disponibilidad a partir de la ciclo del combustible nuclear, y que tiene 137 Ba como producto final estable. La alta solubilidad en agua es una desventaja que la hace incompatible con grandes irradiadores de la piscina para alimentos y suministros médicos. Se ha utilizado en la agricultura, el tratamiento del cáncer, y el esterilización de alimentos, lodos de depuradora, y equipo quirúrgico. Radioactivo isótopos de cesio en dispositivos de radiación fueron utilizados en el campo de la medicina para tratar ciertos tipos de cáncer, pero aparición de mejores alternativas y el uso de cloruro de cesio soluble en agua en las fuentes, lo que podría crear contaminación de amplio alcance, ponen gradualmente algunas de estas fuentes de cesio usar. Cesio-137 ha sido empleado en una variedad de indicadores de medición industriales, incluyendo la humedad, densidad, nivelación, y medidores de espesor. También se ha utilizado en excavación de pozos dispositivos para medir la densidad de electrones de las formaciones rocosas, que es análoga a la densidad aparente de las formaciones.
Isótopo 137 también se ha utilizado en hidrológicos estudios análogos a los que usan tritio. Es un producto hija de reacciones de fisión nuclear. Con el inicio de las pruebas nucleares alrededor de 1945, y continuando hasta mediados de 1980, el cesio-137 se libera a la atmósfera, donde se absorbe fácilmente en solución. Conocido variación de año a año en dicho plazo permite la correlación con capas de suelo y sedimentos. Cesio-134, y en menor medida de cesio-135, también se han utilizado en hidrología como una medida de la producción de cesio por la industria de la energía nuclear. Si bien son menos frecuentes que cualquiera de cesio-133 o el cesio-137, estos isótopos tienen la ventaja de ser producido exclusivamente de fuentes antropogénicas.
Otros usos
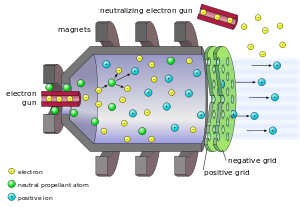
Cesio y el mercurio se utilizaron como un propulsor a principios motores de iones diseñados para propulsión espacial en misiones interplanetarias o extraplanetarios muy largas. El método de ionización era para despojar el electrón externo del propulsor al entrar en contacto con una de tungsteno electrodo que tenía voltaje aplicado. La preocupación por la acción corrosiva de cesio en los componentes de la nave espacial han empujado el desarrollo en la dirección del uso de propulsores de gas inerte como el xenón ; Esto es más fácil de manejar en pruebas en tierra y tiene menos potencial de interferir con la nave espacial. Finalmente, se utilizó xenón en la nave espacial experimental Deep Space 1 puso en marcha en 1998. Sin embargo, de emisión de campo propulsores de propulsión eléctrica que utilizan un sistema simple de acelerar iones de metales líquidos como de cesio para crear empuje se han construido.
Nitrato de cesio se utiliza como oxidante y colorante pirotécnica para quemar silicio en infrarrojos bengalas tales como la LUU-19 llamarada, porque emite gran parte de su luz en el espectro infrarrojo cercano. Cesio se ha utilizado para reducir la firma radar de penachos de escape en el Blackbird SR-71 aviones militares. Cesio, junto con rubidio, se ha añadido como un carbonato de vidrio, ya que reduce la conductividad eléctrica y mejora la estabilidad y la durabilidad de la fibra óptica y dispositivos de visión nocturna. Fluoruro de cesio o fluoruro de cesio de aluminio se utilizan en los flujos formulados para la soldadura fuerte de aluminio aleaciones que contienen magnesio .
Pronósticos
Sistemas de generación de energía magnetohidrodinámicos (MHD) fueron investigados, pero no pudieron lograr la aceptación generalizada. Cesio metal también ha sido considerado como el fluido de trabajo en alta temperatura generadores tobos eléctricos ciclo de Rankine. Sales de cesio han sido evaluadas como reactivos antishock para ser utilizado después de la administración de medicamentos arsenicales. Debido a su efecto sobre el ritmo cardíaco, sin embargo, son menos propensos a ser utilizado de sales de potasio o rubidio. Ellos también se han utilizado para tratar la epilepsia .
Riesgos para la salud y seguridad

Compuestos de cesio se encuentran raramente por la mayoría de la gente, pero la mayoría son ligeramente tóxico debido a la similitud química de cesio de potasio . La exposición a grandes cantidades de compuestos de cesio puede causar hiperirritabilidad y espasmos, pero como esas cantidades no serían normalmente se encuentran en las fuentes naturales, cesio no es uno de los principales contaminantes del medio ambiente químico. La mediana dosis letal (LD 50 valor) de cloruro de cesio en ratones es de 2.3 g por kilogramo, que es comparable a los LD 50 valores de cloruro de potasio y cloruro de sodio .
| NFPA 704 |
|---|
 3 4 3 |
| La diamante fuego signo de peligro para el cesio metálico |
Cesio metal es uno de los elementos más reactivos y es altamente explosivo cuando entra en contacto con el agua. El gas de hidrógeno producido por la reacción se calienta por la energía térmica liberada al mismo tiempo, causando la ignición y una violenta explosión. Esto puede ocurrir con otros metales alcalinos, pero el cesio es tan potente que esta reacción explosiva incluso puede ser activado por agua fría. La temperatura de autoignición del cesio es también -116 o C, por lo que es altamente pirofórico y se enciende de forma explosiva en el aire para formar hidróxido de cesio y diversos óxidos. Hidróxido de cesio es un muy fuerte base y se corroe rápidamente vidrio.
Los isótopos 134 y 137 están presentes en la biosfera en pequeñas cantidades por las actividades humanas y representan una carga radiactividad que varía dependiendo de la ubicación. Cesio radiactivo no se acumula en el cuerpo tan eficazmente como muchos otros productos de fisión (tales como yodo radiactivo y radiostrontium). Alrededor del 10% de los lavados radiocesio absorbidos fuera del cuerpo relativamente rápido en el sudor y la orina. El 90% restante tiene una vida media de entre 50 y 150 días. Cesio radiactivo sigue potasio y tiende a acumularse en los tejidos vegetales, incluyendo frutas y verduras. También está bien documentado que los hongos de los bosques contaminados acumulan cesio radiactivo (cesio-137) en sus hongos esporocarpos. La acumulación de cesio-137 en los lagos ha sido una gran preocupación después de la catástrofe de Chernobyl . Los experimentos con perros mostraron que una dosis única de 3,8 milicurios (140 MBq, 4,1 g de cesio-137) por kilogramo es letal dentro de tres semanas; cantidades más pequeñas pueden causar infertilidad y el cáncer. La Agencia Internacional de Energía Atómica y otras fuentes han advertido de que los materiales radiactivos, como el cesio-137, podrían utilizarse en dispositivos de dispersión radiológica, o " bombas sucias ".
