
Reacci??n ??cido-base
Antecedentes
Esta selecci??n Wikipedia est?? disponible sin conexi??n de SOS Children para su distribuci??n en el mundo en desarrollo. SOS Children ha cuidado de ni??os en ??frica durante cuarenta a??os. ??Puedes ayudar a su trabajo en ??frica ?
| ??cidos y Bases |
|---|
| Constante de disociaci??n del ??cido Extracci??n ??cido-base Reacci??n ??cido-base Valoraci??n ??cido-base Constante de disociaci??n Funci??n de acidez Soluciones tamp??n pH Afinidad prot??nica Auto-ionizaci??n del agua La fuerza del ??cido |
| ??cido tipos |
| Br??nsted ?? Lewis ?? Mineral Org??nica ?? Fuerte Super??cidos ?? D??bil |
| Los tipos base |
| Br??nsted ?? Lewis ?? Org??nico Fuerte ?? Superbases No nucle??fila ?? D??bil |
Una reacci??n ??cido-base es una reacci??n qu??mica que se produce entre un ??cido y una base. Existen varios conceptos que proporcionan definiciones alternativas para los mecanismos de reacci??n involucrados y su aplicaci??n en la soluci??n de problemas relacionados. A pesar de varias similitudes en las definiciones, su importancia se hace evidente como diferentes m??todos de an??lisis cuando se aplica a reacciones ??cido-base de especies gaseosas o l??quidas, o cuando el ??cido o la base de caracteres puede ser algo menos evidente. Hist??ricamente, el primero de estos conceptos cient??ficos de ??cidos y bases fueron provistos por el franc??s qu??mico Antoine Lavoisier , alrededor de 1776 .
Teor??as ??cido-base com??n
Definici??n Lavoisier
Dado que el conocimiento de Lavoisier de ??cidos fuertes estaba restringido principalmente a oxi??cidos, que tienden a contener ??tomos centrales en alto estados de oxidaci??n rodeados de ox??geno, tales como HNO 3 y H 2 SO 4 , y ya que no estaba al tanto de la verdadera composici??n de los ??cidos hidr??cidos, HCl, HBr y HI, se definen los ??cidos en t??rminos de su contenga ox??geno , lo que a su hecho que llam?? de las palabras griegas que significan "??cido-ex" (del griego οξυς (oxys) que significa "??cido" o "fuerte" y γεινομαι (geinomai) o "engendrar"). La definici??n Lavoisier se celebr?? como una verdad absoluta para m??s de 30 a??os, hasta que el art??culo 1810 y conferencias posteriores por Sir Humphry Davy en la que demostraron la falta de ox??geno en H 2 S, H 2 Te, y el ??cidos hidr??cidos halogenados.
Definici??n Liebig
Esta definici??n fue propuesta por Justus von Liebig circa 1838 , basado en su extensa obra sobre la composici??n qu??mica de ??cidos org??nicos. Esto termin?? el cambio doctrinal de ??cidos a base de ox??geno a los ??cidos basados en el hidr??geno, iniciada por Davy. Seg??n Liebig, un ??cido es una sustancia que contiene hidr??geno en la que el hidr??geno podr??a ser sustituido por un metal. Definici??n de Liebig, mientras completamente emp??rica, se mantuvo en uso durante casi 50 a??os, hasta la adopci??n de la definici??n de Arrhenius.
Definici??n de Arrhenius

La definici??n de Arrhenius de las reacciones ??cido-base es un concepto ??cido-base m??s simplificada ideado por Svante Arrhenius, que se utiliza para proporcionar una definici??n moderna de bases que sigui?? de su trabajo con Friedrich Wilhelm Ostwald en el establecimiento de la presencia de iones en soluci??n acuosa, en 1884 , y llev?? a Arrhenius recibir el Premio Nobel de Qu??mica en 1903 por el "reconocimiento de los extraordinarios servicios ... prestado al avance de la qu??mica por su teor??a de la disociaci??n electrol??tica"
Tal como se define en el momento del descubrimiento, reacciones ??cido-base se caracterizan por los ??cidos de Arrhenius, que disociar en forma de soluci??n acuosa de hidr??geno o llamado m??s tarde, el oxonio (H 3 O +) iones, y las bases de Arrhenius que forman hidr??xido (OH -) iones. M??s reciente Recomendaciones de la IUPAC sugieren ahora el nuevo t??rmino "hidronio" se utilizar?? en favor del t??rmino aceptado "oxonio" m??s para ilustrar los mecanismos de reacci??n, tales como los definidos en la definici??n del sistema de disolvente de Br??nsted-Lowry y m??s claramente, con la definici??n de Arrhenius que sirve como una simple esquema general de car??cter ??cido-base m??s sucintamente, la definici??n de Arrhenius se puede conjeturar como;
| " | ??cidos de Arrhenius forman iones hidr??geno en soluci??n acuosa con bases de Arrhenius forman iones hidr??xido. | " |
La definici??n ??cido-base acuosa universal del concepto de Arrhenius se describe como la formaci??n de agua a partir de hidr??geno y iones hidr??xido o iones hidronio y iones hidr??xido producido a partir de la disociaci??n de un ??cido y la base en soluci??n acuosa (2 H 2 O → OH - + H 3 O +), que conduce a la definici??n de Arrhenius que en reacciones ??cido-base, se forma una sal y el agua de la reacci??n entre un ??cido y una base - en las definiciones cient??ficas m??s simples, esta forma de reacci??n se llama una Reacci??n de neutralizaci??n.
- + ??cido + base - → sal + agua
El ion positivo de una base puede formar una sal con el ion negativo de un ??cido. Por ejemplo, dos moles de la base de hidr??xido de sodio (NaOH) se pueden combinar con un mol de ??cido sulf??rico (H 2 SO 4) para formar dos moles de agua y un mol de sulfato de sodio .
- 2NaOH + H 2 SO 4 → 2 H2O + Na 2 SO 4
Definici??n de Br??nsted-Lowry
La definici??n de Br??nsted-Lowry, formulado de forma independiente por sus dos defensores Johannes Nicolaus Br??nsted y Martin Lowry en 1923 se basa en la idea de protonaci??n de bases a trav??s de la de-protonaci??n de ??cidos - m??s com??nmente conocida como la capacidad de los ??cidos a "donar" iones hidr??geno (H +) o protones a las bases, que "aceptar" de ellos. En contraste con la definici??n de Arrhenius, la definici??n de Br??nsted-Lowry se refiere a los productos de una reacci??n ??cido-base como ??cidos y bases conjugadas para referirse a la relaci??n de un prot??n, y para indicar que se ha producido una reacci??n entre las dos cantidades, en lugar de una "formaci??n" de sal y agua, como se explica en la definici??n de Arrhenius.
Se define que en las reacciones, no es la donaci??n y la recepci??n de un prot??n, que se refiere esencialmente a la eliminaci??n de un ion hidr??geno unido dentro de un compuesto y su reacci??n con otro compuesto, y no de la eliminaci??n de un prot??n del n??cleo de un ??tomo , lo que requerir??a enormes cantidades de energ??a no alcanzables a trav??s del simple disociaci??n de ??cidos. En la diferenciaci??n de la Definici??n de Arrhenius, la definici??n de Br??nsted-Lowry postula que para cada ??cido, no es un ??cido conjugado y la base o "par ??cido-base conjugada" que se forma a trav??s de una reacci??n completa, que tambi??n incluye agua, que es anf??tero:
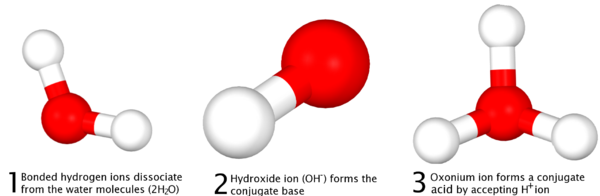
|
Definici??n de Lewis
La definici??n de Lewis de las reacciones ??cido-base, ideado por Gilbert N. Lewis en 1923 es una teor??a abarca a las definiciones de Br??nsted-Lowry y del sistema disolvente con respecto a la premisa de un mecanismo de donaci??n, que atribuye a la inversa de la donaci??n de pares de electrones a partir de bases y la aceptaci??n por los ??cidos, en lugar de protones o otras sustancias y abarca tanto las reacciones acuosas y no acuosas unidas.
- Ag + + 2: NH3 → [H 3 N: Ag: NH 3] +
- Un cati??n plata reacciona como un ??cido con amoniaco que act??a como un donante de par de electrones, formando un aducto de amoniaco y plata
En reacciones entre ??cidos de Lewis y bases, se produce la formaci??n de un aducto cuando el ocupado m??s alto molecular orbital ( HOMO) de una mol??cula, tal como NH 3 con un par de electrones solitario disponible (s) dona pares solitarios de electrones de la mol??cula deficiente en electrones molecular desocupado m??s bajo orbital ( LUMO) a trav??s de una enlace covalente coordinado; en tal reacci??n, la mol??cula que interact??a con HOMO act??a como una base, y la mol??cula de interacci??n LUMO act??a como un ??cido. En las mol??culas altamente polares, tales como el boro Tri-fluoruro (BF 3), el m??s elemento electronegativo tira de electrones hacia sus propios orbitales, proporcionando una carga m??s positiva sobre el elemento menos electronegativo-y una diferencia en su estructura electr??nica debido a la posiciones axial o ecuatorial en ??rbita de sus electrones, causando efectos repulsivos de par solitario par de uni??n (Lp -Bp) las interacciones entre ??tomos unidos por encima de las ya previstas por par Bonding lazos de pareja (Bp-BP) interacciones. Aductos que implican iones met??licos se conocen como compuestos de coordinaci??n.
Definici??n-sistema de disolvente
Esta definici??n se basa en una generalizaci??n de la anterior definici??n de Arrhenius a todos los disolventes autodissociating. En todos estos disolventes hay una cierta concentraci??n de una especie positivas, cationes solvonium y especies negativas, aniones solvato, en equilibrio con las mol??culas de disolvente neutros. Por ejemplo:
- 2H 2 O ⇌ H 3 O + ( hidronio) + OH - ( hidr??xido )
- 2NH 3 ⇌ NH 4 + ( amonio) + NH 2 - ( amida)
o incluso algunos sistemas apr??ticos
- N 2 O 4 ⇌ NO + ( nitrosonio) + NO 3 - ( nitrato )
- 2SbCl 3 ⇌ SBCL 2 + (dichloroantimonium) + SBCL 4 - (tetrachloroantimonate)
Un soluto causando un aumento en la concentraci??n de los iones solvonium y una disminuci??n de los iones de solvato es un ??cido y una causando la inversa es una base. Por lo tanto, en el l??quido de amon??aco , KNH 2 (el suministro de NH 2 -) es una base fuerte, y NH 4 NO 3 (suministro de NH 4 +) es un ??cido fuerte. En l??quido di??xido de azufre (SO 2), compuestos de tionilo (suministro de SO 2 +) se comportan como ??cidos, y sulfitos (que suministran SO 3 2-) se comportan como bases.
Estas son algunas de las reacciones ??cido-base no acuosas en amon??aco l??quido
- 2NaNH 2 (base) + Zn (NH 2) 2 ( amida anf??fila) → Na 2 [Zn (NH 2) 4]
- 2NH 4 I (??cido) + Zn (NH 2) 2 ( amida anf??fila) → [Zn (NH3) 4)] I 2
El ??cido n??trico puede ser una base en ??cido sulf??rico l??quido:
- HNO 3 (base) + 2H 2 SO 4 → NO 2 + + H 3 O + + 2HSO 4 -
Y las cosas se vuelven a??n m??s extra??o en el mundo apr??tico, por ejemplo, en N2 l??quido O 4:
- AgNO3 (base) + NOCl (??cido) → N 2 O 4 + AgCl
Desde definici??n-sistema de disolvente depende del disolvente, as?? como en el propio compuesto, el mismo compuesto puede cambiar su funci??n dependiendo de la elecci??n del disolvente. Por lo tanto, HClO 4 es un ??cido fuerte en agua, un ??cido d??bil en ??cido ac??tico, y una base d??bil en ??cido fluorosulf??nico.
Otras teor??as ??cido-base
Definici??n Usanovich
La definici??n m??s general es que de la qu??mico ruso Mikhail Usanovich, y b??sicamente se puede resumir como la definici??n de un ??cido como cualquier cosa que acepta especies negativas o dona los positivos, y una base como a la inversa. Esto tiende a superponerse el concepto de redox (oxidaci??n-reducci??n), y as?? no es altamente favorecida por los qu??micos. Esto se debe a las reacciones redox se centran m??s en los procesos de transferencia de electrones f??sicos, en lugar de la toma de bonos / procesos de bonos romper, aunque la distinci??n entre estos dos procesos es un tanto ambigua.
Definici??n Lux-Flood
Esta definici??n, propuesta por el qu??mico alem??n Hermann Lux en 1939 , mejor?? a??n m??s por Circa H??kon Flood 1947 y ahora se utiliza com??nmente en la moderna geoqu??mica y electroqu??mica de sales fundidas, describe un ??cido como un aceptor de iones ??xido y una base como un donador de iones ??xido. Por ejemplo:
- MgO (base) + CO2 (??cido) → MgCO3
- CaO (base) + SiO2 (??cido) → CaSiO3
- NO 3 - (base) + S 2 O 7 2- (??cido) → NO 2 + + 2SO 4 2-
Definici??n Pearson
En 1963 Ralph Pearson propuso un concepto cualitativo avanzado conocido como Principio duro Base ??cido suave, m??s tarde hizo cuantitativa con ayuda de Robert Parr en 1984 . 'Hard' se aplica a las especies que son peque??os, tienen estados de alta carga, y son d??bilmente polarizables. 'Suave' se aplica a las especies que son grandes, tienen estados de baja carga y est??n fuertemente polarizable. ??cidos y bases interact??an y las interacciones m??s estables son duro duro y blando-blando. Esta teor??a ha encontrado uso en la qu??mica org??nica e inorg??nica.

