
De metal alcalino
Acerca de este escuelas selección Wikipedia
SOS cree que la educación da una mejor oportunidad en la vida para los niños en el mundo en desarrollo también. Madres SOS cada aspecto después de un una familia de niños apadrinados .
| Metales alcalinos | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ↓ Período | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 2 |  3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 3 |  11 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 4 |  19 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 5 |  37 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 6 |  55 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 7 | Francio (Fr) 87 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Leyenda
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Los metales alcalinos son una grupo en la tabla periódica que consiste en el elementos químicos de litio (Li), sodio (Na), potasio (K), rubidio (Rb), cesio (Cs), y francio (Fr). Este grupo se encuentra en el s-bloque de la tabla periódica como todos los metales alcalinos tienen su electrón más exterior en una s-orbital. Los metales alcalinos proporcionan el mejor ejemplo de tendencias de grupo en las propiedades de la tabla periódica, con elementos que exhiben bien caracterizados comportamiento homóloga.
Los metales alcalinos tienen propiedades muy similares: son todo brillante, suave, altamente metales reactivos en temperatura y presión estándar y fácilmente pierden su electrón más exterior para formar cationes con carga 1. Todos ellos se pueden cortar fácilmente con un cuchillo debido a su suavidad, exponiendo una superficie brillante que empaña rápidamente en el aire debido a la oxidación. Debido a su alta reactividad, deben ser almacenadas bajo aceite para evitar la reacción con el aire, y se encuentran naturalmente sólo en sales y nunca como el elemento libre. En el moderno Nomenclatura de la IUPAC, los metales alcalinos comprenden el grupo 1 elementos, excepto el hidrógeno (H), que nominalmente es un elemento del grupo 1, pero normalmente no se considera un metal alcalino, ya que rara vez exhibe un comportamiento comparable a la de los metales alcalinos. Todos los metales alcalinos reaccionan con el agua, con los metales alcalinos pesados reaccionar con más fuerza que los más ligeros.
Todos los metales alcalinos descubiertas ocurren en la naturaleza: con el fin de abundancia, el sodio es el más abundante, seguido de potasio, litio, rubidio, cesio, francio y, finalmente, que es muy raro debido a su extremadamente alto radiactividad y por lo tanto se produce sólo en traza debido a su presencia en naturales cadenas de desintegración. Se han realizado experimentos para intentar la síntesis de Ununennio (Uue), que es probable que sea el próximo miembro del grupo, pero todos se han reunido con el fracaso a partir de 2012. Sin embargo, Ununennio puede no ser un metal alcalino debido a efectos relativistas, que se predice que tienen una gran influencia sobre las propiedades químicas de elementos superpesados; incluso si no llegar a ser un metal alcalino, se predice que tienen algunas diferencias en las propiedades físicas y químicas de sus homólogos más ligeros.
La mayoría de los metales alcalinos tienen muchas aplicaciones diferentes. Dos de las aplicaciones más conocidas de los elementos puros son rubidio y cesio relojes atómicos, de los cuales los relojes atómicos de cesio son la representación más exacta de tiempo conocido como de 2013. Una aplicación común de los compuestos de sodio es el lámpara de vapor de sodio, que emite luz muy eficiente. La sal de mesa, o cloruro de sodio, se ha utilizado desde la antigüedad. El sodio y el potasio son también elementos esenciales, que tienen importantes funciones biológicas como electrolitos, y aunque los otros metales alcalinos no son esenciales, también tienen diferentes efectos en el cuerpo, tanto beneficiosos como perjudiciales.
Características
Químico

Al igual que otros grupos, los miembros conocidos de este espectáculo familiar patrones en su configuración electrónica, especialmente las capas exteriores, dando lugar a las tendencias en el comportamiento químico:
| Z | Elemento | No. de electrones / shell | Electrón configuración |
|---|---|---|---|
| 3 | litio | 2, 1 | [ Él ] 2s 1 |
| 11 | sodio | 2, 8, 1 | [ Ne ] 3s 1 |
| 19 | potasio | 2, 8, 8, 1 | [ Ar ] 4s 1 |
| 37 | rubidio | 2, 8, 18, 8, 1 | [ Kr ] 5s 1 |
| 55 | cesio | 2, 8, 18, 18, 8, 1 | [ Xe ] 6s 1 |
| 87 | francio | 2, 8, 18, 32, 18, 8, 1 | [ Rn ] 7s 1 |
La mayor parte de la química se ha observado sólo en los primeros cinco miembros del grupo. La química de francio no está bien establecida debido a su extrema radiactividad; Por lo tanto, la presentación de sus propiedades aquí es limitado.
Todos los metales alcalinos son altamente reactivos y nunca se encuentran en formas elementales en la naturaleza. Debido a esto, normalmente se almacenan en aceite mineral o queroseno (aceite de parafina). Ellos reaccionan agresivamente con los halógenos para formar el haluros de metales alcalinos, que son blanco compuestos cristalinos iónicos que son todos solubles en agua, con excepción fluoruro de litio ( Li F ). Los metales alcalinos también reaccionan con agua para formar fuertemente alcalinas hidróxidos y por lo tanto deben manejarse con mucho cuidado. Los metales alcalinos pesados reaccionan con más fuerza que los más ligeros; por ejemplo, cuando cae en el agua, cesio produce una explosión más grande que potasio. Los metales alcalinos tienen el más bajo primero energías de ionización en sus respectivos periodos de la tabla periódica , debido a su baja carga nuclear efectiva y la capacidad de alcanzar un gas noble configuración por la pérdida de un solo electrón . La segunda energía de ionización de todos los metales alcalinos es muy alta, ya que es en una cáscara completo que también está más cerca del núcleo; por lo tanto, casi siempre se pierden un solo electrón, formando cationes. La alkalides son una excepción: son compuestos inestables que contienen metales alcalinos en un estado de oxidación -1, que es muy inusual, ya antes del descubrimiento de los alkalides, no se esperaba que los metales alcalinos para ser capaz de formar aniones y se pensaba que eran capaces a aparecer en sales sólo como cationes. Los aniones alkalide han llenado -subniveles s, lo que les da una mayor estabilidad y permite que existan. Todos los metales alcalinos estables excepto litio se sabe que son capaces de formar alkalides, y los alkalides tienen mucho interés teórico debido a su inusual estequiometría y baja los potenciales de ionización. Alkalides son químicamente similares a la electrides, que son sales con atrapados electrones que actúa como aniones. Un ejemplo particularmente llamativo de un alkalide es "inversa hidruro de sodio ", H + Na -, en comparación con el hidruro de sodio habitual, Na + H -: es inestable en el aislamiento, debido a su alta energía resultante del desplazamiento de dos electrones de hidrógeno al sodio, aunque varios derivados se predijeron ser metaestable o estable.
La química de litio muestra varias diferencias con la del resto del grupo como el pequeño catión Li + polariza aniones y da sus compuestos a más carácter covalente. El litio y el magnesio tienen una relación diagonal: debido a esto, el litio tiene algunas similitudes con el magnesio. Por ejemplo, el litio se forma un establo nitruro, una propiedad común entre todos los metales alcalinotérreos (grupo de magnesio), pero único entre los metales alcalinos. Además, entre sus respectivos grupos, única forma de litio y magnesio covalente compuestos organometálicos (por ejemplo, Li Yo y MgMe 2). El fluoruro de litio es el único haluro de metal alcalino que no es soluble en agua, y hidróxido de litio es el único hidróxido de metal alcalino que no es delicuescente. Francio también se predice muestran algunas diferencias debido a su alto peso atómico, causando sus electrones para viajar a considerables fracciones de la velocidad de la luz y por lo tanto hacer efectos relativistas más prominente. En contraste con la tendencia a la disminución electronegatividades y energías de ionización de los metales alcalinos, electronegatividad y la energía de ionización de francio se prevé que ser más alto que el de debido a la estabilización relativista de los electrones 7s de cesio; También, su Se espera que el radio atómico anormalmente bajas.
Los compuestos y reacciones
La reacción con agua (hidróxidos de metales alcalinos)

Todos los metales alcalinos reaccionan vigorosamente o explosivamente con agua fría, produciendo una solución acuosa de la fuertemente de metal alcalino básico de hidróxido y el gas de hidrógeno de liberación. Esta reacción se hace más vigorosa va por el grupo: litio reacciona de manera constante con efervescencia, pero el sodio y el potasio pueden encender y rubidio y cesio hundirse en el agua y generar gas de hidrógeno tan rápidamente que las ondas de choque se forman en el agua que pueda romperse recipientes de vidrio. Cuando un metal alcalino se deja caer en el agua, produce una explosión, de los cuales hay dos etapas separadas. El metal reacciona con el agua primero, rompiendo los enlaces de hidrógeno en el agua y la producción de hidrógeno gas; Esto tiene lugar más rápido para los metales alcalinos más pesados más reactivos. En segundo lugar, el calor generado por la primera parte de la reacción a menudo enciende el gas de hidrógeno, causando que se queme de forma explosiva en el aire circundante. Esta explosión de gas de hidrógeno secundaria produce la llama visible encima de la taza de agua, lago u otro cuerpo de agua, no la reacción inicial del metal con agua (que tiende a suceder en su mayoría bajo el agua).
La reacción química de los metales alcalinos con agua es:
- 2 M (s) + 2 H 2 O (l) → 2 MOH (aq) + H 2 (g) (donde M representa un metal alcalino)
La reacción con nitrógeno (nitruros de metales alcalinos)

El litio, el más ligero de los metales alcalinos, es el único metal alcalino que reacciona con el nitrógeno al condiciones estándar, y su nitruro es la única de nitruro de metal alcalino estable. El nitrógeno es un gas no reactivo debido a romper el fuerte triple enlace en el dinitrógeno molécula (N 2) requiere una gran cantidad de energía. La formación de un nitruro de metal alcalino se consume la energía de ionización del metal alcalino (formando iones M +), la energía requerida para romper el triple enlace en N 2 y la formación de N 3- iones, y toda la energía liberada de la formación de un nitruro de metal alcalino es de la energía reticular del nitruro de metal alcalino. La energía reticular se maximiza con iones pequeños, altamente cargadas; los metales alcalinos no forman iones altamente cargados, sólo la formación de iones con una carga de 1, por lo que sólo el litio, el metal alcalino más pequeño, se puede liberar suficiente energía reticular para hacer la reacción con nitrógeno exotérmica, formando nitruro de litio. Las reacciones de los otros metales alcalinos con nitrógeno no liberan suficiente energía reticular y serían así endotérmica, por lo que no forman nitruros en condiciones estándar. ( Nitruro de sodio (Na 3 N) y nitruro de potasio (K 3 N), mientras existente, son extremadamente inestables, siendo propensos a la descomposición de nuevo en sus elementos constitutivos, y no puede ser producido por reacción de los elementos entre sí en condiciones estándar).
La reacción química de litio con nitrógeno es:
- 6 Li (s) + N 2 (g) → 2 Li 3 N (s)
La reacción con oxígeno (óxidos de metal alcalino)
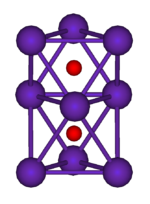 | 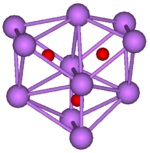 | |
Rb 9 O 2 clúster, compuesta de dos regulares octaedros conectados entre sí por una cara | Cs 11 O 3 agrupación, compuesta de tres octaedros regulares donde cada octaedro está conectado al tanto de los demás por una cara cada uno. Los tres octaedros tienen una arista en común. |
Todos los metales alcalinos reaccionan vigorosamente con el oxígeno en condiciones normales. Se forman varios tipos de óxidos, tales como sencillo óxidos (que contienen el ion O 2-), peróxidos (que contiene el O 2-
2 iónico, donde hay una enlace sencillo entre los dos átomos de oxígeno), superóxidos (que contiene la O -
2 de iones), y muchos otros. Litio quema en el aire para formar óxido de litio, pero el sodio reacciona con el oxígeno para formar una mezcla de óxido de sodio y peróxido de sodio. El potasio se forma una mezcla de peróxido de potasio y superóxido de potasio, rubidio y cesio, mientras que forman la superóxido exclusivamente. Sus reactividad aumenta bajando el grupo: mientras que el litio, el sodio y el potasio simplemente queman en el aire, rubidio y cesio son pirofórico (inflaman espontáneamente en el aire).
Los metales alcalinos más pequeñas tienden a polarizar los aniones más complejas (el peróxido y superóxido), debido a su pequeño tamaño. Esto atrae a los electrones en los más complejos aniones hacia uno de sus átomos de oxígeno constituyentes, formando un ion de óxido y un átomo de oxígeno. Esto causa de litio para formar el óxido exclusivamente en reacción con el oxígeno a temperatura ambiente. Este efecto se vuelve drásticamente más débil para el más grande de sodio y potasio, lo que les permite formar los peróxidos menos estables. Rubidio y cesio, en la parte inferior del grupo, son tan grandes que incluso los superóxidos menos estables pueden formar. Debido a que la superóxido libera más energía cuando se forman, la superóxido se forma preferentemente por los metales alcalinos más grandes donde los aniones más complejas no están polarizados. (Los óxidos y peróxidos de estos metales alcalinos existen, pero no se forman por reacción directa del metal con el oxígeno en condiciones normales.)
La reacción química de los metales alcalinos con el oxígeno que forma el óxido es:
- 4 M (s) + O 2 (g) → 2 M 2 O (s) (donde M representa un metal alcalino)
La reacción química que forma el peróxido es:
- 2 M (s) + O 2 (g) → M 2 O 2 (s) (donde M representa un metal alcalino)
La reacción química que forma el superóxido es:
- M (s) + O 2 (g) → MO 2 (s) (donde M representa un metal alcalino)
Rubidio y cesio pueden formar incluso óxidos más complicados que los superóxidos. Rubidio puede formar Rb 6 O y Rb 9 O 2 tras la oxidación en el aire, mientras que el cesio forma una inmensa variedad de óxidos, tales como el ozónido CsO 3 y varios colores brillantes subóxidos, tales como Cs 7 O, Cs 4 O, Cs 11 O 3, Cs 3 O (verde oscuro), CSO, Cs 3 O 2, así como Cs 7 O 2. Este último se puede calentar bajo vacío para generar Cs 2 O.
La reacción con los halógenos (haluros de metales alcalinos)

Los metales alcalinos son de los más elementos electropositivos en la tabla periódica y por lo tanto tienden a enlace iónicamente a la más elementos electronegativos en la tabla periódica, los halógenos , que forman sales conocidas como los haluros de metales alcalinos. Esto incluye cloruro de sodio , también conocido como sal común. La reactividad se hace más alta de litio al cesio y cae de flúor al yodo . Todos los haluros de metales alcalinos tienen la fórmula MX, donde M es un metal alcalino y X es un halógeno. Todos ellos son sólidos cristalinos blancos iónicos. Todos los haluros de metal alcalino son solubles en agua a excepción de fluoruro de litio (LiF), que es insoluble en agua debido a su muy alto entalpía de celosía. La alta entalpía reticular de fluoruro de litio es debido a los pequeños tamaños de los Li + y F - iones, haciendo que las interacciones electrostáticas entre ellas que ser fuerte.
La reacción química de los metales alcalinos con los halógenos es:
- 2 M + X 2 → 2 MX (donde M representa un metal alcalino y X representa un halógeno)
Físico
Los metales alcalinos son, excepto para el cesio, que tiene un tinte dorado todo color plata. Todos son suaves y tienen bajas densidades , puntos de fusión y puntos de ebullición .
La tabla siguiente es un resumen de las propiedades físicas y atómicas clave de los metales alcalinos. Los datos señalados con signos de interrogación son o incierto o se basan en estimaciones parcialmente tendencias periódicas en lugar de observaciones.
| De metal alcalino | Estándar peso atomico ( u) | Punto de fusion | Punto de ebullicion | Densidad (G / cm 3) | Electronegatividad ( Pauling) | Primero energía de ionización ( kJ · mol -1) | Radio atómico ( pm) | Prueba de color de llama | |
|---|---|---|---|---|---|---|---|---|---|
| Litio | 6,94 (1) | 453,69 K , 180.54 ° C , 356.97 ° F | 1615 K, 1342 ° C, 2448 ° F | 0,534 | 0.98 | 520.2 | 152 | Rojo | |
| Sodio | 22.98976928 (2) | 370,87 K, 97.72 ° C, 207.9 ° F | 1156 K, 883 ° C, 1621 ° F | 0,968 | 0.93 | 495.8 | 186 | Fuerte naranja persistente o amarillo | |
| Potasio | 39,0983 (1) | 336,53 K, 63.38 ° C, 146.08 ° F | 1032 K, 759 ° C, 1398 ° F | 0.89 | 0.82 | 418.8 | 227 | Lila o rosa | |
| Rubidio | 85,4678 (3) | 312.467 K, 39.31 ° C, 102.76 ° F | 961 K, 688 ° C, 1270 ° F | 1,532 | 0.82 | 403.0 | 248 | Rojo o rojizo-violeta | |
| Cesio | 132.9054519 (2) | 301,59 K, 28.44 ° C, 83.19 ° F | 944 K, 671 ° C, 1240 ° F | 1.93 | 0.79 | 375.7 | 265 | Azul o violeta | |
| Francio | [223] | ? 300 K, ? 27 ° C, ? 80 ° F | ? 950 K, ? 677 ° C, ? 1250 ° F | ? 1.87 | ? 0.7 | 380 | ? | ? | |
Nuclear
| Z | De metal alcalino | Estable | Decaimientos | inestables: cursiva isótopos impar y pico de color rosa | ||
|---|---|---|---|---|---|---|
| 3 | litio | 2 | - | 7 Li | 6 Li | |
| 11 | sodio | 1 | - | 23 Na | ||
| 19 | potasio | 2 | 1 | 39 K | 41 K | 40 K |
| 37 | rubidio | 1 | 1 | 85 Rb | 87 Rb | |
| 55 | cesio | 1 | - | 133 Cs | ||
| 87 | francio | - | - | No hay isótopos primordiales | ||
Todos los metales alcalinos tienen números atómicos impares; por lo tanto, sus isótopos deben ser impar-impar (tanto de protones y número de neutrones son impares) o incluso extraño ( número de protones es extraño, pero el número de neutrones es par). Núcleos impar-impar tienen aún números de masa, mientras que los núcleos y pico incluso tienen números de masa impar. Impar impar nucleidos primordiales son raros porque los núcleos más extraño y pico son muy inestables con respecto a desintegración beta, ya que los productos de desintegración son par-par, y son por lo tanto más fuertemente unidos, debido a efectos de emparejamiento nucleares: de los 254 estables nucleidos o observacionalmente estables, sólo cinco tienen tanto un número impar de protones y número impar de neutrones: hidrógeno-2 ( deuterio), litio-6, de boro-10, nitrógeno-14, y tantalio-180m. Los primeros cuatro de ellos tienen poca masa, para que el cambio de un protón a un revés de neutrones o vice daría lugar a una relación de protones neutrones muy desigual; el último, tantalio-180m, es el único primordial isómero nuclear, que todavía no se ha observado que la decadencia a pesar de los intentos experimentales y las predicciones teóricas que no puede verdaderamente ser estable (su decadencia se inhibe en gran medida por su alto spin). Además, cuatro nucleidos y pico extraño radiactivos de larga duración ( potasio-40, vanadio-50, lantano-138, y lutecio-176) se producen de forma natural.
Debido a la gran rareza de núcleos impar-impar, casi todos los isótopos primordiales de los metales alcalinos son impares-pares (las excepciones son el isótopo estable a la luz de litio-6 y la larga vida radioisótopo potasio-40). Para un número de masa impar dado, sólo puede haber un único beta-estable nucleido, ya que no hay una diferencia en la energía de enlace entre par-impar y par-impar comparable a la que existe entre par-par e impar-impar, dejando otros nucleidos de la misma masa ( isobaras) gratuitas para desintegración beta hacia el nucleido menor masa. Un efecto de la inestabilidad de un número impar de cualquier tipo de nucleones es que los elementos de número impar, tales como los metales alcalinos, tienden a tener menos isótopos estables que los elementos pares. De los 26 elementos monoisotopic que sólo tienen un único isótopo estable, todos menos uno tienen un número atómico impar - la única excepción de las dos normas tienen como berilio . Todos estos elementos también tienen un número par de neutrones, siendo la única excepción de nuevo berilio.
Todos los metales alcalinos, excepto de litio y cesio tienen al menos una de origen natural radioisótopo: sodio-22 y sodio-24 se radioisótopos producidos traza cosmogenically, potasio-40 y rubidio-87 tiene muy largas vidas medias y por lo tanto produce de forma natural, y todo isótopos de francio son radiactivo. El cesio también se pensó que era radiactivo en el siglo 20, a pesar de que no ha de origen natural radioisótopos. (Francio no había sido descubierto todavía en ese momento.) El radioisótopo natural de potasio, potasio-40, representa aproximadamente el 0,012% de potasio natural, y por lo tanto de potasio natural es débilmente radiactivos. El científico soviético DK Dobroserdov observó esta radiactividad débil en una muestra de potasio en 1925 e incorrectamente supone que eka-cesio (conocido actualmente como francio) estaba contaminando la muestra. Luego afirmó haber descubierto eka-cesio y predijo sus propiedades, nombrándolo russium después de su país de origen. Poco después, Dobroserdov comenzó a centrarse en su carrera docente en el Instituto Politécnico de Odessa, y él no persiguió el elemento más.

Cesio-137, con una vida media de 30,17 años, es uno de los dos principales productos de fisión, junto con vivido medio estroncio-90, que son responsables de la mayor parte de la radioactividad de el combustible nuclear gastado tras varios años de enfriamiento, hasta varios cientos de años después de su uso. Constituye la mayor parte de la radiactividad todavía izquierda desde el accidente de Chernóbil . 137 Cs beta decae a bario-137m (una corta vida isómero nuclear), que luego decae a no radiactivo de bario-137. Es un fuerte emisor de radiación gamma. 137 Cs tiene una muy baja tasa de captura de neutrones y no puede ser factible eliminar de esta manera, pero se debe permitir a las caries. 137 Cs se ha utilizado como una trazador en estudios hidrológicos, análoga a la utilización de 3 H. Pequeñas cantidades de cesio-134 y cesio-137 fueron puestos en libertad en el medio ambiente durante casi todo los ensayos de armas nucleares y algunos accidentes nucleares, en particular la Accidente de Goiânia y el desastre de Chernobyl . A partir de 2005, el cesio-137 es la principal fuente de radiación en el zona de alienación en todo el Planta de energía nuclear de Chernobyl. Junto con cesio-134, yodo-131, y estroncio 90, cesio-137 fue uno de los isótopos distribuidos por la explosión del reactor, que constituyen el mayor riesgo para la salud. El manejo inadecuado de cesio-137 fuentes de rayos gamma pueden conducir a la liberación de este radioisótopos y radiaciones lesiones. Quizás el caso más conocido es el accidente de Goiânia 1987, en el cual, una disposición inadecuada-dispuesta-de sistema de terapia de radiación de una clínica abandonada en la ciudad de Goiânia, Brasil , fue rescatados de un depósito de chatarra, y la brillante sal de cesio vendido a compradores, sin educación curiosos. Esto dio lugar a cuatro muertes y lesiones graves de exposición a la radiación.
Tendencias periódicas
Los metales alcalinos son más similares entre sí que los elementos en cualquier otra grupo son el uno al otro. Por ejemplo, cuando se mueve hacia abajo la tabla, todos los metales alcalinos conocidos muestran cada vez radio atómico, disminuyendo electronegatividad, aumentando reactividad, y la disminución de puntos de fusión y ebullición. En general, sus densidades aumentan cuando se mueve hacia abajo de la mesa, con la excepción de que el potasio es menos denso que el de sodio.
Radios atómicos e iónicos

El radios atómicos de los metales alcalinos aumentar bajando por el grupo. Debido a la blindaje efecto, cuando un átomo tiene más de una electrón cáscara, cada electrón siente repulsión eléctrica de los otros electrones, así como atracción eléctrica del núcleo. En los metales alcalinos, el electrón más externo sólo se siente una carga neta de +1, como algunos de los carga nuclear (que es igual a la de número atómico ) es cancelada por el electrones internos; el número de electrones internos de un metal alcalino es siempre uno menos que la carga nuclear. Por lo tanto, el único factor que afecta a la radio atómico de los metales alcalinos es el número de capas de electrones. Puesto que este número aumenta hacia abajo el grupo, el radio atómico también debe aumentar por el grupo.
La los radios iónicos de los metales alcalinos son mucho menores que sus radios atómica. Esto es porque el electrón más exterior de los metales alcalinos se encuentra en una diferente capa de electrones que los electrones internos, y por lo tanto cuando se retira el átomo resultante tiene una capa de electrones menos y es más pequeño. Además, el carga nuclear efectiva ha aumentado, por lo que los electrones son atraídos con más fuerza hacia el núcleo y las disminuciones radio iónico.
Primera energía de ionización
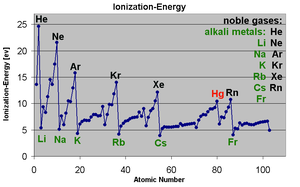
La primera energía de ionización de un elemento o molécula es la energía necesaria para mover el electrón más débilmente retenida de un mol de átomos gaseosos de la elemento o moléculas para formar un mol de iones gaseosos con carga eléctrica 1. Los factores que afectan a la primera energía de ionización son los carga nuclear, la cantidad de blindaje de los electrones internos y la distancia desde el electrón más débilmente retenida desde el núcleo, que es siempre un electrón exterior elementos del grupo principal. Los dos primeros factores cambian la carga nuclear efectiva del electrón más suelto y sujeto siente. Desde el electrón más exterior de metales alcalinos siempre se siente la misma carga nuclear efectiva (1), el único factor que afecta a la primera energía de ionización es la distancia desde el electrón más exterior al núcleo. Desde esta distancia aumenta hacia abajo el grupo, el electrón más exterior se siente menos de atracción del núcleo y por tanto la primera energía de ionización disminuye. (Esta tendencia se rompe en francio debido a la estabilización relativista y contracción de los 7s orbitales de valencia de electrones, con lo que de francio más cerca del núcleo del que se esperaría a partir de cálculos no relativistas. Esto hace electrón más exterior de francio siente más atracción del núcleo, aumentando ligeramente su primera energía de ionización más allá de cesio.)
La segunda energía de ionización de los metales alcalinos es mucho más alta que la primera como la segunda más débilmente retenida de electrones es parte de un completamente lleno Shell y de electrones es por lo tanto difícil de eliminar.
Reactividad
Las reactividades de los metales alcalinos aumentan va por el grupo. Este es el resultado de una combinación de dos factores: el primero energías de ionización y energías de atomización de los metales alcalinos. Debido a que la primera energía de ionización de los metales alcalinos disminuye hacia abajo el grupo, es más fácil para el electrón más exterior para ser retirado de la átomo y participar en reacciones químicas , aumentando así la reactividad por el grupo. La energía de atomización mide la fuerza de la enlace metálico de un elemento, que cae el grupo como los átomos aumentan en radio y por lo tanto el enlace metálico debe aumentar en longitud, haciendo que los electrones deslocalizados más lejos de la atracción de los núcleos de los metales alcalinos más pesados. Adición de la atomización y la primera energías de ionización da una cantidad estrechamente relacionada con (pero no igual a) la energía de activación de la reacción de un metal alcalino con otra sustancia. Esta cantidad disminuye va por el grupo, y lo mismo ocurre con la energía de activación; por lo tanto, las reacciones químicas pueden ocurrir aumentos rápidos y la reactividad hacia abajo el grupo.
Electronegatividad

Electronegatividad es una propiedad química que describe la tendencia de un átomo o una grupo funcional para atraer electrones (o densidad de electrones) hacia sí mismo. Si el vínculo entre sodio y cloro en el cloruro de sodio eran covalente, el par de electrones compartidos se sentiría atraída por el cloro porque la carga nuclear efectiva de los electrones externos es 7 de cloro, pero es sólo 1 en sodio. El par de electrones es atraído tan cerca del átomo de cloro que son prácticamente transferidos al átomo de cloro (una enlace iónico). Sin embargo, si el átomo de sodio fue reemplazado por un átomo de litio, los electrones no serán atraídos tan cerca del átomo de cloro como antes debido a que el átomo de litio es más pequeña, haciendo que el par de electrones más fuertemente atraídos a la carga nuclear efectiva más cerca de litio. Por lo tanto, los átomos de metal alcalino más grandes (más abajo en el grupo) serán menos electronegativo como el par de unión es menos fuertemente atraído hacia ellos.
Debido a la mayor electronegatividad de litio, algunos de sus compuestos tienen un carácter más covalente. Por ejemplo, yoduro de litio ( Li I ) se disuelve en disolventes orgánicos , una propiedad de la mayoría de los compuestos covalentes. El fluoruro de litio (Li F ) es el único haluro alcalino que no es soluble en agua, y hidróxido de litio (Li OH ) es el único hidróxido de metal alcalino que no es delicuescente.
Los puntos de fusión y ebullición
Puntos de fusión y ebullición de los metales alcalinos De metal alcalino Punto de fusion Punto de ebullicion Litio 453,69 K (180,54 ° C) 1615 K (1342 ° C) Sodio 370,87 K (97.72 ° C) 1156 K (883 ° C) Potasio 336,53 K (63,38 ° C) 1032 K (759 ° C) Rubidio 312,46 K (39.31 ° C) 961 K (688 ° C) Cesio 301,59 K (28.44 ° C) 944 K (671 ° C) Francio 300 K (? 27 ° C) 950 K (? 677 ° C)
El punto de fusión de una sustancia es el punto donde cambia estado de sólido a líquido mientras que el punto de ebullición de una sustancia (en estado líquido) es el punto donde la la presión de vapor del líquido es igual a la presión ambiental que rodea el líquido y todos los cambios de estado de líquido a gas . Como un metal se calienta a su punto de fusión, la enlaces metálicos manteniendo los átomos en lugar debilitan de manera que los átomos pueden moverse, y los lazos metálicos eventualmente se rompen por completo en el punto de ebullición del metal. Por lo tanto, los de fusión y ebullición caída de puntos de los metales alcalinos indican que la fuerza de los enlaces metálicos de los metales alcalinos disminuye por el grupo. Esto es debido a átomos de metal se mantienen unidos por la atracción electromagnética de los iones positivos a los electrones deslocalizados. Como los átomos aumentan de tamaño va por el grupo (porque sus atómico aumenta RADIUS), los núcleos de los iones se mueven más lejos de los electrones deslocalizados y por lo tanto el enlace metálico se vuelve más débil de modo que el metal puede fundirse y ebullición más fácilmente, reduciendo así los puntos de fusión y ebullición. (La carga nuclear aumento no es un factor relevante, debido al efecto de apantallamiento.)
Densidad
Los metales alcalinos todos tienen el mismo estructura cristalina ( centrada en el cuerpo cúbico) y por lo tanto los únicos factores relevantes son el número de átomos que pueden caber en un cierto volumen y la masa de uno de los átomos, ya que la densidad se define como masa por unidad de volumen. El primer factor depende del volumen del átomo y por lo tanto el radio atómico, lo que aumenta bajando el grupo; por lo tanto, el volumen de un álcali aumenta átomo de metal que van abajo del grupo. La masa de un átomo de metal alcalino aumenta también va por el grupo. Por lo tanto, la tendencia para las densidades de los metales alcalinos depende de sus pesos atómicos y radios atómicos; si se conocen las cifras de estos dos factores, las proporciones entre las densidades de los metales alcalinos se pueden calcular. La tendencia resultante es que las densidades de los metales alcalinos aumentan abajo de la mesa, con una excepción en potasio. Debido a tener el peso atómico más bajo de todos los elementos en su periodo y tener el radio atómico más grande para sus períodos, los metales alcalinos son los metales menos densos en la tabla periódica. Litio, sodio, y el potasio son los únicos tres metales en la tabla periódica que son menos densos que el agua.
Extensiones

Aunque francio es el metal alcalino más pesado que se ha descubierto, ha habido algún trabajo teórico predecir las características físicas y químicas de los hipotéticos metales alcalinos más pesados. Siendo el primero período de 8 elemento, el elemento no descubierto Ununennio (elemento 119) se prevé que sea la próxima metal alcalino después de francio y se comportan muy parecido a su más ligero congéneres; Sin embargo, también se prevé que diferir de los metales alcalinos más ligeros en algunas propiedades. Su química se prevé que sea más cercano al de potasio o rubidio en lugar de cesio o francio. Esto es inusual como tendencias periódicas, ignorando los efectos relativistas predecirían Ununennio ser aún más reactivo que el cesio y francio. Este rebajado reactividad es debido a la estabilización relativista de electrones de valencia de ununennio, aumentando primera energía de ionización de ununennio y disminuyendo el metálica y radio iónico; este efecto ya se ha visto por francio. Esto supone que ununennio se comportará químicamente como un metal alcalino, que, aunque probable, no puede ser cierto debido a los efectos relativistas. La estabilización relativista del orbital 8s también aumenta de ununennio afinidad electrónica mucho más allá de la de cesio y francio; de hecho, se espera que ununennio tener una afinidad electrónica más alto que todos los metales alcalinos más ligeros de lo que. Efectos relativistas también causan una gran caída en la polarizabilidad de ununennio. Por otro lado, ununennio se prevé que continúe la tendencia de disminución de puntos de fusión que va abajo del grupo, que se espera que tenga un punto de fusión entre 0 ° C y 30 ° C.

La estabilización de la valencia de electrones de ununennio y por lo tanto la contracción de la causa orbital 8s su radio atómico que se baja a 240 pm, muy cercana a la de rubidio (247 pm), de modo que la química de ununennio en el estado de oxidación +1 debe ser más similar a la química de rubidio que a la de francio. Por otro lado, el radio iónico de la Uue + ion se prevé que sea mayor que el de Rb + , porque los 7p orbitales se desestabilizan y por tanto son más grandes que los orbitales p de las conchas inferiores. Ununennio también puede mostrar el 3 estado de oxidación , que no se ve en cualquier otro metal alcalino, además de el estado de oxidación 1 que es característico de los otros metales alcalinos y es también el estado de oxidación principal de todos los metales alcalinos conocidos: esto es debido a la desestabilización y la expansión de la 7p 3/2 spinor, causando sus electrones más externos que tienen una energía de ionización más bajo que lo que de otro modo se esperaba.

No tanto el trabajo que se ha hecho la predicción de las propiedades de los metales alcalinos allá ununennio. Aunque una simple extrapolación de la tabla periódica pondría elemento 169, unhexennium, bajo ununennio, cálculos Dirac-Fock predicen que el próximo metal alcalino después ununennio en realidad puede ser el elemento 165, unhexpentium, que se prevé contar con la configuración electrónica [Uuo] 5g 18 6f 14 7d 10 8s 2 8p 1/2 2 9s 1 . Otros cálculos muestran que unhexpentium sería seguir la tendencia de aumento de la energía de ionización más allá de cesio, que tiene una energía de ionización comparable a la de sodio, y que también debería seguir la tendencia de disminución de radios atómicos más allá de cesio, que tiene un radio atómico comparable a la de potasio . Sin embargo, los electrones 7d de unhexpentium también pueden ser capaces de participar en las reacciones químicas, junto con el electrón 9s, posiblemente permitiendo a los estados de oxidación más allá de 1 y tal vez incluso haciendo unhexpentium comportarse más como un elemento del grupo del boro de un metal alcalino.
Las propiedades probables de los metales alcalinos más allá de unhexpentium no se han explorado todavía a partir de 2012. En períodos 8 y por encima de la tabla periódica, los efectos relativistas y estructura de cubierta se vuelven tan fuertes que las extrapolaciones de los congéneres más ligeros se vuelven completamente incorrecto. Además, los efectos relativistas y de estructura de cáscara (que estabilizan los s-orbitales y desestabilizan y amplían la d-, f-, y g-orbitales de los depósitos superiores) tienen efectos opuestos, haciendo diferencia aún mayor entre relativista y no relativista los cálculos de las propiedades de los elementos con números atómicos tales altos. Debido a los alcalinos y metales alcalinotérreos siendo ambos elementos de s-bloque, estas predicciones para las tendencias y las propiedades de ununennio y unhexpentium también se aplican principalmente a los metales alcalinotérreos correspondiente unbinilio (NBI) y unhexhexium (Uhh).
Otras sustancias similares
Hidrógeno

El elemento de hidrógeno , con un electrón por átomo neutro, normalmente se coloca en la parte superior de Grupo 1 de la tabla periódica por conveniencia, pero el hidrógeno no se considera normalmente que ser un metal alcalino; cuando se considera que es un metal alcalino, es a causa de sus propiedades atómicas y no sus propiedades químicas. En condiciones típicas, existe hidrógeno puro como un gas diatómico que consta de dos átomos por molécula (H 2 ); sin embargo, los metales alcalinos sólo se forman moléculas diatómicas (tales como dilitio, Li 2 ) a altas temperaturas, cuando están en la gaseoso estado.
El hidrógeno, como los metales alcalinos, tiene un electrón de valencia y reacciona fácilmente con los halógenos , pero las similitudes terminan ahí. Su colocación por encima de litio es principalmente debido a su configuración electrónica y no sus propiedades químicas. A veces se coloca por encima de carbono debido a sus electronegatividades o similares flúor debido a sus propiedades químicas similares.
La primera energía de ionización de hidrógeno (1312.0 kJ / mol) es mucho mayor que la de los metales alcalinos. Como sólo se requiere un electrón adicional para llenar en la capa más externa del átomo de hidrógeno, el hidrógeno a menudo se comporta como un halógeno, formando el negativo ion hidruro, y algunas veces se considera que es un halógeno. (Los metales alcalinos también pueden formar iones negativos, conocidos como alkalides, pero estos son poco más que curiosidades de laboratorio, siendo inestable.) Bajo extremadamente altas presiones, como las que se encuentran en los núcleos de Júpiter y Saturno , el hidrógeno se convierte en metálico y se comporta como un metal alcalino; en esta fase, que se conoce como hidrógeno metálico.

Amonio
La ion amonio ( NH +
4 ) tiene propiedades muy similares a los metales alcalinos más pesados, que actúa como un metal alcalino intermedio entre el potasio y rubidio, y a menudo se considera un pariente cercano. Por ejemplo, de metales alcalinos más sales son solubles en agua, una propiedad que sales de amonio acción. Se espera de amonio a comportarse como un metal (NH +
4 iones en un mar de electrones) a presiones muy altas, como el interior de los gigantes de hielo Urano y Neptuno .
Talio

Talio muestra el 1 estado de oxidación que toda la pantalla metales alcalinos conocido, y compuestos de talio con talio en su 1 estado de oxidación se parecen mucho a los de potasio o correspondientes plata compuestos debido a los radios iónicos similar del Tl + (164 horas), K + ( 152 horas) y Ag + (129 horas) iones. A veces era considerado un metal alcalino en la Europa continental (pero no en Inglaterra) en los años inmediatamente posteriores a su descubrimiento, y se colocó justo después de cesio como el sexto metal alcalino en Dmitri Mendeleev 1869 's tabla periódica y 1868 tabla periódica de Julius Lothar Meyer . (1871 tabla periódica de Mendeleiev y 1870 tabla periódica de Meyer ponen talio en su posición actual en el grupo del boro y dejan el espacio debajo de cesio en blanco.) Sin embargo, talio también muestra el estado de oxidación 3, que no conoce las pantallas de metales alcalinos (aunque ununennio, el séptimo de metal alcalino por descubrir, se predice para mostrar posiblemente el estado de oxidación +3). El sexto metal alcalino se considera ahora como francio.
Historia
Etimología
Los metales alcalinos se llaman así porque sus hidróxidos son todos fuertesálcalis cuando se disuelve en agua.
Descubrimiento
Litio

Petalita ( Li Al Si 4 O 10 ) fue descubierto en 1800 por el brasileño químico José Bonifácio de Andrada en una mina en la isla de Utö, Suecia. Sin embargo, no fue hasta 1817 que Johan agosto Arfwedson, que entonces trabajaba en el laboratorio del químico Jöns Jacob Berzelius, detectó la presencia de un nuevo elemento al analizar el mineral petalita. Este nuevo elemento compuestos similares a las de sodio y potasio formado, aunque su carbonato y hidróxido eran menos soluble en agua y más alcalino que los otros metales alcalinos. Berzelius dio el material desconocido el nombre de " Lithion / Lithina ", del griego palabra λιθoς (transcrito como lithos , que significa "piedra"), para reflejar su descubrimiento en un mineral sólido, a diferencia de potasio, que había sido descubierto en cenizas de plantas y sodio, que era conocido en parte por su gran abundancia en la sangre de animales. Nombró el metal dentro de la "materia de litio ".
Sodio

Los compuestos de sodio se han conocido desde la antigüedad; sal ( cloruro de sodio ) ha sido un producto importante en las actividades humanas, como atestigua la palabra Inglés salario , refiriéndose a salarium , las obleas de sal dan a veces a los soldados romanos, junto con sus otros salarios. En medieval Europa un compuesto de sodio con el América nombre de sodanum fue utilizado como un dolor de cabeza remedio. De sodio puro no fue aislado hasta 1807 por Humphry Davy a través de la electrólisis de la sosa cáustica (ahora llamada hidróxido de sodio), un método muy similar a la utilizada para aislar potasio principios de ese año.
Potasio

Mientras que la potasa se ha utilizado desde la antigüedad, no se entendió durante la mayor parte de su historia al ser una sustancia fundamentalmente diferente de sales minerales de sodio. Georg Ernst Stahl obtuvo evidencia experimental que le llevó a sugerir la diferencia fundamental de las sales de sodio y potasio en 1702 y Henri Louis Duhamel du Monceau fue capaz de demostrar esta diferencia en 1736. La composición química exacta de compuestos de potasio y sodio, y la condición de elemento químico de potasio y sodio, no se sabía entonces, y por lo tanto Antoine Lavoisier incluyó el álcali en su lista de elementos químicos en 1789. potasio puro se aisló por primera vez en 1807 en Inglaterra por Sir Humphry Davy , que deriva desde la potasa cáustica (KOH, hidróxido de potasio) por el uso de la electrólisis de la sal fundida con el recién inventado pila voltaica . El potasio fue el primer metal que fue aislado por electrólisis. Más tarde ese mismo año, Davy informó extracción de sodio de la sustancia similar soda cáustica (NaOH, lejía) por una técnica similar, lo que demuestra los elementos, y por lo tanto las sales, a ser diferente.
Rubidio

Rubidio fue descubierto en 1861 en Heidelberg, Alemania por Robert Bunsen y Gustav Kirchhoff, los primeros en sugerir la búsqueda de nuevos elementos de análisis de espectro , en el mineral lepidolita a través del uso de un espectroscopio. Debido a las líneas rojas brillantes en su espectro de emisión, eligieron un nombre derivado del latín palabra rubidus , que significa rojo oscuro. El descubrimiento de rubidio que tuvo éxito de cesio, también descubierto por Bunsen y Kirchhoff a través de la espectroscopia.
Cesio
En 1860, Robert Bunsen y Gustav Kirchhoff descubrió el cesio en el agua mineral de Dürkheim, Alemania. Debido a las líneas brillantes azules en su espectro de emisión, eligieron un nombre derivado de la palabra latina caesius , que significa cielo azul. Cesio fue el primer elemento que se descubrió espectroscópicamente , sólo un año después de la invención del espectroscopio por Bunsen y Kirchhoff.
Francio
Había por lo menos cuatro descubrimientos erróneas e incompletas antes de Marguerite Perey del Instituto Curie de París, Francia descubrió francio en 1939 mediante la purificación de una muestra de actinio-227, que había sido informado que tienen una energía de desintegración de 220 keV. Sin embargo, Perey advirtió partículas de desintegración con un nivel de energía inferior a 80 keV. Perey pensó esta actividad descomposición podría haber sido causado por un producto de desintegración previamente no identificado, que fue separado durante la purificación, pero surgió de nuevo fuera de la pura actinium -227. Varias pruebas eliminaron la posibilidad de que el elemento desconocido siendo torio , radio , plomo , bismuto o talio . El nuevo producto exhibido propiedades químicas de un metal alcalino (tales como coprecipitación con sales de cesio), lo que llevó a Perey creen que fue elemento 87, causada por la desintegración alfa del actinio-227. Perey intentó entonces determinar la proporción de la desintegración beta de desintegración alfa en 227 Ac. Su primera prueba puso el alfa de ramificación en el 0,6%, una cifra que más tarde se revisó al 1%. Fue el último elemento descubierto en la naturaleza , en lugar de mediante síntesis.
Eka-francio
El siguiente elemento a continuación francio ( eka-francio) es muy probable que sea ununennio (Uue), elemento 119, aunque esto no es totalmente cierto, debido a efectos relativistas. la síntesis de ununennio se intentó por primera vez en 1985 bombardeando un blanco de einstenio -254 con calcio -48 iones en el acelerador superHILAC en Berkeley, California. No se identificaron átomos, dando lugar a un rendimiento limitante de 300 nb.
- 254
99Es+ 48
20Ca→302
119UUE* →no hay átomos
Es muy poco probable que esta reacción será capaz de crear cualquier átomo de ununennio en el futuro cercano, dada la extremadamente difícil tarea de hacer cantidades suficientes de 254 ES, que se ve favorecida para la producción de elementos ultrapesado debido a su gran masa, relativamente larga media -La vida de 270 días, y la disponibilidad en cantidades significativas de varios microgramos, para hacer un objetivo lo suficientemente grande como para aumentar la sensibilidad del experimento hasta el nivel requerido; einsteinium no se ha encontrado en la naturaleza y sólo se ha producido en los laboratorios. Sin embargo, dado que ununennio es sólo el primer elemento periodo 8 en la tabla periódica extendida, bien puede ser descubierto en un futuro próximo a través de otras reacciones; de hecho, otro intento de sintetizar ununennio bombardeando un berkelium objetivo con titanio iones está en marcha en el Centro Helmholtz GSI para la Investigación de Iones Pesados en Darmstadt, Alemania . En la actualidad, ninguno de los elementos 8 de época se han descubierto todavía, y también es posible, debido a gotear inestabilidades, que sólo el período inferior 8 elementos, hasta alrededor del elemento 128, son físicamente posible. No hay intentos de síntesis se han hecho para todos los metales alcalinos más pesados, como unhexpentium, debido a su número atómico extremadamente alta.
Aparición
En el Sistema Solar

La Regla Oddo-Harkins sostiene que los elementos con números atómicos incluso son más comunes que los que tienen números atómicos impares, con la excepción de hidrógeno. Esta regla argumenta que los elementos con números atómicos impares tienen un protón desapareado y son más propensos a capturar otra, aumentando así su número atómico. En elementos con números pares atómicos, los protones se emparejan, con cada miembro de la pareja compensar el giro de la otra, la estabilidad mejora. Todos los metales alcalinos tienen números atómicos impares y no son tan comunes como los elementos con números atómicos incluso adyacentes a ellos (los gases nobles y los metales de tierras alcalinas ) en el Sistema Solar. Los metales alcalinos más pesados también son menos abundantes que los más ligeros como los metales alcalinos de rubidio en adelante sólo pueden ser sintetizados en supernovas y no en la nucleosíntesis estelar. El litio es también mucho menos abundante que el de sodio y potasio, ya que está mal sintetiza en tanto nucleosíntesis Big Bang y en las estrellas: el Big Bang sólo podía producir cantidades de trazas de litio, berilio y boro debido a la ausencia de un núcleo estable con 5 o 8 nucleones y nucleosíntesis estelar sólo podían pasar este cuello de botella por el proceso triple alfa, fusionando tres núcleos de helio para formar carbono , y saltando sobre esos tres elementos.
En La Tierra

La Tierra forma a partir de la misma nube de materia que formó el Sol, pero los planetas adquirió diferentes composiciones durante la formación y evolución del sistema solar. A su vez, la historia natural de la Tierra causada partes de este planeta que tienen diferentes concentraciones de los elementos. La masa de la Tierra es de aproximadamente 5.98 × 10 24 kg. Se compone principalmente de hierro (32,1%), oxígeno (30,1%), silicio (15,1%), magnesio (13,9%), azufre (2,9%), níquel (1,8%), calcio (1,5%), y aluminio ( 1,4%); con el 1,2% restante consiste en cantidades traza de otros elementos. Debido a segregación masa, se cree que la región del núcleo que se compone principalmente de hierro (88,8%), con cantidades más pequeñas de níquel (5,8%), azufre (4,5%), y menos de 1% de elementos traza.
Los metales alcalinos, debido a su alta reactividad, no se producen de forma natural en estado puro en la naturaleza. Son litófilos y por lo tanto se mantienen cerca de la superficie de la Tierra, ya que combinan fácilmente con el oxígeno y lo asocian fuertemente con sílice , formando relativamente minerales de baja densidad que hacen no hundirse en el núcleo de la Tierra. El potasio, rubidio y cesio también son elementos incompatibles debido a su baja radios iónicos.
El sodio y el potasio son muy abundantes en la tierra, tanto estar entre los diez elementos más comunes en la corteza terrestre; sodio constituye aproximadamente el 2,6% de la Tierra corteza 's medido en peso, lo que es el sexto elemento más abundante en general y el más abundante de metal alcalino. El potasio constituye aproximadamente el 1,5% de la corteza terrestre y es el séptimo elemento más abundante. El sodio se encuentra en muchos minerales diferentes, de los cuales el más común es la sal común (cloruro de sodio), que se produce en grandes cantidades disueltas en agua de mar. Otros depósitos sólidos incluyen halita, anfíbol, criolita, nitratine y zeolita.
Litio, debido a su reactividad relativamente baja, se puede encontrar en agua de mar en grandes cantidades; se estima que el agua de mar es de aproximadamente 0,14 a 0,25 partes por millón (ppm) o 25 micromolar.
Rubidio es aproximadamente tan abundante como el zinc y el más abundante que el cobre. Se produce naturalmente en los minerales leucita, polucita, carnalita, zinnwaldite y lepidolita. El cesio es más abundante que algunos elementos comúnmente conocidos, tales como antimonio , cadmio , estaño , y de tungsteno , pero es mucho menos abundante que el rubidio.
Francio-223, el isótopo se producen sólo naturalmente de francio, es el producto de la desintegración alfa del actinio-227 y se puede encontrar en cantidades traza en uranio y torio minerales. En una muestra dada de uranio, se estima que sólo un átomo de francio por cada 10 18 átomos de uranio. Se ha calculado que hay como máximo 30 g de francio en la corteza de la tierra en cualquier momento, debido a su muy corta vida media de 22 minutos.
Producción


La producción de metales alcalinos puros es difícil debido a su extrema reactividad con sustancias comúnmente utilizados, tales como agua. Los metales alcalinos son tan reactivos que no pueden ser desplazados por otros elementos y deben ser aislados a través de la electrólisis.
Las sales de litio tienen que ser extraída del agua de fuentes minerales, salmuera, piscinas y depósitos de salmuera. El metal se produce electrolíticamente a partir de una mezcla de fundido cloruro de litio y cloruro de potasio.
El potasio se produce en muchos minerales, tales como silvita ( cloruro de potasio). Se produce de vez en cuando a través de la separación de la potasio del cloro en el cloruro de potasio, pero se produce más a menudo a través de la electrólisis del hidróxido de potasio, que se encuentra ampliamente en lugares como Canadá , Rusia , Bielorrusia , Alemania , Israel , Estados Unidos y Jordania , en un método similar a cómo se produjo de sodio a finales de 1800 y principios de 1900. También puede ser producido a partir de agua de mar . Se produce en su mayoría de sodio en agua de mar y se secó lecho marino, pero ahora se produce a través de la electrólisis de cloruro de sodio mediante la reducción del punto de fusión de la sustancia por debajo de 700 ° C a través del uso de un celular Downs. Extremadamente de sodio puro puede ser producido a través de la descomposición térmica de azida de sodio.

Desde hace varios años en la década de 1950 y 1960, un subproducto de la producción de potasio llamado Alkarb era una fuente principal de rubidio. Alkarb contenía 21% de rubidio mientras que el resto era de potasio y una pequeña fracción de cesio. Hoy en día los mayores productores de cesio, por ejemplo, la mina de Tanco, Manitoba, Canadá, producen rubidio como subproducto de polucita. Hoy en día, un método común para la separación de rubidio de potasio y de cesio es la cristalización fraccionada de un rubidio y cesio alumbre ( Cs , Rb ) Al ( SO 4 ) 2 · 12 H 2 O , lo que da alumbre rubidio puro después de aproximadamente 30 reacciones diferentes. Las aplicaciones limitadas y la falta de un mineral rico en rubidio limita la producción de compuestos de rubidio a 2 a 4 toneladas por año. Cesio, sin embargo, no se produce a partir de la reacción anterior. En lugar de ello, la extracción de mineral de polucita es el principal método de obtención de cesio puro, extraído de la mena principalmente por tres métodos: digestión ácida, alcalina de descomposición, y reducción directa.
Francio-223, el isótopo se producen sólo naturalmente de francio, se produce naturalmente como el producto de la desintegración alfa del actinio-227. Francio se pueden encontrar en pequeñas cantidades en uranio y torio minerales; se ha calculado que a lo sumo hay 30 g de francio en la corteza de la tierra en un momento dado. Como resultado de su extrema rareza en la naturaleza, más francio se sintetiza en la reacción nuclear 197 Au + 18 O → 210 Fr + 5 n , produciendo francio-209, francio-210, y francio-211. La mayor cantidad de francio jamás reunida hasta la fecha es de aproximadamente 300.000 átomos neutros, que fueron sintetizados utilizando la reacción nuclear dado anteriormente.
Aplicaciones
Todos los metales alcalinos descubiertos con exclusión de francio tienen muchas aplicaciones. El litio se utiliza a menudo en baterías, y óxido de litio puede ayudar sílice proceso. El litio también se puede utilizar para hacer grasas lubricantes, de tratamiento de aire, y de producción de aluminio.
De sodio puro tiene muchas aplicaciones, incluyendo el uso de lámparas de vapor de sodio, que producen una luz muy eficiente en comparación con otros tipos de iluminación, y pueden ayudar a suavizar la superficie de otros metales. Los compuestos de sodio tienen muchas aplicaciones, así, el ser compuesto más conocido sal de mesa. El sodio también se usa en el jabón como sales de ácidos grasos .
Compuestos de potasio se utilizan a menudo como fertilizantes como el potasio es un elemento importante para la nutrición de las plantas. Otros iones de potasio se utilizan a menudo para mantener aniones . El hidróxido de potasio es una base muy fuerte, y se utiliza para controlar el pH de diversas sustancias.

Rubidio y cesio se utilizan a menudo en los relojes atómicos. Los relojes atómicos de cesio son extraordinariamente precisa; si un reloj se había hecho en el momento de los dinosaurios, que sería apagado por menos de cuatro segundos (después de los 80 millones de años). Por esa razón, los átomos de cesio se utilizan como la definición de la segunda. Iones de rubidio se utilizan a menudo en púrpura fuegos artificiales, y cesio se utiliza a menudo en los fluidos de perforación en la industria petrolera.
Francio no tiene aplicaciones comerciales, pero a causa de relativamente simple de francio estructura atómica , entre otras cosas, se ha utilizado en la espectroscopia de experimentos, dando lugar a más información sobre los niveles de energía y las constantes de acoplamiento entre partículas subatómicas. Los estudios sobre la luz emitida por francio-210 iones láser atrapados han proporcionado datos precisos sobre las transiciones entre niveles de energía atómica, similares a los predichos por la teoría cuántica .
Papel biológico y precauciones

El litio no se produce de forma natural en los sistemas biológicos y no tiene ningún papel biológico, pero sí que tiene efectos en el cuerpo cuando se ingiere. carbonato de litio se usa como un estabilizador del humor en la psiquiatría para tratar el trastorno bipolar ( maniaco-depresión) en dosis diarias de aproximadamente 0,5 a 2 gramos, aunque hay efectos secundarios. La ingestión excesiva de litio provoca somnolencia, dificultad para hablar y vómitos, entre otros síntomas, y los venenos del sistema nervioso central, que es peligroso como la dosis necesaria de litio para tratar el trastorno bipolar es sólo ligeramente inferior a la dosis tóxica. Su bioquímica, la forma en que se maneja por el cuerpo humano y los estudios con ratas y cabras sugieren que se trata de un esencial elemento traza, aunque la función biológica natural de litio en los humanos aún no se ha identificado.
El sodio y el potasio se producen en todos los sistemas biológicos conocidos, generalmente funciona como electrolitos dentro y fuera de las células . El sodio es un nutriente esencial que regula el volumen de sangre, la presión arterial, el equilibrio osmótico y pH; el requisito mínimo para fisiológica de sodio es 500 miligramos por día. El cloruro de sodio (también conocido como sal común) es la principal fuente de sodio en la dieta, y se utiliza como condimento y conservante, tal como para el decapado y cecina; la mayor parte proviene de los alimentos procesados. La DRI para el sodio es de 1,5 gramos por día, pero la mayoría de personas en los Estados Unidos consume más de 2,3 gramos por día, la cantidad mínima que promueve la hipertensión; esto a su vez provoca 7,6 millones de muertes prematuras en todo el mundo.
El potasio es el principal catión (ion positivo) en el interior de las células animales , mientras que el sodio es el principal catión fuera de las células animales. La diferencias de concentración de estas partículas cargadas provoca una diferencia en el potencial eléctrico entre el interior y exterior de las células, conocido como el potencial de membrana. El equilibrio entre el potasio y de sodio se mantiene por bombas de iones en la membrana celular. El potencial de membrana celular creado por iones de potasio y de sodio permite a la célula para generar un potencial de acción -a "pico" de la descarga eléctrica. La capacidad de las células para producir la descarga eléctrica es crítica para las funciones corporales tales como la neurotransmisión, la contracción muscular, y la función del corazón.
Rubidio no ha conocido papel biológico, pero puede ayudar a estimularel metabolismo, y, de manera similar al cesio, sustituir el potasio en el cuerpo causandodeficiencia de potasio.
Compuestos de cesio se encuentran raramente por la mayoría de la gente, pero la mayoría de los compuestos de cesio son ligeramente tóxicos debido a la similitud química de cesio al potasio, permitiendo que el cesio para reemplazar el potasio en el cuerpo, causando deficiencia de potasio. La exposición a grandes cantidades de compuestos de cesio puede causar hiperirritabilidad y espasmos, pero como esas cantidades no serían normalmente se encuentran en las fuentes naturales, cesio no es uno de los principales contaminantes del medio ambiente químico. La mediana dosis letal (LD 50 valor) de cloruro de cesio en ratones es de 2.3 g por kilogramo, que es comparable a los LD 50 valores de cloruro de potasio y cloruro de sodio . Cloruro de cesio ha sido promovido como un tratamiento alternativo contra el cáncer, pero se ha relacionado con la muerte de más de 50 pacientes, en los que se utilizó como parte de un tratamiento contra el cáncer científicamente validada.
Francio no tiene ningún papel biológico y es más probable que sea tóxica debido a su extrema radiactividad, causandoenvenenamiento por radiación, pero ya que la mayor cantidad de francio jamás reunida hasta la fecha es de aproximadamente 300.000 átomos neutros, es poco probable que la mayoría de la gente jamás encontrada francio.
