
Renio
Antecedentes de las escuelas de Wikipedia
SOS Children han producido una selección de artículos de la Wikipedia para escuelas desde 2005. SOS Children trabaja en 45 países africanos; puede ayudar a un niño en África ?
| Renio | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
75 Re | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Apariencia | ||||||||||||||||||||||
blanco plateado  | ||||||||||||||||||||||
| Propiedades generales | ||||||||||||||||||||||
| Nombre, símbolo, número | renio, Re, 75 | |||||||||||||||||||||
| Pronunciación | / r yo n yo ə m / REE -nee-əm | |||||||||||||||||||||
| Categoría Elemento | metal de transición | |||||||||||||||||||||
| Grupo, período, bloque | 7, 6, d | |||||||||||||||||||||
| Peso atómico estándar | 186.207 | |||||||||||||||||||||
| Configuración electrónica | [ Xe ] 4f 14 5d 5 6s 2 2, 8, 18, 32, 13, 2 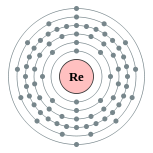 | |||||||||||||||||||||
| Historia | ||||||||||||||||||||||
| Descubrimiento | Masataka Ogawa (1908) | |||||||||||||||||||||
| Primer aislamiento | Masataka Ogawa (1908) | |||||||||||||||||||||
| Nombrado por | Walter Noddack, Ida Noddack, Otto Berg (1922) | |||||||||||||||||||||
| Propiedades físicas | ||||||||||||||||||||||
| Fase | sólido | |||||||||||||||||||||
| Densidad (cerca rt) | 21,02 g · cm -3 | |||||||||||||||||||||
| Líquido densidad en mp | 18,9 g · cm -3 | |||||||||||||||||||||
| Punto de fusion | 3459 K , 3186 ° C, 5767 ° F | |||||||||||||||||||||
| Punto de ebullicion | 5869 K, 5596 ° C, 10.105 ° F | |||||||||||||||||||||
| Calor de fusión | 60.43 kJ · mol -1 | |||||||||||||||||||||
| El calor de vaporización | 704 kJ · mol -1 | |||||||||||||||||||||
| Capacidad calorífica molar | 25.48 J · mol -1 · K -1 | |||||||||||||||||||||
| Presión del vapor | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Propiedades atómicas | ||||||||||||||||||||||
| Estados de oxidación | 7, 6, 5, 4, 3, 2, 1, 0, -1 (Levemente ácida óxido) | |||||||||||||||||||||
| Electronegatividad | 1,9 (escala de Pauling) | |||||||||||||||||||||
| Energías de ionización ( más) | Primero: 760 kJ · mol -1 | |||||||||||||||||||||
| Segundo: 1260 kJ · mol -1 | ||||||||||||||||||||||
| Tercero: 2510 kJ · mol -1 | ||||||||||||||||||||||
| Radio atómico | 137 pm | |||||||||||||||||||||
| Radio covalente | 151 ± 19:00 | |||||||||||||||||||||
| Miscelánea | ||||||||||||||||||||||
| Estructura cristalina | hexagonal compacta | |||||||||||||||||||||
| Ordenamiento magnético | paramagnético | |||||||||||||||||||||
| La resistividad eléctrica | (20 ° C) 193 nΩ · m | |||||||||||||||||||||
| Conductividad térmica | 48.0 W · m -1 · K -1 | |||||||||||||||||||||
| Expansión térmica | 6,2 m / (m · K) | |||||||||||||||||||||
| Velocidad del sonido (varilla delgada) | (20 ° C) 4700 m · s -1 | |||||||||||||||||||||
| El módulo de Young | 463 GPa | |||||||||||||||||||||
| Módulo de corte | 178 GPa | |||||||||||||||||||||
| Módulo de volumen | 370 GPa | |||||||||||||||||||||
| Relación de Poisson | 0.30 | |||||||||||||||||||||
| Dureza de Mohs | 7.0 | |||||||||||||||||||||
| Dureza Vickers | 2450 MPa | |||||||||||||||||||||
| Dureza Brinell | 1320 MPa | |||||||||||||||||||||
| Número de registro del CAS | 7440-15-5 | |||||||||||||||||||||
| La mayoría de los isótopos estables | ||||||||||||||||||||||
| Artículo principal: Los isótopos de renio | ||||||||||||||||||||||
| ||||||||||||||||||||||
El renio es un elemento químico con el símbolo de Re y número atómico 75. Se trata de una, la tercera fila pesado de color blanco plateado metal de transición en grupo 7 de la tabla periódica . Con una concentración media estimada de 1 parte por billón (ppb), renio es uno de los elementos más raros del la corteza terrestre . El elemento libre tiene la tercero más alto punto de fusión y punto de ebullición más alto de cualquier elemento. El renio se asemeja manganeso químicamente y se obtiene como una subproducto de molibdeno y cobre extracción y refinamiento del mineral. Renio muestra en sus compuestos de una amplia variedad de estados de oxidación que van -1-7.
Descubierto en 1925, el renio fue el último elemento estable que hay que descubrir. Debe su nombre al río Rin en Europa.
Níquel -basado superaleaciones de renio se utilizan en las cámaras de combustión, álabes de la turbina y toberas de escape de motores a reacción , estas aleaciones contienen hasta un 6% de renio, por lo que la construcción de motores a reacción el más grande de un solo uso para el elemento, con usos catalíticos de la industria química siendo next- lo más importante. Debido a la disponibilidad baja en relación con la demanda, renio es de los más caros de los metales, con un precio promedio de aproximadamente US $ 4.575 por kilo (US $ 142,30 por onza troy) a partir de agosto de 2011; también de fundamental importancia militar estratégica es, para su uso en motores a reacción y cohetes militares de alto rendimiento.
Historia
Renio ( América : Rhenus significado: " Rin ") fue el último elemento por descubrir que tiene un isótopo estable (otros nuevos elementos radiactivos se han descubierto en la naturaleza desde entonces, como el neptunio y plutonio ). La existencia de un elemento aún por descubrir en esta posición en la tabla periódica había sido predicho por primera Dmitry Mendeleev . Otra información calculada se obtuvo Henry Moseley en 1914. En general, se considera que ha sido descubierto por Walter Noddack, Ida Tacke, y Otto Berg en Alemania . En 1925 se informó que se detectó el elemento en el mineral de platino y en el mineral columbita. También encontraron en renio gadolinita y molibdenita. En 1928 fueron capaces de extraer 1 g del elemento de la transformación de 660 kg de molybdenite.It se estimó en 1968 que el 75% del metal de renio en el Estados Unidos se utiliza para la investigación y el desarrollo de aleaciones de metales refractarios. Pasaron varios años desde ese momento antes de las superaleaciones fueron ampliamente utilizados.
En 1908, Japón químico Masataka Ogawa anunció que descubrió el elemento 43a y la llamó nipponium (Np) después de Japón (Nippon en japonés). Sin embargo, un análisis posterior indicó la presencia de renio (elemento 75), no elemento 43 . El símbolo Np fue utilizado más adelante para el elemento de neptunio .
Características
El renio es un metal de color blanco plateado con uno de los más altos puntos de fusión de todos los elementos, superado sólo por el tungsteno y carbono . Es también una de las más densas, sólo superado por el platino , iridio y osmio . Renio tiene una estructura cristalina hexagonal compacta, con parámetros de red a = 276,1 pm y c = 445,6 pm.
Su forma comercial habitual es un polvo, pero este elemento se puede consolidar por prensado y sinterización en un vacío o de hidrógeno atmósfera. Este procedimiento produce un compacto sólido que tiene una densidad por encima del 90% de la densidad del metal. Cuando recocido este metal es muy dúctil y se puede doblar, en espiral, o enrollado. Renio y molibdeno aleaciones son superconductores a 10 K ; aleaciones de tungsteno-renio también son superconductores alrededor de 4-8 K, dependiendo de la aleación. De metal renio superconduce a 1.697 ± 0.006 K.
En forma a granel y a temperatura ambiente y presión atmosférica, el elemento resiste álcalis, ácido sulfúrico , ácido clorhídrico , diluir, pero no concentrada de ácido nítrico , y agua regia.
Isótopos
Renio tiene un isótopo estable, renio-185, que sin embargo se produce en abundancia minoría, una situación que sólo se encuentra en otros dos elementos ( de indio y telurio ). Renio origen natural es 37.4% 185 Re, que es estable , y el 62,6% 187 Re, la cual es inestable pero tiene una muy larga vida media (~ 10 10 años). Este tiempo de vida se ve afectada por el estado de carga de átomo de renio. La la desintegración beta de 187 Re se utiliza para renio-osmio datación de minerales. La energía disponible para este decaimiento beta (2,6 keV) es uno de los más bajo conocido entre todos radionucleidos. Hay veintiséis otros isótopos radiactivos reconocidos de renio.
Compuestos
Compuestos de renio son conocidos por los nueve estados de oxidación entre -1 y 7. Los estados de oxidación 7, 6, 4 y 2 son los más comunes. El renio es más disponible comercialmente como sales de perrenato, incluyendo de sodio y perrenatos amonio. Estos son compuestos blancos, solubles en agua.
Halogenuros y oxihalogenuros
Los cloruros de renio más comunes son Recl 6, Recl 5, Recl 4, y Recl 3. Las estructuras de estos compuestos a menudo disponen de una amplia unión Re-Re, que es característico de este metal en los estados de oxidación inferiores a VII. Las sales de [Re 2 Cl 8] 2- característica un enlace metal-metal cuádruple. Aunque la más alta de cloruro de renio Re dispone de (VI), flúor da la d 0 Re (VII) derivado heptafluoride renio. Bromuros y yoduros de renio también son bien conocidos.
Como el tungsteno y molibdeno, con el que comparte similitudes químicas, renio forma una variedad de oxihaluros. Los oxicloruros son más comunes, e incluyen ReOCl 4, ReO 3 Cl.
Los óxidos y sulfuros

El óxido más común es la incoloro volátil Re 2 O 7, que adopta una estructura molecular, a diferencia de la mayoría de los óxidos metálicos. La especie d1 ReO 3 adopta una estructura perovskita defecto. Otros óxidos incluyen Re 2 O 5, ReO 2, y Re 2 O 3. La sulfuros son ReS 2 y Re 2 S 7. Sales de perrenato se pueden convertir a tetrathioperrhenate por la acción de hidrosulfuro de amonio.
Otros compuestos
Dibororrenio (ReB 2) es un compuesto duro que tiene la dureza similar a la de carburo de tungsteno, carburo de silicio, diboruro de titanio o diboruro de circonio.
Compuestos organo-renio
Decacarbonyl Dirhenium es la entrada más común de organo-renio química. Su reducción con sodio amalgama da Na [Re (CO) 5] con renio en el estado de oxidación formal -1. Dirhenium decacarbonyl puede ser oxidado con bromo a bromopentacarbonylrhenium (I):
- Re 2 (CO) 10 + Br 2 → 2 Re (CO) 5 Br
La reducción de esta pentacarbonilo con zinc y ácido acético da pentacarbonylhydridorhenium:
- Re (CO) 5 Br + Zn + HOAc → Re (CO) 5 H + ZnBr (OAc)
Methylrhenium trióxido ("MTO"), CH 3 ReO 3 es una volátil, sólido incoloro se ha utilizado como un catalizador en algunos experimentos de laboratorio. Se puede preparar por muchas rutas, un método típico es la reacción de Re 2 O 7 y tetrametilestaño:
- Re 2 O 7 + (CH 3) 4 Sn → CH 3 ReO 3 + (CH3) 3 3 SnOReO
Se conocen derivados de alquilo y arilo análoga. MTO cataliza para las oxidaciones con peróxido de hidrógeno . Terminal alquinos producir el ácido o éster correspondiente, dicetonas de rendimiento internos alquinos y alquenos dan epóxidos. MTO también cataliza la conversión de aldehídos y diazoalcanos en un alqueno.
Nonahydridorhenate

9.
Un derivado distintivo de renio es nonahydridorhenate, pensado originalmente para ser el anión rhenide, Re -
, Pero en realidad contiene el ReH 2-
9 de aniones en el que el estado de oxidación de renio es 7.
Aparición

El renio es uno de los elementos más raros en la corteza terrestre con una concentración media de 1 ppb; otras fuentes citan el número de 0.5 ppb por lo que es el elemento más abundante 77a en la corteza terrestre. Renio probablemente no se encuentra libre en la naturaleza (su posible presencia natural es incierto), pero se produce en cantidades de hasta 0,2% en el mineral molibdenita (que es principalmente disulfuro de molibdeno), la fuente comercial importante, aunque se han encontrado muestras individuales molibdenita con un máximo de 1,88%. Chile cuenta con reservas de renio más grandes del mundo, una parte de los depósitos de mineral de cobre, y fue el productor líder a partir de 2005. Fue sólo recientemente que la primera renio mineral se encontró y se describe (en 1994), una renio mineral de sulfuro (res 2) condensación de un fumarola en Rusia 's Volcán Kudriavy, Isla Iturup, en el Islas Kuriles. Kudryavy descarga hasta 20-60 kg renio por años principalmente en forma de disulfuro de renio. Nombrado Reniíta, este raro mineral comandos de precios altos entre los coleccionistas.
Producción

Renio comercial se extrae del gas-tostador de combustión molibdeno obtenido a partir de minerales de cobre y sulfuro. Algunos minerales de molibdeno contienen 0,001% a 0,2% de renio. Renio (VII) y óxido ácido perrénico se disuelven fácilmente en el agua; que son lixiviados a partir de polvos y gases de combustión y se extrajeron por precipitación con potasio o cloruro de amonio como sales de perrenato, y se purificaron por recristalización. La producción mundial total es de entre 40 y 50 toneladas / año; los principales productores se encuentran en Chile, Estados Unidos, Perú y Kazajstán. Reciclaje de catalizadores de Pt-Re y aleaciones especiales utilizados permiten la recuperación de otras 10 toneladas por año. Los precios para el metal aumentó rápidamente a principios de 2008, de $ 1000- $ 2000 por kg en el período 2003-2006 a más de $ 10.000 en febrero de 2008. La forma de metal se prepara mediante la reducción amonio perrenato con hidrógeno a altas temperaturas:
- 2 NH 4 ReO 4 + 7 H 2 → 2 Re + 8 H2O + 2 NH 3
Aplicaciones

El renio se añade a superaleaciones de alta temperatura que se utilizan para hacer de motores a reacción partes, usando 70% de la producción de renio en todo el mundo. Otra aplicación importante es in-platino renio catalizadores , que se utilizan principalmente en la fabricación de plomo exento, de alto octanaje gasolina.
Aleaciones
La base de níquel- superaleaciones han mejorado la fluencia con la adición de renio. Las aleaciones contienen normalmente 3% o 6% de renio. Aleaciones de segunda generación contienen 3%; estas aleaciones se utilizan en los motores de la F-16 y F-15, mientras que las aleaciones más nuevos de la tercera generación de un solo cristal contienen 6% de renio; que se utilizan en el F-22 y F-35 motores. Renio también se utiliza en las superaleaciones, como CMSX-4 (segunda generación) y CMSX-10 (3rd gen) que se utilizan en la industria motores de turbina de gas como el GE 7FA. El renio puede causar superaleaciones a convertirse microestructuralmente inestable, formando TCP indeseable (topológicamente compacta) fases . En la generación de cuarta y quinta superaleaciones, rutenio se utiliza para evitar este efecto. Entre otros, el nuevo superaleaciones son EPM-102 (con 3% de Ru) y TMS-162 (con 6% de Ru), ambos conteniendo 6% de renio, así como TMS-138 y TMS-174.

Para 2006, el consumo se da como 28% para General Electric, el 28% Rolls-Royce plc y el 12% Pratt & Whitney, todo para superaleaciones, mientras que el uso de catalizadores sólo representa el 14% y el resto de aplicaciones utiliza el 18%. En 2006, el 77% del consumo de renio en los Estados Unidos fue en aleaciones. La creciente demanda de motores a reacción militar y el suministro constante hacen necesario el desarrollo de superaleaciones con un contenido de renio inferior. Por ejemplo, el más reciente CFM International CFM56 turbina de alta presión (HPT) cuchillas usarán René N515 con un contenido de renio de 1,5% en lugar de René N5 con 3%.
Renio mejora las propiedades de tungsteno . Aleaciones de tungsteno renio son más dúctiles a baja temperatura, que les permite ser más fácil de mecanizar. También se mejora la estabilidad a alta temperatura. El efecto aumenta con la concentración de renio, y aleaciones de tungsteno, por tanto, se producen con hasta 27% de Re, que es el límite de solubilidad. Una aplicación para las aleaciones de tungsteno renio es Fuentes de rayos-X. El alto punto de fusión de ambos compuestos, junto con la masa atómica alta, hace estable frente al impacto de electrones prolongado. Aleaciones de tungsteno renio también se aplican como termopares para medir temperaturas de hasta 2.200 ° C .
La estabilidad a alta temperatura, baja presión de vapor, buena resistencia al desgaste y capacidad para resistir la corrosión arco de renio son útiles en auto-limpieza contactos eléctricos. En particular, la descarga se produce durante la conmutación oxida los contactos. Sin embargo, el óxido de renio Re 2 O 7 tiene una pobre estabilidad (sublima a ~ 360 ° C) y por lo tanto se elimina durante la descarga.
Renio tiene un punto de fusión alto y una baja presión de vapor similar a la de tántalo y tungsteno. Por lo tanto, los filamentos de renio exhiben una mayor estabilidad si el filamento no es operado en el vacío, pero en la atmósfera que contiene oxígeno. Estos filamentos son ampliamente utilizados en los espectrómetros de masas , en medidores de iones y de lámparas de destellos en fotografía .
Catalizadores
Renio en forma de aleación de platino-renio se utiliza como catalizador para reformado catalítico, que es un proceso químico para convertir refinería de petróleo naftas de baja índices de octano en productos líquidos de alto octanaje. En todo el mundo, el 30% de los catalizadores utilizados para este proceso contiene renio. La metátesis de olefinas es la otra reacción para la cual renio se utiliza como catalizador. Normalmente RE 2 O 7 en alúmina se utiliza para este proceso. Catalizadores de renio son muy resistentes a envenenamiento químico de nitrógeno, azufre y fósforo, y así se utilizan en ciertos tipos de reacciones de hidrogenación.
Otros usos
188 Re y 186 isótopos Re son radiactivos y se utilizan para el tratamiento de cáncer de hígado. Ambos tienen similar profundidad de penetración en el tejido (5 mm para 186 Re y 11 mm para 188 Re), pero 186 Re tiene ventaja de mayor duración (90 horas frente a 17 horas).
Relatado por tendencias periódicas, renio tiene una química similar con tecnecio ; trabajo realizado para la etiqueta de renio en compuestos de interés a menudo se puede traducir a tecnecio. Esto es útil para radiofarmacia, donde es difícil trabajar con tecnecio - 99m especialmente el isótopo utilizado en la medicina - debido a su costo y corta vida media.
Precaución
Se sabe muy poco acerca de la toxicidad de renio y sus compuestos porque se utilizan en cantidades muy pequeñas. Las sales solubles, tales como los haluros de renio o perrenatos, podrían ser peligrosos debido a elementos distintos de renio o debido a renio sí mismo. Sólo unos pocos compuestos de renio han sido probados por su toxicidad aguda; dos ejemplos son perrenato de potasio y tricloruro de renio, que se inyecta como una solución en ratas. El perrenato tenía una LD 50 valor de 2,800 mg / kg después de siete días (esto es muy baja toxicidad, similar a la de la sal de mesa) y el tricloruro de renio mostraron LD 50 de 280 mg / kg.
