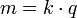Electr??lisis
Acerca de este escuelas selecci??n Wikipedia
SOS Children ha intentado que el contenido de Wikipedia m??s accesible por esta selecci??n escuelas. Visite el sitio web de Aldeas Infantiles SOS en http://www.soschildren.org/

En la qu??mica y de fabricaci??n , la electr??lisis es un m??todo de usar una directo corriente el??ctrica (DC) para conducir una reacci??n qu??mica de otra forma no espont??nea. La electr??lisis es comercialmente muy importante como una etapa en la separaci??n de elementos a partir de fuentes naturales tales como minerales utilizando un celda electrol??tica.
Historia
La palabra electr??lisis procede del griego ἤλεκτρον [Ɛ̌ːlektron] "??mbar" y λύσις [Lisis] "disoluci??n".
- 1785 - Generador electrost??tico de Martinus van Marum se utiliz?? para reducir el esta??o , zinc , y antimonio partir de sus sales utilizando la electr??lisis.
- 1800 - William Nicholson y Johann Ritter descompone el agua en hidr??geno y ox??geno .
- 1807 - El potasio , sodio , bario , calcio y magnesio fueron descubiertas por Sir Humphry Davy mediante electr??lisis.
- 1875 - Paul ??mile Lecoq de Boisbaudran descubri?? el galio mediante electr??lisis.
- 1886 - El fl??or fue descubierto por Henri Moissan mediante electr??lisis.
- 1886 - Proceso Hall-H??roult desarrollado para la fabricaci??n de aluminio
- 1890 - Proceso de Castner-Kellner desarrollado para la fabricaci??n de hidr??xido de sodio
Visi??n de conjunto
La electr??lisis es el paso de una directo corriente el??ctrica a trav??s de un i??nica sustancia que es ya sea fundido o disuelto en un disolvente adecuado, lo que resulta en las reacciones qu??micas en los electrodos y la separaci??n de materiales.
Los principales componentes necesarios para lograr la electr??lisis son:
- Una Electrolito: una sustancia que contiene gratuitas iones que son los portadores de corriente el??ctrica en el electrolito. Si los iones no son m??viles, como en una sal s??lida entonces no se puede producir electr??lisis.
- La corriente continua (CC) Suministro directo: proporciona la energ??a necesaria para crear o descargar los iones en el electrolito. La corriente el??ctrica es transportada por los electrones en el circuito externo.
- Dos electrodos: una conductor el??ctrico que proporciona la interfaz f??sica entre el circuito el??ctrico que proporciona la energ??a y la electr??lito
Electrodos de metales , grafito y de semiconductores de material son ampliamente utilizados. Elecci??n de electrodo adecuado depende de la reactividad qu??mica entre el electrodo y el electrolito y el coste de fabricaci??n.
Proceso de electr??lisis
El proceso clave de la electr??lisis es el intercambio de los ??tomos y iones mediante la retirada o la adici??n de electrones desde el circuito externo. Los productos requeridos de electr??lisis est??n en un estado f??sico diferente del electrolito y se pueden quitar por algunos procesos f??sicos. Por ejemplo, en la electr??lisis de salmuera para producir hidr??geno y cloro, los productos son gaseosos. Estos productos gaseosos de la burbuja del electrolito y se recogen.
- 2 NaCl + 2 H 2 O → 2 NaOH + H + 2 Cl 2
Un l??quido que contiene iones m??viles (electrolitos) es producido por:
- Solvataci??n o reacci??n de una compuesto i??nico con un disolvente (tal como agua) para producir iones m??viles
- Un compuesto i??nico se funde (fundida) por calentamiento
Un potencial el??ctrico se aplica a trav??s de un par de electrodos sumergidos en el electrolito.
Cada electrodo atrae a los iones que son de lo contrario cargo . Iones cargados positivamente ( cationes ) se mueven hacia el c??todo (negativo) de electrones que proporciona, mientras que los iones cargados negativamente ( aniones ) se mueven hacia el ??nodo positivo.
En los electrodos, los electrones son absorbidos o liberados por los ??tomos y iones. Esos ??tomos que ganan o pierden electrones para convertirse en iones cargados pasan en el electrolito. Esos iones que ganar o perder electrones para convertirse en ??tomos no cargados se separan del electrolito. La formaci??n de ??tomos no cargados de iones se denomina descarga.
La energ??a necesaria para hacer que los iones migren a los electrodos, y la energ??a para hacer que el cambio en el estado i??nico, es proporcionada por la fuente externa de potencial el??ctrico.
La oxidaci??n y la reducci??n en los electrodos
La oxidaci??n de los iones o mol??culas neutras se produce en el ??nodo, y el reducci??n de los iones o mol??culas neutras se produce en el c??todo. Por ejemplo, es posible oxidar los iones ferrosos a iones f??rricos en el ??nodo:
- Fe 2+
aq → Fe 3+
e aq + -
Tambi??n es posible reducir iones ferricianuro a iones de ferrocianuro en el c??todo:
- Fe (CN) 3-
6 + e - → Fe (CN) 4-
6
Las mol??culas neutrales tambi??n pueden reaccionar a ninguno de los electrodos. Por ejemplo: p-benzoquinona se puede reducir a la hidroquinona en el c??todo:
![]() + 2 e - + 2 H + →
+ 2 e - + 2 H + → 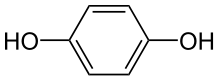
En el ??ltimo ejemplo, los iones H + (iones de hidr??geno) tambi??n participan en la reacci??n, y son proporcionados por un ??cido en la soluci??n, o el propio disolvente (agua, metanol, etc.). Reacciones de electr??lisis que implican iones H + son bastante comunes en soluciones ??cidas. En las soluciones de agua alcalina, las reacciones que implican OH - (iones hidr??xido) son comunes.
Las sustancias oxidadas o reducidas tambi??n puede ser el disolvente (normalmente agua) o los electrodos. Es posible tener los gases de electr??lisis que implica.
Cambios de energ??a durante la electr??lisis
La cantidad de energ??a el??ctrica que debe ser a??adido es igual al cambio en la energ??a libre de Gibbs de la reacci??n m??s las p??rdidas en el sistema. Las p??rdidas pueden (en teor??a) ser arbitrariamente cercano a cero, por lo que el m??ximo termodin??mico eficiencia es igual a la entalp??a de cambio dividido por el cambio de energ??a libre de la reacci??n. En la mayor??a de los casos, la entrada el??ctrica es mayor que el cambio de entalp??a de la reacci??n, por lo que parte de la energ??a se libera en forma de calor. En algunos casos, por ejemplo, en la electr??lisis de vapor de agua en hidr??geno y ox??geno a alta temperatura, es todo lo contrario. El calor se absorbe de los alrededores, y el valor de calentamiento del hidr??geno producido es m??s alta que la de entrada el??ctrica.
T??cnicas relacionadas
Las siguientes t??cnicas est??n relacionados con la electr??lisis:
- Las c??lulas electroqu??micas, incluyendo el hidr??geno pila de combustible, utilizar las diferencias en Potencial de electrodo est??ndar con el fin de generar un potencial el??ctrico de potencia ??til que se puede extraer. Aunque relacionadas a trav??s de la interacci??n de iones y electrodos, la electr??lisis y el funcionamiento de las c??lulas electroqu??micas son muy diferentes. Una c??lula qu??mica no debe ser pensado como la realizaci??n de "electrolisis a la inversa".
Ley de Faraday de la electr??lisis
Primera ley de la electr??lisis
En 1832, Michael Faraday inform?? que la cantidad de elementos separados por pasar una corriente el??ctrica a trav??s de un fundido o disuelto sal es proporcional a la cantidad de carga el??ctrica que pasa a trav??s del circuito. Esto se convirti?? en la base de la primera ley de la electr??lisis:
Segunda ley de la electr??lisis
Faraday descubri?? que cuando se pasa la misma cantidad de electricidad a trav??s de diferentes electrolitos conectados en serie, la masa de sustancia liberada / depositada en los electrodos es directamente proporcional a sus pesos equivalentes.
Los usos industriales

- Producci??n de aluminio , de litio , de sodio , de potasio , de magnesio , de calcio
- Culombiom??tricas t??cnicas se pueden utilizar para determinar la cantidad de materia transformada durante la electr??lisis mediante la medici??n de la cantidad de electricidad requerida para realizar la electr??lisis
- La producci??n de cloro y de hidr??xido de sodio
- Produccion de clorato de sodio y cloruro de potasio
- Producci??n de compuestos org??nicos perfluorados tales como ??cido trifluoroac??tico
- Produccion de cobre electrol??tico como c??todo, de refinado de cobre de menor pureza como una ??nodo.
La electr??lisis tiene muchos otros usos:
- Electrometalurgia es el proceso de reducci??n de metales a partir de compuestos met??licos para obtener la forma pura de metal por medio de electr??lisis. Por ejemplo, hidr??xido de sodio en su forma fundida se separa por electr??lisis en sodio y ox??geno, ambos de los cuales tienen usos qu??micos importantes. (El agua se produce al mismo tiempo).
- La anodizaci??n es un proceso electrol??tico que hace que la superficie de metales resistentes a la corrosi??n . Por ejemplo, los barcos se salvan de ser corro??do por el ox??geno en el agua por este proceso. El proceso tambi??n se utiliza para decorar superficies.
- La bater??a funciona mediante el proceso inverso a la electr??lisis.
- Producci??n de ox??geno para naves espaciales y submarinos nucleares.
- Galvanoplastia se utiliza en capas de metales para fortalecerlos. Galvanoplastia se utiliza en muchas industrias para fines funcionales o decorativos, como en carrocer??as de veh??culos y monedas de n??quel.
- Producci??n de hidr??geno para combustible, utilizando una fuente barata de energ??a el??ctrica.
- Grabado electrol??tico de superficies met??licas como herramientas o cuchillos con una marca permanente o logotipo.
La electr??lisis se utiliza tambi??n en la limpieza y conservaci??n de artefactos antiguos. Debido a que el proceso separa las part??culas no met??licas de las met??licas, es muy ??til para limpiar monedas antiguas y objetos a??n m??s grandes.
Competir medias reacciones en disoluci??n electr??lisis
Uso de una c??lula que contiene electrodos de platino inertes, la electr??lisis de soluciones acuosas de algunas sales conduce a la reducci??n de los cationes (por ejemplo, la deposici??n de metal con, por ejemplo, sales de zinc) y la oxidaci??n de los aniones (por ejemplo, la evoluci??n de bromo con bromuros). Sin embargo, con sales de algunos metales (por ejemplo, sodio) de hidr??geno se desarroll?? en el c??todo, y por sales que contienen algunos aniones (por ejemplo, sulfato SO 4 2-) se desprende ox??geno en el ??nodo. En ambos casos esto es debido al agua que est?? siendo reducida para formar hidr??geno o oxidado para formar ox??geno. En principio, el voltaje requerido para electrolizar una soluci??n de sal puede ser derivada de la potencial de electrodo est??ndar para las reacciones en el ??nodo y el c??todo. La potencial de electrodo est??ndar es directamente relacionado con la energ??a libre de Gibbs ,? G, para las reacciones en cada electrodo y se refiere a un electrodo sin que circule corriente. Un extracto de la tabla de potenciales de electrodo est??ndar se muestra a continuaci??n.
| Semirreacci??n | ?? E (V) | Ref. |
|---|---|---|
| Na + + e - | -2.71 | |
| Zn 2 + 2 + e - | -0.7618 | |
| 2H + + 2 e - | ≡ 0 | |
| Br 2 (ac) + 2 e - | 1.0873 | |
| O 2 (g) + 4H + + 4 e - | 1.23 | |
| Cl 2 (g) + 2 e - | 1.36 | |
| S 2 O 2- 8 + 2 e - 4 | 2.07 |
En t??rminos de la electr??lisis, esta tabla debe interpretarse de la siguiente manera
- especies oxidadas (a menudo un cati??n) m??s cerca de la parte superior de la tabla son m??s dif??ciles de reducir que las especies oxidadas m??s abajo. Por ejemplo, es m??s dif??cil reducir iones de sodio al metal de sodio de lo que es para reducir iones de zinc a zinc metal.
- especies reducidas (a menudo un ani??n) cerca de la parte inferior de la tabla son m??s dif??ciles de oxidar especies reducidas de m??s arriba. Por ejemplo, es m??s dif??cil de oxidar aniones de sulfato de lo que es para oxidar aniones bromuro.
Usando el La ecuaci??n de Nernst potencial de electrodo se puede calcular para una concentraci??n espec??fica de iones, la temperatura y el n??mero de electrones que participan. Para el agua pura ( pH 7):
- el potencial de electrodo para la producci??n de hidr??geno es la reducci??n de -0,41 V
- el potencial del electrodo para el ox??geno produciendo la oxidaci??n es 0,82 V.
Las cifras comparables calculadas de manera similar, por 1M bromuro de zinc, ZnBr 2, son -0,76 V para la reducci??n a Zn metal y 1,10 V para la producci??n de bromo oxidaci??n. La conclusi??n de estos datos es que el hidr??geno debe ser producido en el c??todo y ox??geno en el ??nodo de la electr??lisis del agua que est?? en desacuerdo con la observaci??n experimental de que el zinc met??lico se deposita y se produce bromo. La explicaci??n es que estos potenciales calculados s??lo indican la reacci??n termodin??micamente preferido. En la pr??ctica tienen que ser tomado muchos otros factores en cuenta, tales como la cin??tica de algunas de las etapas de reacci??n implicadas. Estos factores juntos hacen que un potencial m??s alto se requiere para la reducci??n y oxidaci??n del agua de lo previsto, y ??stos se denominan sobrepotenciales. Experimentalmente se sabe que sobrepotenciales dependen del dise??o de la c??lula y la naturaleza de los electrodos.
Para la electr??lisis de una soluci??n de cloruro de sodio neutro (pH 7), la reducci??n de los iones de sodio es termodin??micamente muy dif??cil y el agua se reduce la evoluci??n de hidr??geno dejando iones de hidr??xido en soluci??n. En el ??nodo se observa la oxidaci??n de cloro en lugar de la oxidaci??n de agua, ya que el sobrepotencial para la oxidaci??n de cloruro a cloro es menor que el sobrepotencial para la oxidaci??n de agua a ox??geno . Los iones de hidr??xido y disuelto cloro gas reaccionan adicionalmente para formar ??cido hipocloroso. Las soluciones acuosas resultantes de este proceso se llama agua electrolizada y se utiliza como un agente desinfectante y de limpieza.
Electr??lisis del agua
Un uso importante de la electr??lisis del agua es para producir hidr??geno .
- 2 H2O (l) → 2 H 2 (g) + O2 (g); E 0 = -1.229 V
El hidr??geno puede ser utilizado como un combustible para la alimentaci??n de motores de combusti??n interna por motores de combusti??n o el??ctricos a trav??s de c??lulas de combustible de hidr??geno (v??ase Veh??culo de hidr??geno). Esto ha sido sugerido como un enfoque para cambiar econom??as del mundo desde el estado actual de la dependencia casi total sobre los hidrocarburos para la energ??a (Ver econom??a del hidr??geno.)
La la eficiencia energ??tica de la electr??lisis del agua es muy variable. La eficiencia de un electrolizador es una medida de la entalp??a contenida en el hidr??geno (a menos de combusti??n ir con ox??geno, o alguna otra reacci??n posterior), en comparaci??n con la energ??a el??ctrica de entrada. / Valores de entalp??a de calor para el hidr??geno son bien publicados en textos de ciencia e ingenier??a, como 144 MJ / kg. Tenga en cuenta que las pilas de combustible (no electrolizadores) no pueden utilizar esta cantidad de calor / entalp??a, que ha dado lugar a cierta confusi??n en el c??lculo de los valores de eficiencia para ambos tipos de tecnolog??a. En la reacci??n, algo de energ??a se pierde en forma de calor, un subproducto in??til. Algunos informes citan eficiencias de entre 50% y 70% para los electrolizadores alcalinos; sin embargo, mucho m??s altas eficiencias de pr??ctica est??n disponibles con el uso de PEM y la tecnolog??a catal??tica, la eficiencia tales como 95%. En los EE.UU. todav??a hay una tendencia err??nea ocasional a utilizar el "Valor inferior de calefacci??n 'de eficiencias. Este valor (obsolescencia) no representa la cantidad total de energ??a en el hidr??geno, por lo tanto, la eficiencia parece ser menor que cuando se utilizan los valores m??s definidos con precisi??n. El m??ximo te??rico considera la cantidad total de energ??a necesaria para la formaci??n del hidr??geno y el ox??geno del agua. Tenga en cuenta que (en contextos m??s amplios de la eficiencia energ??tica), estos valores se refieren s??lo a la eficiencia de la conversi??n de energ??a el??ctrica en energ??a qu??mica del hidr??geno; la energ??a que se pierde en la generaci??n de la electricidad no est?? incluido.
NREL estima que 1 kg de hidr??geno (aproximadamente equivalente a 3 kg o 4 L, del petr??leo en t??rminos de energ??a) podr??an ser producidos por el viento impulsado por electr??lisis entre 5,55 d??lares en el corto plazo y $ 2.27 para el largo plazo.
Cerca del 4% del gas de hidr??geno producido en todo el mundo es creado por electr??lisis, y normalmente se utiliza el sitio. El hidr??geno se utiliza para la creaci??n de amoniaco para el fertilizante a trav??s de la Proceso de Haber, y la conversi??n de fuentes de petr??leo pesados a fracciones m??s ligeras a trav??s hidrocraqueo.
Electrocristalizaci??n
Una aplicaci??n especializada de la electr??lisis implica el crecimiento de cristales de conductores sobre uno de los electrodos de especies oxidadas o reducidas que se generan in situ. La t??cnica se ha utilizado para obtener cristales individuales de conductores el??ctricos de baja dimensi??n, tales como sales de transferencia de carga.
Los experimentadores
Pioneros cient??ficos de la electr??lisis incluyen:
- Antoine Lavoisier
- Robert Bunsen
- Humphry Davy
- Michael Faraday
- Paul H??roult
- Svante Arrhenius
- Adolph Wilhelm Hermann Kolbe
- William Nicholson
- Joseph Louis Gay-Lussac
- Alexander von Humboldt
- Johann Wilhelm Hittorf
Pioneros de bater??as:
- Alessandro Volta
- Gaston Plant??
M??s recientemente, la electr??lisis de agua pesada se realiz?? por Fleischmann y Pons en su famoso experimento, lo que resulta en la generaci??n de calor an??malo y el reclamo desacreditado de fusi??n fr??a.