
Termodinámica
Sabías ...
SOS Children, que corre cerca de 200 sos escuelas en el mundo en desarrollo, organizó esta selección. Infantil SOS es la mayor donación de caridad del mundo niños huérfanos y abandonados de la oportunidad de la vida familiar.
Termodinámica (del griego θερμη, therme, que significa " calor "y δυναμις, dunamis, significado" poder ") es una rama de la física y se utiliza ampliamente en la química . termodinámica estudia los efectos de los cambios en la temperatura , presión y volumen en sistemas físicos en el escala macroscópica mediante el análisis del movimiento colectivo de sus partículas usando estadísticas . A grandes rasgos, el calor significa "energía en tránsito" y dinámica se refiere al "movimiento"; por lo tanto, en la termodinámica esencia estudia el movimiento de la energía y cómo la energía infunde movimiento. Históricamente, la termodinámica se desarrolló a partir de la necesidad de aumentar la la eficiencia de los primeros motores de vapor .
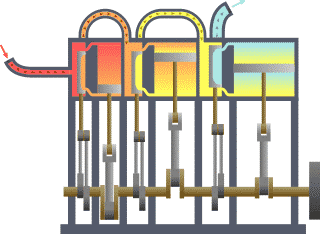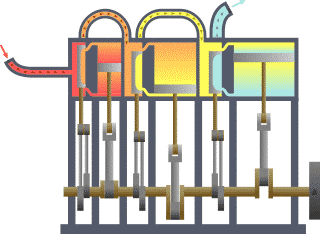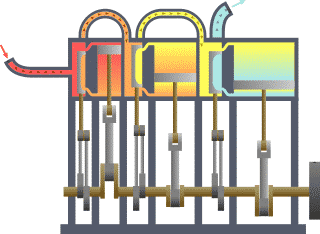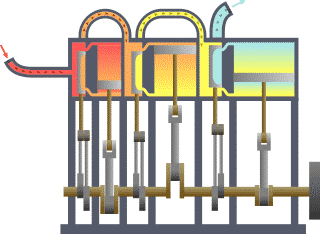
El punto de partida para la mayoría de las consideraciones termodinámicas son la leyes de la termodinámica, que postulan que la energía se pueden intercambiar entre los sistemas físicos como el calor o el trabajo . También postulan la existencia de una cantidad llamada entropía , que se puede definir para cualquier sistema. En termodinámica, las interacciones entre grandes conjuntos de objetos se estudian y clasifican. Central de esta son los conceptos de sistema y alrededores. Un sistema está compuesto de partículas, cuyos movimientos promedio definir sus propiedades, que a su vez se relacionan entre sí a través de ecuaciones de estado. Las propiedades se pueden combinar para expresar energía interna y potenciales termodinámicos, que son útiles para determinar las condiciones para equilibrio y procesos espontáneos.
Con estas herramientas, la termodinámica describe cómo los sistemas responden a los cambios en su entorno. Esto se puede aplicar a una amplia variedad de temas en la ciencia y la ingeniería , tales como motores, transiciones de fase, reacciones químicas , fenómenos de transporte, e incluso los agujeros negros . Los resultados de la termodinámica son esenciales para otros campos de la física y de la química , ingeniería química, ingeniería aeroespacial, ingeniería mecánica , biología celular, ingeniería biomédica, ciencia de los materiales , y la economía por nombrar algunos.
Historia

La historia de la termodinámica como disciplina científica en general, comienza con Otto von Guericke quien en 1650 construyó y diseñó la primera del mundo bomba de vacío y creó el mundo por primera vez de vacío (conocido como el Hemisferios de Magdeburgo). Guericke fue impulsado para hacer el vacío con el fin de refutar Aristóteles 'desde hace mucho tiempo suposición s de que "la naturaleza aborrece el vacío". Poco después de Guericke, el físico irlandés y químico Robert Boyle había aprendido de los diseños de Guericke y en 1656, en coordinación con el científico Inglés Robert Hooke, construyó una bomba de aire. El uso de esta bomba, Boyle y Hooke observaron una correlación entre la presión, temperatura y volumen. A tiempo, Ley de Boyle fue formulado, que establece que la presión y el volumen son inversamente proporcionales. Luego, en 1679, en base a estos conceptos, un asociado de Boyle nombrado Denis Papin construyó una digestor hueso, que era un recipiente cerrado con una tapa hermética que limita vapor hasta que se generó una alta presión.
Diseños posteriores implementaron una válvula de escape de vapor que mantiene la máquina de explosión. Al observar la válvula rítmicamente moverse arriba y abajo, Papin concibió la idea de un pistón y un motor de cilindros. No lo hizo, sin embargo, sigue adelante con su proyecto. Sin embargo, en 1697, basado en los diseños de Papin, ingeniero Thomas Savery construyó el primer motor. Aunque estos primeros motores eran toscas e ineficiente, que atrajeron la atención de los científicos más importantes de la época. Uno de estos fue el científico Sadi Carnot, el "padre de la termodinámica", que en 1824 publicó Reflexiones sobre la potencia motriz del fuego, un discurso sobre el calor, el poder y la eficiencia del motor. El documento describe las relaciones energéticas básicas entre la Máquina de Carnot, la Ciclo de Carnot, y La fuerza motriz. Esto marca el comienzo de la termodinámica como ciencia moderna.
La termodinámica término fue acuñado por James Joule en 1858 para designar la ciencia de las relaciones entre el calor y de energía. Antes de 1849, "termodinámica", como un término funcional, se utilizó en Papel de William Thomson Una Cuenta de la teoría de Carnot de la Fuerza Motriz de calor. El primer libro de texto termodinámica fue escrito en 1859 por William Rankine, originalmente se formó como un físico y profesor de ingeniería civil y mecánica en la Universidad de Glasgow.
Las leyes de la termodinámica
En termodinámica, hay cuatro leyes de validez muy general, y como tales no dependen de los detalles de las interacciones o los sistemas que se está estudiando. Por lo tanto, se pueden aplicar a los sistemas sobre los que uno conoce otra cosa que el equilibrio de la energía y la materia de transferencia. Ejemplos de esto incluyen Einstein predicción de 's emisión espontánea alrededor de la vuelta del siglo 20 y la investigación actual sobre la termodinámica de los agujeros negros .
Las cuatro leyes son:
- Ley cero de la termodinámica, que indica que equilibrio termodinámico es una relación de equivalencia .
- Si dos sistemas termodinámicos son por separado en equilibrio térmico con un tercio, también están en equilibrio térmico entre sí.
- Primera ley de la termodinámica , sobre la conservacion de energia
- La entropía total de cualquier sistema termodinámico aislado tiende a aumentar con el tiempo, acercándose a un valor máximo.
- Como un sistema de se acerca asintóticamente cero absoluto de temperatura todos los procesos prácticamente cesan y la entropía del sistema se aproxima asintóticamente un valor mínimo; También declaró que: "la entropía de todos los sistemas y de todos los estados de un sistema es cero en el cero absoluto" o equivalente "es imposible de alcanzar el cero absoluto de temperatura por un número finito de procesos".
- Onsager relaciones recíprocas (a veces llamada la cuarta ley de la termodinámica)
- Expresar la igualdad de ciertas relaciones entre flujos y fuerzas en sistemas termodinámicos de cada equilibrio, pero donde una noción de existe equilibrio local.
- Ver también: Bose-Einstein y temperatura negativa.
Potenciales termodinámicos
Como puede deducirse de la ecuación de balance de energía (o ecuación Burks ') en un sistema termodinámico existen cantidades energéticos llamados potenciales termodinámicos, siendo la medida cuantitativa de la energía almacenada en el sistema. Los cinco potenciales más conocidos son:
| Energía interna | 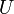 |
| Energía libre de Helmholtz | 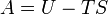 |
| Entalpía | 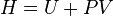 |
| Energía libre de Gibbs | 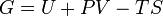 |
| Gran potencial | 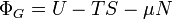 |
Otros potenciales termodinámicos pueden obtenerse a través Transformación de Legendre. Potenciales se utilizan para medir los cambios de energía en los sistemas a medida que evolucionan desde un estado inicial a un estado final. El usados potencial depende de las limitaciones del sistema, tales como la temperatura o la presión constante. La energía interna es la energía interna del sistema, la entalpía es la energía interna del sistema, más la energía relacionada con el trabajo presión-volumen, y Helmholtz y de Gibbs de energía son las energías disponibles en un sistema para realizar trabajo útil cuando la temperatura y el volumen o la presión y la temperatura son fijos, respectivamente.
La termodinámica clásica
Termodinámica clásica es la década de 1800 la variación original de principios de la termodinámica que se ocupan de los estados termodinámicos y propiedades como la energía, el trabajo y el calor, y con las leyes de la termodinámica, que carecen de toda una interpretación atómica. En forma preliminar, la termodinámica clásica se deriva de químico Robert Boyle 's 1662 postulado de que la presión P de una determinada cantidad de gas varía inversamente con su volumen V a temperatura constante; es decir, en forma de ecuación: PV = k, una constante. Desde aquí, una apariencia de un termo-ciencia comenzó a desarrollarse con la construcción de las primeras máquinas de vapor atmosférico éxito en Inglaterra por Thomas Savery en 1697 y Thomas Newcomen en 1712. La primera y segunda leyes de la termodinámica surgió simultáneamente en la década de 1850, principalmente fuera de las obras de William Rankine, Rudolf Clausius, y William Thomson (Lord Kelvin).
Termodinámica estadística
Con el desarrollo de teorías atómicas y moleculares en las finales de 1800 y principios de 1900, la termodinámica se le dio una interpretación molecular. Este campo se llama la termodinámica estadística, lo que puede ser pensado como un puente entre las propiedades macroscópicas y microscópicas de los sistemas. En esencia, la termodinámica estadística es una aproximación a la termodinámica situados en la mecánica estadística , que se centra en la obtención de resultados macroscópicos de los primeros principios. Se puede oponerse a su predecesor histórico termodinámica fenomenológica , que da descripciones científicas de los fenómenos con la evitación de detalles microscópicos. El enfoque estadístico es derivar todas las propiedades macroscópicas (temperatura, volumen, presión, energía, entropía, etc.) a partir de las propiedades de mover partículas constituyentes y las interacciones entre ellos (incluyendo los fenómenos cuánticos). Se encontró ser muy exitoso y por lo tanto se utiliza comúnmente.
La termodinámica química
La termodinámica química es el estudio de la interrelación de calor con reacciones químicas o con un cambio físico de Estado dentro de los confines de la leyes de la termodinámica. Durante los años 1873 a 1876 el físico matemático americano Josiah Willard Gibbs publicó una serie de tres artículos, siendo los más famosos En el equilibrio de sustancias heterogéneas, en la que mostraba cómo procesos termodinámicos podrían ser analizados gráficamente, mediante el estudio de la energía , la entropía , volumen , temperatura y presión de la sistema termodinámico, de tal manera para determinar si se produciría un proceso de forma espontánea. Durante el siglo 20, los químicos tales como Gilbert N. Lewis, Merle Randall, y EA Guggenheim comenzó a aplicar los métodos matemáticos de Gibbs para el análisis de los procesos químicos.
Sistemas termodinámicos
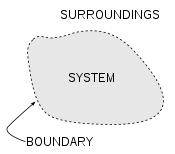
Un concepto importante en la termodinámica es el "sistema". Todo en el universo, excepto el sistema se conoce como entorno. Un sistema es la región del universo en estudio. Un sistema se separa del resto del universo por una límite que puede ser imaginario o no, pero que por convención delimita un volumen finito. Los posibles intercambios de trabajo , calor , o la materia entre el sistema y el entorno tienen lugar a través de esta frontera. Los límites son de cuatro tipos: fijo, móvil, reales, e imaginarios.
Básicamente, el "límite" es simplemente una línea de puntos imaginaria trazada en torno a un volumen de algo cuando no va a haber un cambio en la energía interna de que algo. Cualquier cosa que pasa a través de la frontera que efectúa un cambio en la energía interna de la algo tiene que tenerse en cuenta en la ecuación de balance de energía. Ese algo puede ser la región volumétrica que rodea a un solo átomo de resonancia de energía, tales como Max Planck se define en el 1900; puede ser un cuerpo de vapor o aire en un motor de vapor , tales como Sadi Carnot definido en 1824; puede ser el cuerpo de un ciclón tropical , como Kerry Emanuel teorizó en 1986 en el campo de la termodinámica atmosférica; también podría ser sólo uno nucleido (es decir, un sistema de quarks ) como algunos están teorizando actualmente en termodinámica cuántica.
Para un motor, un límite fijo significa que el pistón está bloqueado en su posición; como tal, un proceso de volumen constante se produce. En ese mismo motor, una frontera móvil permite que el pistón se mueva dentro y fuera. En los sistemas cerrados, los límites son reales, mientras que para el sistema abierto límites son a menudo imaginario. Hay cinco clases dominantes de los sistemas de:
- Sistemas Aislados - materia y energía no pueden cruzar la frontera
- Sistemas adiabáticos - calor no deben cruzar la frontera
- Sistemas diatérmicos - calor puede cruzar frontera
- Sistemas Cerrados - asunto no pueden cruzar la frontera
- Sistemas Abiertos - calor, trabajo, y la materia, podrán cruzar la frontera (a menudo llamado volumen de control en este caso)
Como pasa el tiempo en un sistema aislado, las diferencias internas en el sistema tienden a igualar las presiones y las temperaturas tienden a igualar, al igual que las diferencias de densidad. Un sistema en el que todos los procesos de igualación han ido prácticamente hasta la terminación, se considera que en una estado de equilibrio termodinámico.
En equilibrio termodinámico, las propiedades de un sistema son, por definición, invariable en el tiempo. Sistemas en equilibrio son mucho más simple y más fácil de entender que los sistemas que no están en equilibrio. A menudo, cuando el análisis de un proceso termodinámico, se puede suponer que cada estado intermedio en el proceso está en equilibrio. Esto también simplificará considerablemente la situación. Los procesos termodinámicos que se desarrollan tan lentamente que permiten a cada paso intermedio para ser un estado de equilibrio se dice que son procesos reversibles.
Parámetros termodinámicos
El concepto central de la termodinámica es el de la energía , la capacidad de hacer el trabajo. Según lo estipulado por la primera ley , la energía total del sistema y sus alrededores se conserva. Puede ser transferido a un cuerpo por calentamiento, compresión, o la adición de la materia, y se extrajo de un cuerpo, ya sea por enfriamiento, expansión, o la extracción de la materia. En comparación, en mecánica, los resultados de transferencia de energía a partir de una fuerza que provoca el desplazamiento, el producto de los dos es la cantidad de energía transferida. De manera similar, los sistemas termodinámicos pueden ser considerados como la transferencia de energía como resultado de una fuerza generalizada causando un desplazamiento generalizado, con el producto de los dos es la cantidad de energía transferida. Estos pares de fuerza-desplazamiento termodinámicas se conocen como variables conjugadas. Las variables termodinámicas conjugadas son más común de presión-volumen (parámetros mecánicos), la temperatura-entropía (parámetros térmicos), y el número de partículas potencial químico (parámetros de los materiales).
Instrumentos termodinámicos
Hay dos tipos de instrumentos termodinámicos, el metro y el depósito. Un metro termodinámico es cualquier dispositivo que mide cualquier parámetro de una sistema termodinámico. En algunos casos, el parámetro termodinámico es en realidad define en términos de un instrumento de medición idealizada. Por ejemplo, el ley cero indica que si dos cuerpos están en equilibrio térmico con un tercer cuerpo, sino que también están en equilibrio térmico entre sí. Este principio, según lo observado por James Maxwell en 1872, afirma que es posible medir la temperatura. Un idealizada termómetro es una muestra de un gas ideal a presión constante. Desde el ideales PV = nRT ley de los gases, el volumen de una muestra de este tipo puede ser utilizado como un indicador de la temperatura; De esta manera se define la temperatura. Aunque la presión se define mecánicamente, un dispositivo de medición de presión, llamada barómetro también puede ser construido a partir de una muestra de un gas ideal mantenido a una temperatura constante. La calorímetro es un dispositivo que se utiliza para medir y definir la energía interna de un sistema.
Un depósito termodinámico es un sistema que es tan grande que no altera apreciablemente sus parámetros de estado cuando se pone en contacto con el sistema de prueba. Se utiliza para imponer un valor particular de un parámetro de estado en el sistema. Por ejemplo, un depósito de presión es un sistema a una presión en particular, que impone que la presión sobre cualquier sistema de prueba que está conectado mecánicamente a. La atmósfera terrestre es a menudo utilizado como un depósito de presión.
Es importante que estos dos tipos de instrumentos son distintos. Un metro no realiza su tarea con precisión si se comporta como un depósito de la variable de estado que está tratando de medir. Si, por ejemplo, un termómetro fuera para actuar como un reservorio de temperatura que pueda alterar la temperatura del sistema que se está midiendo, y la lectura sería incorrecto. Metros ideales tienen ningún efecto sobre las variables de estado del sistema que se está midiendo.
Estados termodinámicos
Cuando un sistema está en equilibrio bajo un conjunto dado de condiciones, se dice que está en un estado definido. El estado del sistema puede ser descrito por una serie de variables intensivas y extensas variables. Las propiedades del sistema se pueden describir por una ecuación de estado que especifica la relación entre estas variables. Estado puede ser pensado como la descripción cuantitativa instantánea de un sistema con un número determinado de variables constantes
Los procesos termodinámicos
Un proceso termodinámico puede ser definida como la evolución energética de un sistema termodinámico de proceder de un estado inicial a un estado final. Normalmente, cada proceso termodinámico se distingue de otros procesos, en carácter enérgico, de acuerdo con lo parámetros, como la temperatura, la presión o volumen, etc., se mantienen fijas. Además, es útil agrupar estos procesos en pares, en los que cada variable se mantiene constante es un miembro de una par conjugado. Los siete procesos termodinámicos más comunes se muestran a continuación:
- Una proceso isobárico se produce a presión constante.
- Una proceso isócoro o proceso isométrico / isovolumétrica, ocurre a volumen constante.
- Una proceso isotérmico se produce a una temperatura constante.
- Una proceso adiabático se produce sin pérdida o ganancia de calor.
- Una proceso isentrópico (proceso adiabático reversible) se produce a una entropía constante.
- Una isoentálpica proceso se produce a una entalpía constante.
- La proceso de estado estacionario se produce sin un cambio en la energía interna de un sistema.
