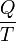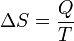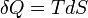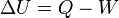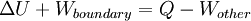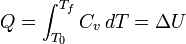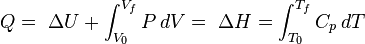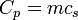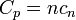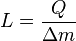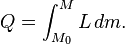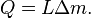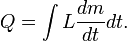Calor
Sabías ...
Voluntarios SOS ayudaron a elegir artículos e hicieron otro material curricular Patrocinar los niños ayuda a los niños en el mundo en desarrollo para aprender también.
En la física , el calor, simbolizado por Q, es la energía transferida de un cuerpo o sistema a otro debido a una diferencia en la temperatura . En la termodinámica , el TDS de cantidad se utiliza como una medida representativa de calor, que es la temperatura absoluta de un objeto multiplicada por la cantidad de diferencial de un sistema de entropía medida en el límite del objeto. El calor puede fluir espontáneamente de un objeto con una temperatura alta para un objeto con una temperatura más baja. La transferencia de calor de un objeto a otro objeto con una temperatura igual o superior sólo puede ocurrir con la ayuda de una bomba de calor. Cuerpos de alta temperatura, que a menudo resultan en altas tasas de la transferencia de calor, se pueden crear mediante reacciones químicas (como quema), reacciones nucleares (por ejemplo, fusión que tienen lugar en el interior del Sol ), electromagnética disipación (como en estufas eléctricas), o disipación mecánica (tal como fricción). El calor puede ser transferido entre los objetos por radiación, conducción y convección. Temperatura se utiliza como una medida de la energía interna o entalpía , es decir el nivel de movimiento elemental dando lugar a la transferencia de calor. El calor sólo puede transferirse entre los objetos, o áreas dentro de un objeto, con diferentes temperaturas (como propuesta por el ley cero de la termodinámica) y, a continuación, en la ausencia de trabajo, sólo en la dirección del cuerpo más frío (según la segunda ley de la termodinámica ). La temperatura y la fase de una sustancia objeto de transferencia de calor se determinan por calor latente y capacidad calorífica. Un término relacionado es energía térmica, vagamente definido como la energía de un cuerpo que aumenta con su temperatura .

Visión de conjunto
La primera ley de la termodinámica establece que la energía de una sistema cerrado se conserva. Por lo tanto, para cambiar la energía de un sistema, la energía debe ser transferida hacia o desde el sistema. El calor y el trabajo son los únicos dos mecanismos por los que la energía puede ser transferida hacia o desde una masa de control. El calor es la transferencia de energía causada por la diferencia de temperatura. La unidad de la cantidad de energía transferida por calor en Sistema Internacional de Unidades SI es el Joule (J), aunque la Unidad Térmica Británica y la calorías son todavía de vez en cuando utiliza en los Estados Unidos. La unidad para la tasa de transferencia de calor es la vatios (W = J / s).
La transferencia de calor es un función de trayectoria ( cantidad de proceso), en oposición a una función de punto ( cantidad de estado). El calor fluye entre los sistemas que no están en equilibrio térmico entre sí; fluye espontáneamente a partir de las áreas de alta temperatura a las áreas de baja temperatura. Cuando dos cuerpos de diferente temperatura se ponen en contacto térmico, intercambiarán energía interna hasta que se igualan sus temperaturas; es decir, hasta que alcanzan equilibrio térmico. El adjetivo caliente se utiliza como un término relativo para comparar la temperatura del objeto a la de los alrededores (o la de la persona que utiliza el término). El calor término se utiliza para describir el flujo de energía. En ausencia de interacciones de trabajo, el calor que se transfiere a un objeto termina siendo almacenado en el objeto en forma de energía interna.

El calor específico se define como la cantidad de energía que tiene que ser transferido hacia o desde una unidad de masa o mol de una sustancia para cambiar su temperatura por uno grado. El calor específico es una propiedad, lo que significa que depende de la sustancia considerada y su estado según lo especificado por sus propiedades. Fuels, cuando se queman, liberan gran parte de la energía en los enlaces químicos de sus moléculas. Al cambiar de una fase a otra, a emisiones de sustancias puras o absorbe calor sin su cambio de la temperatura. La cantidad de transferencia de calor durante un cambio de fase se conoce como calor latente y depende principalmente de la sustancia y su estado.
Energía térmica
La energía térmica es un término a menudo se confunde con el de calor. Hablando sin apretar, cuando se añade calor a un sistema termodinámico sus térmicas energía aumenta y cuando el calor se retira disminuye su energía térmica. En este punto de vista, los objetos que están calientes se conocen como estar en posesión de una gran cantidad de energía térmica, mientras que los objetos fríos poseen poca energía térmica. La energía térmica a continuación, es a menudo erróneamente define como sinónimo de la palabra de calor. Esto, sin embargo, no es el caso: un objeto no puede poseer el calor, pero sólo energía. La energía térmica plazo cuando se usa en la conversación a menudo no se utiliza en un sentido estrictamente correcto, pero es más probable que se sólo se utiliza como una palabra descriptiva. En la física y la termodinámica, las palabras "calor", " energía interna "," trabajo "," entalpía "(contenido de calor)," entropía "," externos fuerzas ", etc., que se puede definir con exactitud, es decir, sin recurrir a los movimientos y vibraciones atómicas internas, tienden a preferir y utilizar más a menudo que la energía térmica plazo, que es difícil de definir.
Historia
En la historia de la ciencia , la historia de calor remonta sus orígenes a partir de la primera homínidos para hacer fuego y especulan sobre su funcionamiento y significado a día modernos físicos de partículas que estudian la naturaleza subatómica de calor. En pocas palabras, el fenómeno de calor y su definición se desarrolló de teorías mitológicas de fuego , al calor, a pinguis terra, flogisto, a aire fuego, a calórica, a la teoría del calor, a la equivalente mecánico del calor, de la termodinámica (a veces llamada energética) a la termodinámica . La historia de calor, entonces, es un precursor para la evolución y las teorías en el la historia de la termodinámica.
Notación
La cantidad total de energía que se transfiere a través de la transferencia de calor se convencionalmente abreviado como Q. La convención de signos convencional es que cuando un cuerpo libera calor en su entorno, Q <0 (-); . cuando un cuerpo absorbe el calor de su entorno, Q> 0 (+) Tasa de transferencia de calor, o flujo de calor por unidad de tiempo, se denota por:
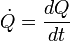 .
.
Se mide en vatios. flujo de calor se define como la tasa de transferencia de calor por unidad de área de la sección transversal, y se denota q, dando como resultado en unidades de vatios por metro cuadrado, aunque ligeramente diferentes convenciones de notación se pueden utilizar.
Entropía
En 1854, el físico alemán Rudolf Clausius definió el segundo teorema fundamental (la segunda ley de la termodinámica ) en la mecánica teoría del calor ( termodinámica ): "si dos transformaciones que, sin necesidad de ningún otro cambio permanente, pueden reemplazar mutuamente, ser llamados equivalentes, entonces las generaciones de la cantidad de calor Q de trabajo a la temperatura T, tiene la equivalence- valor: "
En 1865, llegó a definir esta relación como entropía simbolizado por S, de manera que, por un sistema cerrado, estacionario:
y por lo tanto, por reducción, cantidades de δQ de calor (una diferencial inexacta) se definen como cantidades de TdS (una diferencial exacta):
En otras palabras, la función de la entropía S facilita la cuantificación y la medición del flujo de calor a través de una límite termodinámico.
Definiciones
En términos modernos, el calor es concisa define como energía en tránsito. Físico escocés James Clerk Maxwell , en su 1871 Teoría clásica del Heat, fue uno de los primeros en enunciar una definición moderna de "calor". En resumen, Maxwell destacó cuatro estipulaciones sobre la definición de calor. Uno, es "algo que puede ser transferida de un cuerpo a otro", de acuerdo con la segunda ley de la termodinámica . Dos, se puede hablar de una "cantidad mensurable", y este tratado matemáticamente como otras cantidades mensurables. En tercer lugar, "no puede ser tratado como una sustancia"; ya que puede ser transformado en algo que no es una sustancia, por ejemplo, el trabajo mecánico . Por último, se trata de "una de las formas de energía ". Similar tales moderna, las definiciones sucintas de calor son los siguientes:
- En un sentido termodinámico, el calor nunca se considera como de ser almacenado dentro de un cuerpo. Al igual que el trabajo, que existe sólo como energía en tránsito de un cuerpo a otro; en la terminología termodinámico, entre un sistema y sus alrededores. Cuando se añade la energía en forma de calor a un sistema, que no se almacena en forma de calor sino como energía cinética y potencial de los átomos y las moléculas que componen el sistema.
- El calor sustantivo se define sólo durante el proceso de transferencia de energía por conducción o radiación.
- El calor se define como cualquier flujo espontáneo de la energía de un objeto a otro, causada por una diferencia de temperatura entre dos objetos.
- El calor puede ser definida como energía en tránsito de un objeto de alta temperatura a un objeto de temperatura más baja.
- El calor es una interacción entre dos sistemas cerrados sin intercambio de trabajo es una interacción puro calor cuando los dos sistemas, inicialmente aisladas y en un equilibrio estable, se ponen en contacto. La energía intercambiada entre los dos sistemas se llama entonces el calor.
- El calor es una forma de energía que posee una sustancia en virtud del movimiento de vibración, es decir, la energía cinética, de sus moléculas o átomos.
- El calor es la transferencia de energía entre las sustancias de diferentes temperaturas.
Termodinámica
Energía interna
El calor se relaciona con el energía interna 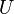 del sistema y de trabajo
del sistema y de trabajo 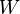 realizado por el sistema de la primera ley de la termodinámica :
realizado por el sistema de la primera ley de la termodinámica :
lo que significa que la energía del sistema puede cambiar ya sea a través del trabajo o a través de flujos de calor a través del límite de la sistema termodinámico. Con más detalle, La energía interna es la suma de todas las formas microscópicas de energía de un sistema. Está relacionada con la estructura molecular y el grado de actividad molecular y puede ser vista como la suma de las energías cinética y potencial de las moléculas; que comprende los siguientes tipos de energías:
| Tipo | Composición de Energía interna (U) |
|---|---|
| Energía Sensible | la porción de la energía interna de un sistema asociado con energías cinéticas (traducción molecular, rotación y vibración; traducción de electrones y el giro, y spin nuclear) de las moléculas. |
| La energía latente | la energía interna asociada a la fase de un sistema. |
| Energía química | la energía interna asociada con los enlaces atómicos en una molécula. |
| Energía nuclear | la enorme cantidad de energía asociada con el fuertes lazos dentro del núcleo del átomo mismo. |
| Interacciones energéticas | esos tipos de energías que no están almacenados en el sistema (por ejemplo, transferencia de calor, transferencia de masa, y trabajo), pero que son reconocidos en el frontera del sistema, ya que la cruzan, que representan ganancias o pérdidas por un sistema durante un proceso. |
| Energía térmica | la suma de las formas sensibles y latentes de energía interna. |
La transferencia de calor a un gas ideal a presión constante aumenta la energía interna y lleva a cabo trabajo de frontera (es decir, permite un volumen de control de gas a ser más grande o más pequeño), siempre que el volumen no se ve limitada. Volviendo a la primera ley de la ecuación y que separa el término trabajo en dos tipos, "trabajo en la frontera" y "otros" (por ejemplo, trabajo realizado por eje de un ventilador del compresor), se obtiene el siguiente:
Esta cantidad combinada 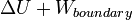 es la entalpía ,
es la entalpía , 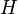 , Uno de los potenciales termodinámicos. Tanto entalpía,
, Uno de los potenciales termodinámicos. Tanto entalpía, 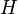 , Y la energía interna,
, Y la energía interna, 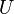 son las funciones del Estado. Las funciones del Estado vuelven a sus valores iniciales tras la finalización de cada ciclo en los procesos cíclicos tales como la de una motor térmico. En cambio, ni
son las funciones del Estado. Las funciones del Estado vuelven a sus valores iniciales tras la finalización de cada ciclo en los procesos cíclicos tales como la de una motor térmico. En cambio, ni 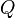 ni
ni 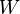 son propiedades de un sistema y no es necesario sumar cero en los pasos de un ciclo. La expresión infinitesimal de calor,
son propiedades de un sistema y no es necesario sumar cero en los pasos de un ciclo. La expresión infinitesimal de calor, 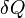 , Forma una diferencial inexacta para procesos que implican trabajo. Sin embargo, para los procesos que no implican ningún cambio en el volumen, el campo magnético aplicado, o de otros parámetros externos,
, Forma una diferencial inexacta para procesos que implican trabajo. Sin embargo, para los procesos que no implican ningún cambio en el volumen, el campo magnético aplicado, o de otros parámetros externos, 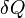 , Forma una diferencial exacta. Del mismo modo, para los procesos adiabáticos (sin transferencia de calor), la expresión para el trabajo constituye un diferencial exacta, pero para procesos que implican la transferencia de calor que forma un diferencial inexacta.
, Forma una diferencial exacta. Del mismo modo, para los procesos adiabáticos (sin transferencia de calor), la expresión para el trabajo constituye un diferencial exacta, pero para procesos que implican la transferencia de calor que forma un diferencial inexacta.
Capacidad calorífica
Para un sistema simple compresible tal como un gas ideal en el interior de un pistón, los cambios en la energía interna y la entalpía pueden estar relacionados con el capacidad calorífica a presión constante y volumen, respectivamente. obligado a tener un volumen constante, el calor, 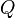 , Necesario para cambiar su temperatura desde una temperatura inicial, T 0, hasta una temperatura final, T f viene dada por:
, Necesario para cambiar su temperatura desde una temperatura inicial, T 0, hasta una temperatura final, T f viene dada por:
Extracción de la restricción de volumen y permitiendo que el sistema se expanda o contraiga a presión constante:
Para las sustancias incompresibles, como sólidos y líquidos , la distinción entre los dos tipos de capacidad de calor desaparece como se lleva a cabo ningún trabajo. Capacidad de calor es una extensa cantidad y, como tal, es dependiente del número de moléculas en el sistema. Se puede representarse como el producto de la masa, 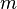 Y calor específico,
Y calor específico, 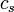 de acuerdo a:
de acuerdo a:
o es dependiente en el número de moles y la capacidad calorífica molar, 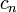 de acuerdo a:
de acuerdo a:
Las capacidades caloríficas molares y específicos dependen de los grados de libertad internos del sistema y no en propiedades externas, tales como el volumen y el número de moléculas.
Los calores específicos de los gases monoatómicos (por ejemplo, helio) son casi constante con la temperatura. Gases diatómicos como la visualización de hidrógeno alguna dependencia de la temperatura, y los gases triatómicas (por ejemplo, dióxido de carbono) aún más.
En los líquidos a temperaturas suficientemente bajas, los efectos cuánticos se vuelven significativas. Un ejemplo es el comportamiento de bosones tales como helio-4. Para tales sustancias, el comportamiento de la capacidad de calor con la temperatura es discontinua en el Punto de condensación de Bose-Einstein.
El comportamiento cuántico de los sólidos se caracteriza adecuadamente por el Modelo de Debye. A temperaturas muy por debajo de la temperatura característica de Debye de una red sólida, su calor específico será proporcional al cubo de la temperatura absoluta. Para los metales de baja temperatura, se necesita un segundo plazo para tener en cuenta el comportamiento de los electrones de conducción, un ejemplo de Estadística de Fermi-Dirac.
Los cambios de fase
El punto de ebullición del agua , por lo el nivel del mar y la presión atmosférica y temperatura normales, estarán siempre a casi 100 ° C, no importa cuánto calor se añadió. El calor adicional cambia la fase del agua de líquido en vapor de agua . El calor añadido para cambiar la fase de una sustancia de esta manera se dice que es "oculta", y por lo tanto se llama calor latente (del latín significado latere "mentir oculto"). El calor latente es el calor por unidad de masa necesaria para cambiar el estado de una sustancia dada, o:
y
Tenga en cuenta que a medida que aumenta la presión, la L se eleva ligeramente. Aquí, 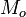 es la cantidad de masa inicialmente en la nueva fase, y M es la cantidad de masa que termina en la nueva fase. También, L generalmente no depende de la cantidad de masa que cambia de fase, por lo que la ecuación normalmente se puede escribir:
es la cantidad de masa inicialmente en la nueva fase, y M es la cantidad de masa que termina en la nueva fase. También, L generalmente no depende de la cantidad de masa que cambia de fase, por lo que la ecuación normalmente se puede escribir:
A veces, L puede ser dependiente del tiempo si la presión y el volumen están cambiando con el tiempo, de modo que la integral se puede escribir como:
Los mecanismos de transferencia de calor
El calor tiende a pasar de una región de alta temperatura a una región de baja temperatura. Esta transferencia de calor puede ocurrir por los mecanismos de conducción y radiación. En ingeniería , el término transferencia de calor convectivo se utiliza para describir los efectos combinados de conducción y el flujo de fluido y es considerado como un tercer mecanismo de transferencia de calor.
Conducción
La conducción es el principal medio de transmisión de calor en un sólido. En una escala microscópica, la conducción se produce tan caliente, que se mueve rápidamente o vibración átomos y moléculas de interactuar con los átomos vecinos y moléculas, transfiriendo parte de su energía (calor) para estos átomos vecinos. En Aisladores el flujo de calor se realiza casi en su totalidad por vibraciones fonones.
El "fluido de electrones" de una metálicas conductora conductas sólidos casi todo el flujo de calor a través del sólido. Flujo de fonones todavía está presente, pero lleva menos de 1% de la energía. Los electrones también llevan a cabo corriente eléctrica a través de sólidos conductores, y el térmica y conductividades eléctricas de la mayoría de los metales tienen aproximadamente la misma proporción. Un buen conductor eléctrico, tal como cobre , por lo general también conduce bien el calor. La Efecto Peltier-Seebeck exhibe la propensión de electrones para conducir el calor a través de un conductor eléctricamente sólido. Termoelectricidad es causada por la relación entre los electrones, los flujos de calor y corrientes eléctricas.
Convección
La convección es generalmente la forma dominante de transferencia de calor en líquidos y gases. Este es un término utilizado para caracterizar los efectos combinados de conducción y flujo de fluido. En la convección, la entalpía de transferencia se produce por el movimiento de las porciones calientes o frías del fluido junto con la transferencia de calor por conducción. Por ejemplo, cuando el agua se calienta en una estufa, agua caliente desde el fondo de la cacerola se eleva, calentar el agua en la parte superior de la cacerola. Dos tipos de convección, comúnmente se distinguen, la convección libre, en el que la gravedad y la flotabilidad fuerzas impulsan el movimiento de fluido, y la convección forzada, donde se utiliza un ventilador, agitador, o por otros medios para mover el fluido. Convección boyante es debido a los efectos de la gravedad, y por lo tanto no se produce en ambientes de microgravedad.
Radiación
La radiación es la única forma de transferencia de calor que puede ocurrir en ausencia de cualquier forma de medio; por tanto, es el único medio de transferencia de calor a través de un vacío. La radiación térmica es un resultado directo de los movimientos de los átomos y moléculas en un material. Dado que estos átomos y moléculas están compuestas de partículas cargadas ( protones y electrones ), sus movimientos resultan en la emisión de radiación electromagnética , que lleva energía lejos de la superficie. Al mismo tiempo, la superficie está constantemente bombardeado por la radiación de los alrededores, lo que resulta en la transferencia de energía a la superficie. Dado que aumenta la cantidad de radiación emitida al aumentar la temperatura, una transferencia neta de energía a partir de las temperaturas más altas a temperaturas más bajas resultados
El poder que una cuerpo negro emite en varias frecuencias es descrito por La ley de Planck. Hay una frecuencia f max en la que la potencia emitida es un máximo. Ley del desplazamiento de Wien, y el hecho de que la frecuencia de la luz es inversamente proporcional a su longitud de onda en el vacío, significan que el pico de frecuencia f max es proporcional a la temperatura absoluta T del cuerpo negro. La fotosfera del Sol, a una temperatura de aproximadamente 6000 K, emite radiación principalmente en la parte visible del espectro. La atmósfera terrestre es parcialmente transparente a la luz visible, y la luz que llega a la superficie terrestre es absorbida o reflejada. La superficie de la tierra emite la radiación absorbida, que se aproxima al comportamiento de un cuerpo negro a 300 K con el pico espectral a f max. En estas frecuencias más bajas, la atmósfera es en gran parte opaca y la radiación de la superficie de la tierra es absorbida o dispersada por la atmósfera. Aunque parte de la radiación se escapa hacia el espacio, que se absorbe y posteriormente re-emitida por gases atmosféricos. Es esta selectividad espectral de la atmósfera que es responsable de la planetaria efecto invernadero
El común de la casa bombilla tiene un espectro de la superposición de los espectros de cuerpo negro del sol y la tierra. Una porción de los fotones emitidos por un filamento de bombilla de tungsteno en 3000K están en el espectro visible. Sin embargo, la mayor parte de la energía se asocia con fotones de longitudes de onda más largas; estos no ayudar a una persona ver, pero todavía transferir calor al medio ambiente, como se puede deducir empíricamente mediante la observación de una bombilla incandescente hogar. Siempre que la radiación EM se emite y luego absorbido, el calor se transfiere. Este principio se utiliza en hornos de microondas, corte por láser, y Depilación RF.
Otros mecanismos de transferencia de calor
- Calor latente: Transferencia de calor a través de un cambio físico en el medio como el agua-hielo o agua-vapor implica energía significativa y se aprovecha de muchas maneras: la máquina de vapor , refrigerador etc. (véase calor latente de fusión)
- Las pipas de calor: El uso de calor latente y la acción capilar para mover el calor, tubos de calor pueden llevar muchas veces tanto calor como una varilla de cobre de tamaño similar. Originalmente inventado para su uso en satélites, que están empezando a tener aplicaciones en los ordenadores personales .
Disipación de calor
En climas fríos, las casas con sus sistemas de calefacción forman sistemas disipativos. A pesar de los esfuerzos para aislar a esas casas para reducir las pérdidas de calor a sus exteriores, un calor considerable se pierde, o se disipó, de ellos, que pueden hacer sus interiores incómodamente fresco o frío. Para la comodidad de sus habitantes, el interior de una casa debe mantenerse fuera del equilibrio térmico con su entorno externo. En efecto, residencias domésticas son oasis de calidez en un mar de frío y el gradiente térmico entre el interior y el exterior es a menudo bastante empinadas. Esto puede conducir a problemas tales como condensación y las corrientes de aire (corrientes de aire) que, si se deja sin tratar, pueden causar daños estructurales a la propiedad. Es por esto que se requieren técnicas de aislamiento modernos para reducir la pérdida de calor.
En una casa de este tipo, un termostato es un dispositivo capaz de poner en marcha el sistema de calefacción cuando el interior de la casa cae por debajo de una temperatura de ajuste, y de detener ese mismo sistema cuando se ha logrado establecer otra temperatura (superior). Así, el termostato controla el flujo de energía en la casa, que la energía de ser finalmente disipa al exterior.