Amina
Antecedentes
SOS ofrecen una descarga completa de esta selección de escuelas para su uso en escuelas intranets. Todos los niños disponibles para el apadrinamiento de niños de Aldeas Infantiles SOS son atendidos en una casa de familia por la caridad. Leer más ...
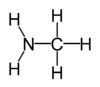
Las aminas son compuestos orgánicos y grupos funcionales que contienen una básica de nitrógeno átomo con una par solitario. Las aminas son derivados de amoniaco , en el que uno o más hidrógeno átomos se reemplazan por orgánica sustituyentes tales como alquilo y grupos arilo. Los compuestos con el átomo de nitrógeno al lado de una carbonilo de la estructura RC (= O) NR 2 se llaman amidas y tienen diferentes propiedades químicas. Aminas importantes incluyen aminoácidos , aminas biogénicas, trimetilamina (olor a pescado), y anilina; ver Categoría: Aminas para una lista de aminas.
Introducción
Aminas alifáticas
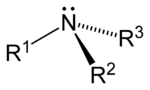
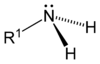
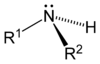
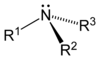
Como se muestra en las siguientes imágenes, surgen aminas primarias cuando uno de los tres átomos de hidrógeno en amoniaco se sustituye por un sustituyente orgánico. Las aminas secundarias tienen dos sustituyentes orgánicos unidos a N junto con uno H. En aminas terciarias para todos los tres átomos de hidrógeno están reemplazados por orgánica sustituyentes. También es posible tener cuatro sustituyentes alquilo en el nitrógeno. Estos compuestos tienen un centro de nitrógeno cargado, y necesariamente vienen con un contraión negativo, por lo que se llaman cuaternario sales de amonio.
| Amina primaria | Amina secundaria | Amina terciaria |
|---|---|---|
 |  |  |
Del mismo modo, un compuesto orgánico con múltiples grupos amino se llama una diamina, triamina, tetraamina y así sucesivamente.
Las aminas aromáticas
Las aminas aromáticas tienen el átomo de nitrógeno conectado a una anillo aromático como en anilinas. El anillo aromático disminuye fuertemente la basicidad de la amina, dependiendo de sus sustituyentes. Curiosamente, la presencia de un grupo amina aumenta fuertemente la reactividad del anillo aromático, debido a un efecto donador de electrones. Uno reacción orgánica que implica aminas aromáticas es la Reacción de Goldberg.
Convenciones de nombres
- el prefijo "N-" muestra la sustitución en el átomo de nitrógeno
- como prefijo: "amino"
- como sufijo: "amina"
- recuerde que los compuestos químicos no son nombres propios, caso por lo inferior está indicado en todas partes.
Los nombres sistemáticos para algunas aminas comunes:
| Aminas inferiores se nombran con el sufijo amina. | Aminas superior tienen el prefijo amino como un grupo funcional. |
- Las aminas primarias:
- metilamina
- etanolamina o 2-aminoetanol
- trisamina (o más comúnmente tris) (Su Sal de HCl se utiliza como una pH agente tampón en la bioquímica )
- Aminas secundarias:
- dimetilamina
- metiletanolamina o 2- (metilamino) etanol
- Aminas cíclicas:
- aziridina (anillo de 3 miembros),
- azetidina (anillo de 4 miembros),
- pirrolidina (anillo de 5 miembros) y
- piperidina (anillo de 6 miembros)
- Las aminas terciarias:
- trimetilamina
- metildietanolamina (MDEA)
- dimetiletanolamina (DMEA) o 2- (dimetilamino) etanol
- bis-tris (Se utiliza como un agente de tamponamiento del pH en bioquímica)
Propiedades físicas
Propiedades generales
- El enlace de hidrógeno influye significativamente en las propiedades de las aminas primarias y secundarias, así como los derivados de aminas protonadas de todos. Así, el punto de ebullición de las aminas es más alta que las de los correspondientes fosfinas, pero generalmente más bajos que los de los correspondientes alcoholes . Alcoholes, o alcanoles, se asemejan a las aminas, pero cuentan con un grupo -OH en lugar de NR 2. Puesto que el oxígeno es más electronegativo que el nitrógeno, RO- H es típicamente más ácido que el R2 compuesto N- H relacionada.
- Metil-, dimetil-, trimetil-, y etilamina son gases bajo condiciones estándar, mientras dietilamina y trietilamina son líquidos. La mayoría de los otros alquil aminas común son líquidos; alto aminas de peso molecular son, por supuesto, de sólidos.
- Aminas gaseosas poseen un olor característico amoníaco, aminas líquidos tienen un olor característico a "pescado".
- La mayoría de aminas alifáticas muestran cierta solubilidad en agua, lo que refleja su capacidad para formar enlaces de hidrógeno. Solubilidad disminuye con el aumento en el número de átomos de carbono, especialmente cuando el número de átomos de carbono es mayor que 6.
- Las aminas alifáticas muestran una solubilidad significativa en orgánicos disolventes , especialmente disolventes orgánicos polares. Las aminas primarias reaccionan con cetonas tales como acetona , y la mayoría de las aminas son incompatibles con cloroformo y tetracloruro de carbono .
- Las aminas aromáticas, tales como anilina, tienen sus solitarios par de electrones conjugado en el anillo de benceno, por lo tanto su tendencia a participar en enlaces de hidrógeno se ve disminuida. De lo contrario, se muestran las siguientes propiedades:
- Sus puntos de ebullición son por lo general sigue siendo alta debido a su mayor tamaño.
- La disminución de solubilidad en agua, aunque mantienen su solubilidad en disolventes orgánicos adecuados sólo.
- Ellos son tóxicos y son fácilmente absorbidos por la piel: así peligrosos.
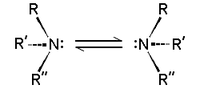
La quiralidad
Las aminas terciarias del tipo NHRR 'y NRR'R "son quiral: el átomo de nitrógeno lleva cuatro sustituyentes distintos contar el par solitario. La barrera de energía para la inversión de la estereocentro es relativamente baja, por ejemplo, ~ 7 kcal / mol para una trialquilamina. La interconversión de los estereoisómeros se ha comparado con la inversión de un paraguas abierto en un fuerte viento. Debido a esta baja barrera, aminas tales como NHRR 'no se pueden resolver de forma óptica y NRR'R "sólo pueden resolverse cuando el R, R' y R" grupos están limitados en estructuras cíclicas.
Propiedades como bases
Al igual que el amoníaco, aminas actúan como bases y son razonablemente fuerte (ver la tabla de ejemplos de ácido conjugado K unos valores). La basicidad de las aminas depende de:
- La disponibilidad del par solitario de electrones en el átomo de nitrógeno.
- Las propiedades electrónicas de los sustituyentes (grupos alquilo mejorar la basicidad, grupos arilo la disminuyen).
- El grado de solvatación de la amina protonada.
Las características del átomo de nitrógeno un par de electrones solitario que se puede unir H + para formar una ion amonio R 3 NH +. El par de electrones solitario está representado en este artículo por unos dos puntos por encima o al lado del N. El agua solubilidad de las aminas simples se debe principalmente a el enlace de hidrógeno entre los protones en las moléculas de agua y estos pares de electrones solitarios.
- Efecto inductivo de grupos alquilo
| Los iones de compuesto | K b |
|---|---|
| El amoníaco NH 3 | 1,8 · 10 -5 M |
| Metilamina CH 3 NH 2 | 4,4 · 10 -4 M |
| propilamina CH 3 CH 2 CH 2 NH 2 | 4,7 · 10 -4 M |
| 2-propilamina (CH 3) 2 2 CHNH | 5,3 · 10 -4 M |
| dimetilamina (CH 3) 2 NH | 5,4 · 10 -4 M |
- + Efecto I de grupos alquilo eleva la energía del par de electrones solitario, elevando así la basicidad.
- Efecto mesomérico de sistemas aromáticos
| Los iones de compuesto | K b |
|---|---|
| El amoníaco NH 3 | 1,8 · 10 -5 M |
| Anilina C 6 H 5 NH 2 | 3,8 · 10 -10 M |
| 4-metilfenilamina 4-CH 3 C 6 H 4 NH 2 | 1,2 · 10 -9 M |
- + M efecto de anillo aromático deslocalizan el par de electrones solitario en el ring, lo que resulta en una disminución de la basicidad.
El grado de protonación de aminas protonadas:
| Los iones de compuesto | Número máximo de H-bond |
|---|---|
| NH 4 + | 4 Muy soluble en H2O |
| RNH 3 + | 3 |
| R 2 NH 2 + | 2 |
| R 3 NH + | 1 Por lo menos soluble en H2O |
Síntesis
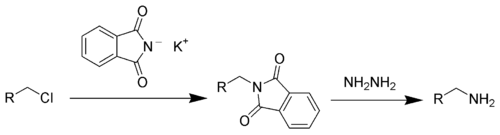
Existen los siguientes métodos de laboratorio para la preparación de aminas:
- a través de la Síntesis de Gabriel:
- vía azidas por la Reducción de Staudinger.
- De los ácidos carboxílicos en la Reacción de Schmidt.
- Aminas alílicos pueden prepararse a partir iminas en el Reacción Aza-Baylis-Hillman.
- vía Degradación de Hofmann de amidas. Esta reacción es válida sólo para la preparación de aminas primarias. Da buenos rendimientos de aminas primarias no contaminados con otras aminas.
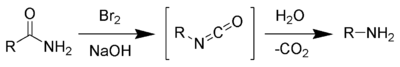
- Sales de amonio cuaternario por tratamiento con base fuerte se someten a la llamada Eliminación de Hofmann
- La reducción de nitrilos, amidas y compuestos nitro:
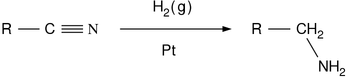
- Los nitrilos se reducen a aminas usando hidrógeno en presencia de un catalizador de níquel, aunque las condiciones ácidas o alcalinas se debe evitar para evitar la hidrólisis del grupo -CN. LiAlH 4 se emplea más comúnmente para la reducción de nitrilos a escala de laboratorio. Del mismo modo, LiAlH 4 reduce amidas a aminas:
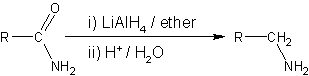
- La reducción de compuestos nitro a aminas se puede lograr con elemental de zinc , estaño o hierro con un ácido .
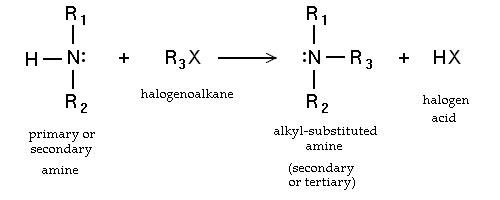
- Sustitución nucleófila de haloalcanos. Las aminas primarias también pueden ser sintetizados por alkylaton de amoniaco. Haloalcanos reaccionan con aminas para dar una amina sustituida con alquilo correspondiente, con el lanzamiento de un ácido halógeno. Tales reacciones, que son más útiles para los yoduros de alquilo y bromuros, rara vez se emplean debido a que el grado de alquilación es difícil de controlar. Si la amina terciaria es reaccionar, una cuaternario resultados de cationes de amonio en la Reacción Menshutkin. Muchos sales de amonio cuaternario se pueden preparar por esta ruta con diversos grupos R y muchos aniones haluro y pseudohaluro.
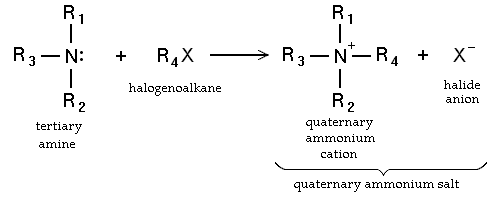
- a través de haluros y hexamina en el Reacción Delepine
- aril aminas se pueden obtener a partir de aminas y haluros de arilo en el Reacción de Buchwald-Hartwig
- a partir de alquenos y alquinos en hidroaminación
- de reordenación de haloaminas en el Reacción de Hofmann-Löffler
Reacciones
Las aminas reaccionan en una variedad de maneras:
- Por sustitución nucleofílica de acilo. Cloruros de acilo y anhídridos de ácido reaccionan con aminas primarias y secundarias en frío para formar amidas en el Reacción de Schotten-Baumann. Las aminas terciarias no pueden estar acilados debido a la ausencia de un átomo de hidrógeno reemplazable. Con la mucho menos activo cloruro de benzoilo, acilación todavía se puede realizar mediante el uso de exceso de álcali aqeous para facilitar la reacción.
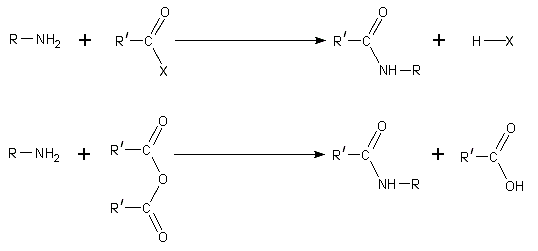
- Debido a que las aminas son básicas, se neutralizan los ácidos carboxílicos para formar las sales de carboxilato de amonio correspondientes. Tras el calentamiento a 200 ° C, las sales de aminas primarias y secundarias se deshidratan para formar el correspondiente amidas.
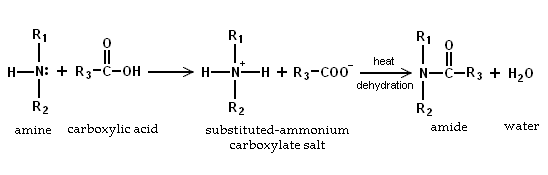
- Por formación de la sal de amonio. Las aminas R 3 N reaccionar con ácidos fuertes tales como ácido yodhídrico, ácido bromhídrico y ácido clorhídrico en reacciones de neutralización formando sales de amonio R 3 NH +.
- Por formación de la sal de diazonio. El ácido nitroso con la fórmula HNO 2 es inestable, por lo tanto, generalmente una mezcla de NaNO2 y diluir el ácido clorhídrico o el ácido sulfúrico se utiliza para producir ácido nitroso indirectamente. Aminas alifáticas primarias con ácido nitroso dan sales de diazonio muy inestables que se descomponen espontáneamente por la pérdida de N 2 para formar iones carbonio. El ion carbonio va a producir una mezcla de alquenos , alcanoles o haluros de alquilo, con alcanoles como el producto principal. Esta reacción es de poca importancia sintética porque la sal de diazonio formada es demasiado inestable, incluso en condiciones de frío.
- NaNO2 + HCl → HNO 2 + NaCl
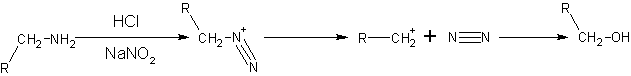
- Aminas aromáticas primarias, tales como forma anilina (fenilamina) más estable iones de diazonio a 0-5 ° C. Por encima de 5 ° C, que se descomponen para dar fenol y N 2. Sales de Arenediazonium se pueden aislar en forma cristalina, pero se utilizan generalmente en solución inmediatamente después de la preparación, debido a la descomposición rápida en pie, incluso cuando frío. La sal arenediazonium sólido es explosivo en shock o calentamiento suave. Debido a su mayor estabilidad, sales de arenediazonium son más sintéticamente útiles que sus contrapartes alliphatic. Dado que no es necesario aislar la sal de diazonio, una vez que se formó otro reactivo tal como cianuro cuproso simplemente se puede añadir a la mezcla, y con calentamiento suave de la solución, una reacción de sustitución se lleva a cabo junto con la evolución de nitrógeno. Además, arenediazonium iones también pueden someterse a una reacción de acoplamiento con un compuesto aromático altamente activado tal como un fenol para formar una compuesto azo.
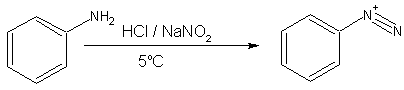
- Por formación de la imina. Las aminas primarias reaccionan con cetonas y aldehídos para formar iminas. En el caso de formaldehído (R '= H), estos productos son típicamente cíclico trímeros.
- RNH2 + R '2 C = O → R' 2 C = NR + H 2 O
- Las aminas secundarias reaccionan con cetonas y aldehídos para formar enaminas
- R 2 NH + R '(R "CH 2) C = O → R" CH = C (NR 2) R' + H 2 O
- Por oxidación para compuestos nitrosos, por ejemplo con ácido peroximonosulfúrico.
- Por reducción de cationes de amonio cuaternario a aminas terciarias en el Degradación Emde.
- Por reordenación de anilinas N-alquilo a arilo anilinas sustituidas en la Transposición de Hofmann-Martius.
- aminas primarias y secundarias reaccionan con sales de piridinio en la Reacción Zincke
- Por escisión (sólo aminas terciarias) con bromuro de cianógeno en el Reacción de Von Braun.
La actividad biológica
Las aminas tienen característicos, olores fuertes, desagradables, y son tóxicos. Los olores de amoníaco, peces de edad, orina, carne podrida, y el semen se componen principalmente de todas las aminas. Muchos tipos de actividad biológica producen aminas por la descomposición de los aminoácidos .
El uso de aminas
Tintes
Aminas aromáticas primarias se utilizan como material de partida para la fabricación de colorantes azo. Reacciona con ácido nítrico (III) para formar la sal de diazonio, que puede someterse a reacción de acoplamiento para formar compuesto azo. Como azo-compuestos son altamente coloreado, que se utilizan ampliamente en las industrias de teñido, tales como:
- Metil naranja
- Marrón directa 138
- Amarillo ocaso FCF
- Ponceau
Drogas
- La chlorpheniramine es un antihistamínico que ayuda a aliviar los trastornos alérgicos debido al frío, fiebre del heno, picazón en la piel, picaduras de insectos y picaduras.
- Clorpromazina es un tranquilizante que sedativo sin inducir el sueño. Se utiliza para aliviar la ansiedad, agitación, inquietud o incluso trastorno mental.
- La efedrina y Fenilefrina, como clorhidratos de amina, se utilizan como descongestionantes.
- La anfetamina, La metanfetamina, y Metcatinona son aminas que se indican como sustancias controladas por el DEA.
- La amitriptilina, La imipramina, Lofepramina y La clomipramina son tricíclico antidepresivos y aminas terciarias
- La nortriptilina, Desipramina, y Amoxapine son los antidepresivos tricíclicos y aminas secundarias
- (Los tricylics se agrupan por la naturaleza del grupo final de amina en la cadena lateral).
Tratamiento de Gas
- Acuoso monoetanolamina (MEA), diglicolamina (DGA), dietanolamina (DEA), diisopropanolamina (DIPA) y metildietanolamina (MDEA) son ampliamente utilizados industrialmente para la eliminación de dióxido de carbono (CO 2) y sulfuro de hidrógeno (H 2 S) de corrientes de gas natural y corrientes de proceso de la refinería. También pueden ser utilizados para eliminar el CO2 de los gases de combustión / gases de combustión y pueden tener potencial para la reducción de gases de efecto invernadero.