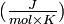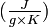Aluminium
| Aluminium | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Informations générales | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Nom, symbole, numéro | Aluminium, Al, 13 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Série chimique | métal pauvre | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Groupe, période, bloc | 13 (IIIA), 3, p | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Masse volumique | 2,6989 g·cm-3 [1] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Dureté | 1,5 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Couleur | blanc lustre métallique | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| No CAS | [2] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| No EINECS | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propriétés atomiques | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Masse atomique | 26,9815386 ± 8×10-7 u | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Rayon atomique (calc) | 125 pm (118 pm) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Rayon de covalence | 121 ± 4 pm [3] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Rayon de van der Waals | 205 pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Configuration électronique | [Ne] 3s2 3p1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Électrons par niveau d’énergie | 2, 8, 3 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| État(s) d’oxydation | +3 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Oxyde | amphotère | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Structure cristalline | cubique à faces centrées | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propriétés physiques | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| État ordinaire | solide | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Point de fusion | 660,323 °C (congélation)[4] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Point d’ébullition | 2 519 °C [1] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Énergie de fusion | 10,79 kJ·mol-1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Énergie de vaporisation | 294 kJ·mol-1 (1 atm, 2 519 °C)[1] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Volume molaire | 10,00×10-6 m3·mol-1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Pression de vapeur | 2,42×10-6 Pa | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Vitesse du son | 6 400 m·s-1 à 20 °C | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Divers | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Électronégativité (Pauling) | 1,61 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Chaleur massique | 897 J·K-1·kg-1 (solide, à 298 K)[5]
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Conductivité électrique | 37,7×106 S·m-1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Conductivité thermique | 237 W·m-1·K-1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Solubilité | sol. dans NaOH, KOH ou Na2CO3 aqueux[6], HCl (catalysée par CuCl2, HgCl2 ou une goutte de Hg), | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Énergies d’ionisation[8] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 1re : 5,985768 eV | 2e : 18,82855 eV | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 3e : 28,44765 eV | 4e : 119,992 eV | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 5e : 153,825 eV | 6e : 190,49 eV | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 7e : 241,76 eV | 8e : 284,66 eV | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 9e : 330,13 eV | 10e : 398,75 eV | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 11e : 442,00 eV | 12e : 2 085,98 eV | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 13e : 2 304,1410 eV | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Isotopes les plus stables | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Précautions | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
État pulvérulent : F Phrases R : 11, 15, 17, Phrases S : 2, 7/8, 43,
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
 B6, | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
 Danger | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Unités du SI & CNTP, sauf indication contraire. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| modifier | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
L'aluminium est un élément chimique, de symbole Al et de numéro atomique 13. C’est un métal pauvre, malléable, de couleur argent, qui est remarquable pour sa résistance à l’oxydation[13] et sa faible densité. C'est le métal le plus abondant de l'écorce terrestre et le troisième élément le plus abondant après l'oxygène et le silicium ; il représente en moyenne 8 % de la masse des matériaux de la surface solide de notre planète. L'aluminium est trop réactif pour exister à l'état natif dans le milieu naturel : on le trouve au contraire sous forme combinée dans plus de 270 minéraux différents, son minerai principal étant la bauxite, où il est présent sous forme d’oxyde hydraté dont on extrait l’alumine. Il peut aussi être extrait de la néphéline, de la leucite, de la sillimanite, de l'andalousite et de la muscovite.
L'aluminium métallique est très oxydable, mais est immédiatement passivé par une fine couche d'alumine Al2O3 imperméable de quelques micromètres d'épaisseur qui protège la masse métallique de la corrosion. On parle de protection cinétique, par opposition à une protection thermodynamique, car l’aluminium reste en tout état de cause très sensible à l'oxydation. Cette résistance à la corrosion et sa remarquable légèreté en ont fait un matériau très utilisé industriellement.
L'aluminium est un produit industriel important, sous forme pure ou alliée, notamment dans l'aéronautique, les transports et la construction. Sa nature réactive en fait également un catalyseur et un additif dans l'industrie chimique ; il est ainsi utilisé pour accroître la puissance explosive du nitrate d'ammonium.
La production mondiale de bauxite atteignait 211 millions de tonnes en 2010[14], l'Australie en assurant 33,2 % devant la Chine (19,0 %), le Brésil (15,2 %), l'Inde (8,5 %) et la Guinée (8,2 %) – la Guinée détient à elle seule plus du quart des réserves mondiales de bauxite, estimées fin 2010 à 28 milliards de tonnes. La production mondiale d'aluminium métallique s'est élevée à 41,4 millions de tonnes en 2010[15], dont la Chine a réalisé 40,6 % avec 16,8 millions de tonnes, loin devant la Russie (9,3 %) le Canada (7,1 %) et le Portugal (5,2%).
Histoire

En 1807, Humphry Davy, après avoir découvert que le sodium et le potassium entraient dans la composition de l’alun, suppose qu’il s’y trouve aussi un autre métal, qu’il baptise « aluminium » (en latin, « alun » se dit alumen). Pierre Berthier découvre dans une mine près des Baux-de-Provence en 1821 un minerai contenant de 50 à 60 % d’oxyde d’aluminium. Ce minerai sera appelé bauxite.
En 1825, le chimiste et physicien danois Hans Christian Ørsted réussit à produire une forme impure du métal. Friedrich Wöhler approfondit les travaux d'Ørsted en 1827. Il isole l’aluminium par action du potassium sur le chlorure d’aluminium, obtenant une poussière grise d’aluminium. Il est le premier à mettre en évidence les propriétés chimiques et physiques de cet élément, dont la plus notable est la légèreté.
Le chimiste français Henri Sainte-Claire Deville améliore en 1846 la méthode de Wöhler en réduisant le minerai par le sodium. En 1854, il présente à l'Académie des sciences le premier lingot d'aluminium obtenu, à l'état fondu, par voie chimique[16]. Il publie ses recherches dans un livre en 1856. Cette méthode est utilisée de façon industrielle à travers toute l’Europe pour la fabrication de l’aluminium (notamment en 1859 par Henry Merle dans son usine de Salindres, berceau de la société Pechiney), mais elle reste extrêmement coûteuse, donnant un métal dont le prix était comparable à celui de l'or (1200 et 1 500 F or/kg et l'argent 210 F/kg seulement). Le métal est alors réservé pour fabriquer des bijoux de luxe[17], puis avec la baisse des coûts, trouve des applications dans les ustensiles de cuisines et avec des alliages dans l'industrie de l'aéronautique (alliage duralumin moins cassant créé en 1909), le câblage électrique (almelec créé en 1921 et utilisé comme conducteur électrique). En 1901 naît l’Aluminium Association (AA), cartel qui réunit les entreprises des quatre seuls pays producteurs au monde (France, États-Unis, Allemagne, Royaume-Uni) et qui maintient le prix de l'aluminium stable alors que le cours des métaux concurrents subissent de plus grandes fluctuations[18]. À la fin des années 1970, la production d’aluminium se contracte et l'arrivée de nouveaux concurrents (Canada, Australie, Russie) font éclater le cartel qui ne contrôle plus son prix dont la valeur décline[19].
- 1855 : les nouveaux métaux sont exposés à l’Exposition universelle de Paris. La société Pechiney est créée en France.
- Le premier site industriel producteur d’aluminium au monde s’installe à Salindres dans le Gard, et commence son activité dès 1860.
- 1876 : William Frishmuth réalise la première coulée d’aluminium. En 1884, il réalise la coiffe du Washington Monument en ce métal.
- 1886 : de manière indépendante, Paul Héroult et Charles Martin Hall, découvrent la méthode de production de l’aluminium en remarquant qu’il est possible de dissoudre l’alumine et de décomposer le mélange par électrolyse (procédé Héroult-Hall breveté) pour donner le métal brut en fusion. Pour cette découverte, Hall obtient un brevet (400655) la même année. Ce procédé permet d’obtenir de l’aluminium de manière relativement économique. La méthode mise au point par Héroult et Hall est toujours utilisée aujourd’hui.
- 1887 : Karl Josef Bayer décrit une méthode connue sous le nom de procédé Bayer pour obtenir de l’alumine à partir de la bauxite, en la dissolvant avec de la soude. Cette découverte permet de faire entrer l’aluminium dans l’ère de la production de masse.
- 1888 : les premières sociétés de production d’aluminium sont fondées en Suisse, France et aux États-Unis.
- de 1941 à 1959, la France a frappé des pièces de monnaie de 50 c, 1 F, 2 F et 5 F en aluminium. Auparavant, pendant la première guerre mondiale et dans les années 1920, de très nombreuses monnaies de nécessité avaient déjà été frappées en France et à l'étranger.
Isotopes
L'aluminium possède 22 isotopes connus, de nombre de masse variant entre 21 et 42, ainsi que quatre isomères nucléaires. Seul 27Al est stable, ce qui fait de l'aluminium un élément monoisotopique. Si le radioisotope 26Al existe également dans la nature (demi-vie de 7,17×105 années), l'abondance de 27Al est telle qu'on considère l'aluminium comme mononucléidique et on lui attribue une masse atomique standard de 26,9815386(8) u. Tous les autres isotopes de l'aluminium ont une demi-vie inférieure à 7 minutes, et la plupart d'entre eux ont une demi-vie inférieure à une seconde.
Propriétés
Propriétés physiques
L’aluminium est un métal mou, léger, mais résistant avec un aspect argent-gris mat, dû à une mince couche d’oxydation de cinq à dix nanomètres qui se forme rapidement quand on l’expose à l’air et qui empêche la corrosion de progresser dans des conditions normales d’exposition chimiques. Ce film composé d'alumine se forme spontanément très rapidement quand l’aluminium est mis en contact avec un milieu oxydant comme l’oxygène de l’air. À la différence de la plupart des métaux, il est utilisable même s’il est oxydé en surface. On peut même dire que sans cette couche d’oxyde, il serait impropre à la plupart de ses applications. Il est possible d’augmenter artificiellement l’épaisseur de cette couche d’oxydation par anodisation, ce qui permet d’augmenter la protection et de décorer les pièces en colorant la couche d’oxyde. Contrairement à l’aluminium qui est un très bon conducteur, l’oxyde d’aluminium est un excellent isolant.
L’aluminium a une densité (2,7) environ trois fois plus faible que celle de l’acier ou du cuivre ; il est malléable, ductile et facilement usiné et moulé. C’est le deuxième métal le plus malléable et le sixième le plus ductile.
Il est paramagnétique et ne provoque pas d’étincelles.
Bombardé par un laser à électrons libres, l’aluminium devient transparent dans les ultraviolets extrêmes[20].
Propriétés chimiques
En solution, l’aluminium se trouve le plus généralement sous la forme d’ions Al3+. Il s’oxyde lentement à froid et rapidement à chaud pour former l’alumine Al2O3. L’action des acides sur l’aluminium produit l’ion cité plus haut.
La réaction de l'aluminium avec une solution aqueuse d'hydroxyde de sodium (soude) produit de l’aluminate de sodium et du dihydrogène gazeux, selon une réaction exothermique d’équation :
![\mathrm{2\, Al + 2\, (Na^+,OH^-) + 6\, H_2O \longrightarrow 2\, [Na^+,Al(OH)_4^-] + 3\, H_2}](../i/m/e628ac372c470325ecc7d44b469e5f0f.png)
Les hydroxydes d’aluminium s’obtiennent en général en précipitant une solution contenant des cations Al3+ à l’aide d’une base. Cette méthode permet de former selon les conditions de précipitation différentes phases cristallographiques tel que la bayerite, la boehmite, la gibbsite.
L’aluminium est aussi utilisé en tant que réducteur fort, notamment pour l’aluminothermie et en pyrotechnie dans les feux d'artifice, où il joue un rôle similaire au magnésium, à moindre coût et avec une puissance plus grande.
Cinétique dans l'organisme humain et élimination
L'organisme d'un sujet sain contient au total de 30 à 50 mg (ATSDR 1999), surtout présent dans l’os (+/- 50 %), le poumon (environ 25 %) et le foie (20 à 25 %). Le reste est partagé dans d'autres organes, dont le système nerveux central et la rate. Les taux tissulaires et notamment dans le poumon et le cerveau augmentent avec l’âge (ATSDR 1999).
Le traçage isotopique (isotope radioactif 26Al) d'aluminium injecté montre que 24 h après l’injection, 99 % de l’aluminium sanguin est passé dans la fraction plasmatique. Peu à peu, le taux intra-érythrocytaire augmente pour atteindre 14 %. L'aluminium se lie, dans le plasma, préférentiellement à la transferrine (80 %), et à l'albumine à hauteur de 10 %, les 10 % restants sont transportés par des protéines de bas poids moléculaire (LMW). L'Al-transferrine se dépose surtout dans la rate et le foie (riches en récepteurs-transferrine), pendant que l'Al-LMW se fixe dans l’os (qui ne contient pas de récepteurs-transferrine) [21].
L'homme élimine plus de 95 % de l'aluminium ingéré dans les fèces, et 83 % de l'aluminium qui aura passé la barrière intestinale sera éliminé par voie urinaire (avec une fonction rénale normale, la dose éliminée varie de 3 à 20 μg/ℓ d'urine[22],[23],[24],[25]. Des chélateurs (EDTA, déféroxamine...) en accélèrent l'élimination). La demi-vie dans l'organisme varie selon l'importance et la durée d’exposition et la durée de la redistribution de l’aluminium à partir des organes qui l'ont stocké. Elle peut durer plusieurs années. Elle est triphasique : en phase 1, la moitié de l'aluminium est éliminé en quelques heures, en phase deux, 50 % de ce qui reste est éliminé en quelques semaines, et il faut habituellement plus d'un an pour éliminer la moitié du reste[26].
Toxicologie



Dans certaines conditions, l’aluminium est reconnu pour ses effets neurotoxiques[27].
L'« encéphalopathie des dialysés » (ou « démence des dialysés ») observée dès 1972, a pu être attribuée en 1978 à l'aluminium contenu dans le dialysat, qui s'ajoute à un apport oral d'hydroxyde d'aluminium visant à contrôler l'hyperphosphorémie du patient[28]. Des personnes exposées à l’aluminium (à la suite d'un traitement de dialyse) peuvent développer des complications au niveau du système nerveux central, la myofasciite à macrophages[29], l’encéphalopathie, l’épilepsie et des troubles de mémoire. L’accumulation d’aluminium dans l’organisme peut aussi jouer un rôle dans d’autres maux comme le psoriasis, les insuffisances hépatorénales chroniques, l’anémie, l’ostéomalacie (os cassants ou mous), l’intolérance au glucose et les arrêts cardiaques chez les humains. Les cellules du cerveau des patients atteints d’Alzheimer contiennent de 10 à 30 fois plus d’aluminium que la normale[30]. La réglementation européenne impose maintenant aux centres de dialyse de mieux contrôler l'exposition des dialysés à l'aluminium, ce qui s'est traduit par une diminution de leurs taux sériques moyens, avec une diminution de 61,8 ± 47,5 μg/ℓ en 1988 à 25,78 ± 22,2 μg/ℓ en 1996[28].
Parmi les sources d'exposition figurent les aliments, l’eau, les cosmétiques (en particulier les déodorants / antitranspirants sous forme de sels d'aluminium), les médicaments anti-acides. Les ustensiles de cuisine et le papier d’aluminium peuvent également en libérer (en quantité généralement négligeable) dans les aliments. C'est pourquoi son utilisation dans la fabrication de conduites d’eau est prohibée dans plusieurs pays. Cependant, le sulfate d'aluminium est utilisé dans le traitement des eaux.
Des cas particuliers sont certains adjuvants de vaccins, et l’eau pour la dilution des concentrés pour hémodialyse, lorsqu’elle provient d’une station de production inefficace, ainsi que les poches de nutrition parentérale. Dans ces derniers cas, l'aluminium est directement injecté dans le système sanguin ou dans le muscle (autrefois la vaccination pouvait être sous-cutanée, mais elle est devenue intramusculaire)[31].
En France, la campagne massive de vaccination à la suite de la Grippe A (H1N1) de 2009-2010 a relancé la polémique sur les risques de santé liés à cet élément car 47 % des vaccins commercialisés contiennent comme adjuvant de l'aluminium[32].
Et en 2012, on évoque à nouveau, sur la base d'un suivi plus large (statistiquement plus significatif) le lien entre aluminium et Myofasciite à macrophages[33].
Une étude parue en janvier 2012 dans la revue scientifique : Journal of Applied Toxicology publiant des articles de recherches originales concernant la toxicologie montre in vitro les effets néfastes des sels d’aluminium (chlorhydrate d’aluminium et chlorure d'aluminium) sur les cellules épithéliales mammaires humaines[34]. Tout cela avec des doses 1500 à 100000 fois inférieures à celles que l’on retrouve dans les déodorants contenant des sels d'aluminium du commerce.
État des connaissances
En France
- Le Groupe Nerf-Muscle du Département de Pathologie de Hôpital Henri Mondor de Créteil, et le Groupe d’études et de recherche sur les maladies musculaires acquises et dysimmunitaires (GERMMAD) de l’Association française contre les myopathies décèlent un syndrome qu'ils appellent myofasciite à macrophages (MFM), qui sera histologiquement défini en 1998 puis médicalement définie en 2003[33].
- décembre 2000, la Direction générale de la santé (DGS, ministère de la santé) saisit les agences de sécurité sanitaire (AFSSAPS/AFSSA/INVS) à propos des risques de l’aluminium pour la population (notamment concernant la maladie d'Alzheimer).
- Fin 2000 l’Agence française de sécurité sanitaire des produits de santé (Afssaps) décide de faire un point sur l'aluminium dans les produits de santé (voir rendu du rapport en 2003)
- En 2001, des indices forts penchent en faveur d'une hypothèse associant l'aluminium contenu dans les vaccins à la myofasciite à macrophages car il est retrouvé dans des biopsies musculaires[35].
- 2003 dans le rapport « Évaluation des risques sanitaires liés à l’exposition de la population française à l’aluminium » (AFSSAPS/AFSSA/INVS 2003), l'agence conclut qu'on manque encore de données pertinentes quant à l’absorption cutanée de l’aluminium contenu dans les produits cosmétiques. L'Afssaps décide de s'auto-saisir du sujet. L'INVS concluait à un manque de données suffisantes pour confirmer ou infirmer les conséquences de l’aluminium sur la santé. Par exemple, la qualité des eaux de boisson est très suivie, mais non les effets des emballages en aluminium[36].
- 2004, une étude de Darbre et al. (2003) évoque un risque de cancérogénicité pour le sein chez les femmes utilisant des antitranspirants à base d’aluminium. La DGS interroge l'Afssaps à ce sujet.
- Octobre 2011, l'Afssaps, via un rapport[37] sur l' "Évaluation du risque lié à l'utilisation de l'aluminium dans les produits cosmétiques" demande aux fabricants de déodorants et d'antiperspirants de diminuer la teneur de ces produits en composés d'aluminium (l'industrie des cosmétiques est susceptible d'utiliser au moins 25 composés de l’aluminium, dont principalement le chlorohydrate d'aluminium comme antitranspirant. L'aluminium provoque une rétraction des pores et a une action bactéricide) ou de le remplacer par des alternatives ; Selon l'Afssaps, 18 % des sels d’aluminium d'un déodorant traversent la peau blessée ou irritée (après rasage ou épilation par exemple). L'Agence demande qu'un avertissement figure sur les boites, et demande aux fabricants de ne pas dépasser 0,6 % du produit alors que certains déodorants contiennent jusqu'à plus de 20 % d'aluminium. En 2012, aucune de ces recommandations n'avait été suivie par les grands industriels de la cosmétique. L'Afssaps a intégré pour former son nouvel avis la « récente étude d’absorption cutanée fournie par les industriels du secteur cosmétique, donnée manquante dans le rapport de 2003 », et « une synthèse des données toxicologiques, en partie basée sur le récent avis émis par l'Autorité européenne de sécurité des aliments » (EFSA)[38],[39].
- En janvier 2012, France 5 diffuse un documentaire, l'"Aluminium, notre poison quotidien", qui fait le point sur l'exposition des populations aux sels d'aluminium solubles. À cette occasion, une association de médecins, l'Association Santé Environnement France, alerte sur l'importance de sensibiliser sur la toxicité de ce métal[40].
- Le 12 mars 2012, TF1 diffuse lors du 20 h un reportage[41] qui indique que les docteurs Olivier GUILLARD et le Professeur Alain PINEAU ont prouvé que les sels d'aluminium (chlorhydrate d’aluminium et chlorure d'aluminium) contenus dans les déodorants et antitranspirants passent dans le sang et ce d'autant plus facilement quand la peau est lésée, épilée ou rasée. Cette découverte a fait l'objet de plusieurs publication dans des revues scientifiques : Toxicology Mechanisms and Methods[42] & dans Journal of Inorganic Biochemistry[43] Selon ce même reportage, les industriels du cosmétique quant à eux considèrent qu'il n'y a aucune raison de remettre en cause leurs pratiques.
- En mars 2013, la chaîne Arte a consacré une soirée Thema à la toxicité de l'aluminium[44] : effet des excipients dus à l'aluminium ; industrie des produits dérivés ; présence dans l'eau du réseau de ville ; effet sur les maladies du cerveau. Le film documentaire Planet Alu de Bert Ehgartner (de) est diffusé.
Alimentation
L'aluminium est utilisé comme colorant alimentaire, son numéro SIN est E173[45],[46].
30 % des Chinois consomment trop d'aluminium et dépassent la ration hebdomadaire tolérable provisoire (PTWI)[47]. Dans le nord de la Chine, les habitants consomment environ de 5,1 mg d'aluminium par kilogramme de poids du corps, soit 2,6 fois plus que le volume recommandé par l'Organisation mondiale de la santé.
Il s'agit d'un usage dispersif de l'aluminium.
Prix au kilogramme
Au , la tonne d'aluminium de première fusion s'échangeait à 3 500 USD, soit 2 530 EUR, d'où un prix au kilogramme de 2,53 €.
Alliages remarquables et utilisations
En tonnage et en valeur, l’aluminium est le métal le plus utilisé après le fer, grâce à sa légèreté et sa bonne conductivité électrique et thermique. L’aluminium pur est mou et fragile, mais avec des petites quantités de cuivre, magnésium, manganèse, silicium et d’autres éléments, il peut former des alliages aux propriétés variées.
Parmi les secteurs utilisant l’aluminium, on peut citer :
- les transports (automobiles, avions, camions, trains, bateaux, vélos etc.) ;
- l’emballage (boîtes de conserve, papier aluminium, canettes, barquettes, aérosols, etc.) et notamment les emballages alimentaires ;
- la construction (fenêtres, portes, gouttières, etc.) ;
- les biens de consommation (appareils, ustensiles de cuisine, miroirs etc.) ;
- les fils électriques (la conductivité de l’aluminium ne représente que 60 % de celle du cuivre, mais l’aluminium est plus léger et moins cher) ;
- de l’aluminium très pur (99,980 à 99,999 %) est employé en électronique, en astronomie (miroirs des télescopes comme ceux du VLT de l'ESO au Chili) et pour les CD.
- de l'alliage de l'aluminium soumis à une torsion sous haute pression (6 GPa - équivalent d'une pression d'une masse de plus de 60 tonnes par centimètre carré) puis à un vieillissement, est doté d'une « nanostructure hiérarchique » et de performances atteignant celles des meilleurs aciers. Il est employé en aéronautique ou astronautique[48].
- En peinture, certains artistes tels que le peintre laqueur Frédéric Halbreich utilisent des panneaux d'aluminium comme support de leurs œuvres.
- En pyrotechnie, l'aluminium est utilisé pour colorer les feux d'artifices et à faire des fumigènes.
Outil de datation
- En géomorphologie et paléosismologie, l’isotope 26Al, créé par les rayons cosmiques, est utilisé pour la datation par isotopes cosmogéniques de surfaces ou la détermination de taux d’érosion.
- Le système solaire provient d'une nébuleuse où le 26Al était autrefois réparti de manière homogène (à ± 10 % ; ceci est démontré par l'analyse des chondres des météorites les plus anciennes). Il se désintègre en magnésium avec une demi-vie de 0,73 million d'années, ce qui constitue un étalon pour évaluer la date de formation des premiers solides du système solaire[49]. Ceci pourra aider à mieux connaître le calendrier de la formation des premiers solides du système solaire.[réf. nécessaire]
Gisements
L’aluminium est un élément abondant dans la croûte terrestre mais il se trouve rarement sous sa forme pure[50]. C’est le troisième élément le plus abondant dans la croûte terrestre (8 % de la masse) après l’oxygène et le silicium. L’aluminium est très difficile à extraire des roches qui le contiennent et a donc été rare et précieux avant sa production en masse.
Le principal minerai d’aluminium est la bauxite.
Production
La première étape constitue à extraire l'alumine (Al2O3) d'un minerai (habituellement la bauxite) selon le procédé Bayer ou le procédé Orbite. Dans le cas du procédé Bayer, la bauxite est traitée par une solution de soude.
On obtient un précipité de Al(OH)3 qui donne de l’alumine par chauffage. L’aluminium est extrait par électrolyse : l’alumine est introduite dans des cuves d’électrolyse avec des additifs comme la cryolithe (Na3AlF6), le fluorure de calcium (CaF2), le fluorure de lithium et d’aluminium (Li3AlF6) et le fluorure d’aluminium (AlF3) afin d’abaisser le point de fusion de 2 040 °C à 960 °C.
La production d’une tonne d’aluminium nécessite de quatre à cinq tonnes de bauxite. Elle nécessite entre 13 000 et 17 000 kWh (entre 47 et 61 GJ). Lors de l’électrolyse, sont émis des gaz tels que du dioxyde de carbone, (CO2), du monoxyde de carbone (CO), des hydrocarbures aromatiques polycycliques (HAP), et des fluorures gazeux. Dans les meilleures usines, le monoxyde de carbone (CO) et les hydrocarbures aromatiques polycycliques (HAP) sont brûlés ou recyclés comme source de carbone, et les fluorures sont retournés dans le bain d’électrolyse.
Statistiques de production[51]
La production mondiale d’aluminium secondaire à partir du recyclage s’est élevée à 7,6 Mt en 2005, soit 20 % de la production totale de ce métal.
| Année | Afrique | Amérique du Nord |
Amérique latine |
Asie | Europe et Russie |
Océanie | Total |
|---|---|---|---|---|---|---|---|
| 1973 | 249 | 5 039 | 229 | 1 439 | 2 757 | 324 | 10 037 |
| 1978 | 336 | 5 409 | 413 | 1 126 | 3 730 | 414 | 11 428 |
| 1982 | 501 | 4 343 | 795 | 1 103 | 3 306 | 548 | 10 496 |
| 1987 | 572 | 4 889 | 1 486 | 927 | 3 462 | 1 273 | 12 604 |
| 1992 | 617 | 6 016 | 1 949 | 1 379 | 3 319 | 1 483 | 14 763 |
| 1997 | 1 106 | 5 930 | 2 116 | 1 910 | 6 613 | 1 804 | 19 479 |
| 2003 | 1 428 | 5 945 | 2 275 | 2 457 | 8 064 | 2 198 | 21 935 |
| 2004 | 1 711 | 5 110 | 2 356 | 2 735 | 8 433 | 2 246 | 22 591 |
Recyclage
L’aluminium a une excellente recyclabilité théorique, mais il faut le collecter, le trier et le faire fondre, ce qui nécessite une quantité importante d’énergie, cependant, en plus des bénéfices environnementaux, le recyclage de l’aluminium est beaucoup moins coûteux que l’extraction à partir du minerai de bauxite. Il nécessite 95 % d’énergie en moins et une tonne d’aluminium recyclé permet d’économiser quatre tonnes de bauxite. En sautant l’étape de l’électrolyse, qui réclame beaucoup d’énergie, on évite les rejets polluants qui lui sont associés.
L’aluminium est quasiment recyclable à l’infini sans perdre ses qualités, à condition de ne pas fondre dans un même bain des alliages de composition différente. Pour cette raison les producteurs refusent une partie significative de l’aluminium récupéré dans les déchets ménagers. De plus, les différentes familles d’alliages d’aluminium aux propriétés diverses sont soumises à différents types de corrosion : corrosion par piqures, corrosion filiforme, corrosion feuilletante, corrosion galvanique, corrosion sous contrainte, corrosion sous dépôt dont l'industriel se prémunit en réalisant des traitements de surface, du thermolaquage[52].
Il y a donc une certaine spécialisation des alliages en fonction des domaines d’application
Le recyclage de l’aluminium a commencé à être pratiqué dans les années 1900 et a régulièrement progressé : dans la consommation d’aluminium en Europe, la part d’origine recyclage est passée de 50 % en 1980 à plus de 70 % en 2000. Il existe différentes filières industrielles de récupération de l’aluminium.
Après la Seconde Guerre mondiale la pénurie a conduit à refondre des alliages d’aluminium pour en faire des pièces n’exigeant pas de caractéristiques mécaniques précises, et en particulier des ustensiles de cuisine. La composition des alliages obtenus n’était pas appréciée des fondeurs qui les qualifiaient de « cochonium ». Les casseroles ainsi réalisées se piquaient (corrosion par piqûre), sous l’effet de l’acidité des aliments. Les conséquences d’une alimentation polluée ont déjà été évoquées.
Recyclage en France
En France, l’aluminium des décharges des déchets industriels et assimilés est récupéré et broyé puis refondu par des affineurs d’aluminium pour produire l’aluminium de seconde fusion. Ce dernier est essentiellement utilisé pour fabriquer des pièces de fonderie pour l’automobile (blocs moteur, culasses, pistons, etc.). L’aluminium « ménager » est récupéré avec les emballages dans le cadre du tri sélectif. Dans les centres de tri (en France et dans le monde), l’aluminium est trié manuellement ou plus couramment grâce à des machines de tri par courants de Foucault inventées en 1984 par le thermodynamicien Hubert Juillet[53],[54],[55].
En 2009, en France, 32 % des emballages en aluminium ont été recyclés. Les petites canettes métalliques, les canettes écrasées, les feuilles d’aluminium froissées, les capsules de café, etc. sont rejetées par le processus de tri du fait de leur taille, de même que le papier aluminium et divers composés contenant de l’aluminium (environ 50 000 t/an, rien que pour la France).
Afin d'améliorer le recyclage de ces emballages en aluminium, des industriels ont créé le Club de l’emballage léger en aluminium et en acier (CELAA)[56]. Le CELAA a réalisé des expérimentations dans 4 départements (Hauts-de-Seine, Var, Alpes-Maritimes et Lot) qui ont démontré qu'il était tout à fait possible de recycler des produits tels que les capsules de machines à café, les feuilles d’aluminium, les bouchons et couvercles, etc. Les résultats obtenus montrent qu'on peut ainsi aller jusqu'à doubler les taux de recyclage de l'aluminium et augmenter le recyclage de l'acier de 10%.
À la suite de ces expérimentations a été créé, en partenariat avec Eco-Emballages et l'Association des Maires de France, le Projet Métal qui vise à améliorer le recyclage des emballages métalliques en fournissant des outils techniques et financiers aux centres de tri[57]. L'entreprise Nespresso accompagne ce Projet avec la création du Fonds de Dotation pour le recyclage des petits emballages métalliques qui apporte des soutiens financiers complémentaires pour recycler ces petits emballages. Plus de 500 collectivités et 3 millions d'habitants participent d'ores et déjà à ce Projet et peuvent ainsi recycler l'ensemble de leurs emballages métalliques.
Autres pays
Dans certains pays en voie de développement[Lesquels ?], le recyclage non contrôlé de matières à base d’aluminium conduit encore de nos jours à réaliser des ustensiles alimentaires avec des teneurs en éléments nocifs (nickel, cuivre, etc.). Néanmoins, le recyclage des alliages d’aluminium, effectué sérieusement, avec un contrôle précis de la composition, donne d’excellents résultats.
Les cinq premiers producteurs mondiaux
Dans la liste de producteurs d’aluminium dans le monde, les cinq principaux sont en 2006[58] :
- Rio Tinto Alcan
- Rusal
- Alcoa
- Hydro Al
- Chalco
Pollutions dues au processus de production
Trois types de pollutions directes sont engendrées par la production de l’aluminium[59] :
- une pollution par les rejets de production d'alumine à partir de la bauxite, dites boues rouges stockées dans des aires protégées par des digues; ces boues sont caustiques (soude) et contiennent divers métaux ;
- une pollution fluorée lors de la transformation de l’alumine en aluminium ;
- des rejets gazeux au-dessus des cuves d’électrolyse, qui doivent être captés.
La production d'aluminium aussi nécessite de grande quantité d’électricité (2 fois plus que pour la production d'acier), produite souvent par des centrales polluantes. En Islande cette énergie est produite par la géothermie, mais le minerai doit être transporté car l'Islande ne possède pas de gisement de bauxite.
Incidents graves liés à l'industrie de l'aluminium
Le , un réservoir de l’usine de production de bauxite-aluminium, Ajkai Timfoldgyar Zrt, située à Ajka, à 160 kilomètres de Budapest, s’est rompu déversant entre 600 000 et 700 000 m3 de boue rouge toxique composée d’éléments nocifs et très corrosifs qui ont inondé trois villages dans un rayon de 40 km2 avant d’atteindre le Danube menaçant l’écosystème du grand fleuve avec un taux alcalin légèrement au-dessus de la normale[60],[61],[62].
Le bilan des pertes humaines s’élève à 9 morts et plus de 150 blessés, l’écosystème à proximité de l’usine a été entièrement détruit, la marée rouge a emporté avec elle le bétail et les animaux de fermes, des milliers de poissons ont péri. Le gouvernement hongrois a décrété l’état d’urgence[63]. La région demeure sous le risque d’une deuxième inondation semblable après que plusieurs fissures ont été remarquées sur le réservoir nord menaçant de déverser 500 000 mètres cubes de boue rouge de plus[64],[65].
Notes et références
- 1 2 3 (en) David R. Lide, CRC Handbook of Chemistry and Physics, CRC Press Inc, , 90e éd., Relié, 2804 p. (ISBN 978-1-420-09084-0)
- ↑ Base de données Chemical Abstracts interrogée via SciFinder Web le 15 décembre 2009 (résultats de la recherche)
- ↑ (en) Beatriz Cordero, Verónica Gómez, Ana E. Platero-Prats, Marc Revés, Jorge Echeverría, Eduard Cremades, Flavia Barragán et Santiago Alvarez, « Covalent radii revisited », Dalton Transactions, , p. 2832 - 2838 (DOI 10.1039/b801115j)
- ↑ Procès-verbaux du Comité international des poids et mesures, 78e session, 1989, pp. T1-T21 (et pp. T23-T42, version anglaise).
- 1 2 3 (en) « Aluminum » sur NIST/WebBook, consulté le 28 juin 2010
- ↑ (en) Metals handbook, vol. 10 : Materials characterization, ASM International, , 1310 p. (ISBN 0-87170-007-7), p. 346
- ↑ (en) Thomas R. Dulski, A manual for the chemical analysis of metals, vol. 25, ASTM International, , 251 p. (ISBN 0803120664, lire en ligne), p. 71
- ↑ (en) David R. Lide, CRC Handbook of Chemistry and Physics, TF-CRC, , 87e éd. (ISBN 0849304873), p. 10-202
- ↑ « ESIS » (consulté le 1er février 2009)
- ↑ « Aluminium (poudre) » dans la base de données de produits chimiques Reptox de la CSST (organisme québécois responsable de la sécurité et de la santé au travail), consulté le 25 avril 2009
- ↑ Numéro index dans le tableau 3.1 de l'annexe VI du règlement CE N° 1272/2008 (16 décembre 2008)
- ↑ SIGMA-ALDRICH
- ↑ En fait il est rapidement couvert d'une mince couche d'oxyde d'aluminium Cf.#Propriétés physiques qui le protège.
- ↑ (en) USGS Minerals – 2011 « Bauxite. »
- ↑ (en) USGS Minerals – 2011 « Aluminum. »
- ↑ Georges Chaudron in « La préparation industrielle de l'aluminium et la découverte de ses propriétés par un illustre savant français, Henry Sainte-Claire Deville », Revue de l'aluminium no 211, juin 1954, page 97, publié par l'Institut d'histoire de l'aluminium
- ↑ Histoire de l’aluminium
- ↑ Ivan Grinberg, Cent ans d'innovation dans l'industrie de l'aluminium, Éditions L'Harmattan, 1997 (lire en ligne), p. 157-158
- ↑ Martin Brown, Bruce McKern, L'aluminium, le cuivre et l'acier dans les pays en développement, OECD Publishing, 1987, p. 27-28
- ↑ (en) B. Nagler et al., « Turning solid aluminium transparent by intense soft X-ray photoionization », Nat. Phys., vol. 5, no 9, , p. 693-696 (ISSN 1745-2473, DOI 10.1038/nphys1341)
- ↑ (en) J.-P. Day et al., « Biological chemistry of aluminium studied using 26Al and accelerator mass spectrometry », Nucl. Instrum. Methods Phys. Res., Sect. B, vol. 92, no 1-4, , p. 463-468 (DOI 10.1016/0168-583X(94)96055-0)
- ↑ (en) W. D. Kaehny, A. P. Hegg et A. C. Alfrey, « Gastrointestinal Absorption of Aluminum from Aluminum-Containing Antacids », N. Engl. J. Med., vol. 296, no 24, , p. 1389-1390 (ISSN 0028-4793, DOI 10.1056/NEJM197706162962407)
- ↑ (en) S. Valkonen et A. Aitio, « Analysis of aluminium in serum and urine for the biomonitoring of occupational exposure », Sci. Total Environ., vol. 199, no 1-2, , p. 103-110 (ISSN 0048-9697, DOI 10.1016/S0048-9697(97)05485-5)
- ↑ Aitio A, Riihimäki V, Valkonen S. Aluminium. In Biological monitoring of chemical exposure in the wor place, WHO, Genève 1996; 2:1-17
- ↑ Lauwerys R.R, Hoet P. Industrial chemical exposure: Guidelines for biological monitoring. Lewis publishers. 3 rd Ed 2001; 638p.
- ↑ Bismuth C. Toxicologie clinique. Médecine-Sciences. Ed. Flammarion, 2000; 1092p.
- ↑ Effets éventuels de l'aluminium sur la santé
- 1 2 Neuro toxicité de l'aluminium
- ↑ Michelle Coquet (2008), Dossier : Myofasciite à Macrophages ; Mise en évidence d’une nouvelle entité ; Kinésithérapie, la Revue ; Volume 8, Issue 79, juillet 2008, Pages 16–21 ()
- ↑ (en) C. R. Harrington, C. M. Wischik, F. K. McArthur, G. A. Taylor, J. A. Edwardson et J. M. Candy, « Alzheimer's-disease-like changes in tau protein processing: association with aluminium accumulation in brains of renal dialysis patients », Lancet, vol. 343, no 8904, , p. 993-997 (ISSN 0140-6736, DOI 10.1016/S0140-6736(94)90124-4)
- ↑ Évaluation des risques sanitaires liés à l’exposition de la population française à l’aluminium : eaux, aliments, produits de santé (AFFSSA, 2003)
- ↑ Virginie Belle, Quand l'aluminium nous empoisonne - Enquête sur un scandale sanitaire, Éd. Max Milo, 2010
- 1 2 Gherardi R. K, Myofasciite à macrophages et hydroxyde d'aluminium : vers la définition d'un syndrome des adjuvants = Lessons from macrophagic myofascitiis: towards definition of a vaccine adjuvant-related syndrome ; Revue neurologique ; ISSN:0035-3787 ; 2003, vol. 159, no2, p. 162-164 ; 3pp ; (résumé Inist-CNRS)
- ↑ The Globalist Report Sappino AP, Buser R, Lesne L, Gimelli S, Béna F, Belin D, Mandriota SJ. (Division of Oncology, Faculty of Medicine, University of Geneva, Geneva, Switzerland.) Aluminium chloride promotes anchorage-independent growth in human mammary epithelial cells, in Journal of applied toxicology 2012 Jan 6. doi: 10.1002/jat.1793
- ↑ F.-J. Authier, P. Cherin, A. Creange, B. Bonnotte, X. Ferrer, A. Abdelmoumni, D. Ranoux, J. Pelletier, D. Figarella-Branger, B. Granel, T. Maisonobe, M. Coquet, J.-D. Degos et R. K. Gherardi (2001), Central nervous system disease in patients with macrophagic myofasciitis ; Oxford Journals ; Medicine ; Volume 124 Issue 5 ; p. 974-983 ; Online ISSN:1460-2156 - Print ISSN:0006-8950 (Résumé)
- ↑ Claire Gourier-Fréry, Nadine Fréry, Claudine Berr, Sylvaine Cordier, Robert Garnier, Hubert Isnard, Coralie Ravault, Claude Renaudeau IVS, 2003, Aluminium - Quels risques pour la santé ?, INVS PDF, 184 pages
- ↑ Rapport d'expertise : Évaluation du risque lié à l’utilisation de l’aluminium dans les produits cosmétiques, Oct 2012, 44 pages, PDF
- ↑ European Food Safety Agency (EFSA) (2008). Safety of aluminium from dietary intake-Scientific Opinion of the Panel on Food Additives, Flavourings, Processing Aids and Food Contact Materials(AFC). The EFSA Journal 2008, 754 : 1-34.
- ↑ European Food Safety Agency (EFSA ) (2008). Annex of the opinion on Safety of aluminium from dietary intake-Scientific Opinion of the Panel on Food Additives, Flavourings, Processing Aids and Food Contact Materials (AFC). Annex to the EFSA Journal (2008) 754, 1-34 opinion ”Safety of aluminium from dietary intake”.
- ↑ « Aluminium, notre poison quotidien », sur France 5, (consulté le 24 janvier 2015)
- ↑ « Attention à l'alu dans les déodorants »
- ↑ An analytical procedure for the determination of aluminum used in antiperspirants on human skin in Franz™ diffusion cell; Toxicol Mech Methods. 2012 Apr;22(3):205-10. doi: 10.3109/15376516.2011.610386. Guillard O, Fauconneau B, Favreau F, Marrauld A, Pineau A.(CHU Poitiers, Laboratoire de Biochimie, Poitiers, France)
- ↑ In vitro study of percutaneous absorption of aluminum from antiperspirants through human skin in the Franz™ diffusion cell. J Inorg Biochem. Volume 110, May 2012, Pages 21–26. Pineau A, Guillard O, Favreau F, Marrauld A, Fauconneau B. (Université Nantes, Faculté de Pharmacie, Laboratoire de Toxicologie 44035 Nantes, France)
- ↑ L'aluminium au quotidien
- ↑ Codex alimentarius, « Noms de catégories et systèmes international de numérotation des additifs alimentaires », sur codexalimentarius.net, 2009 (consulté le 19 mai 2010)
- ↑ Le E173 (Aluminium) est autorisé en France sous conditions., sur le site les-additifs-alimentaires.com
- ↑ Un tiers des Chinois consomment trop d'aluminium, selon un rapport, sur le site french.peopledaily.com.cn du 29 septembre 2012
- ↑ (en) P. V. Liddicoat, X.-Z. Liao, Y. Zhao, Y. Zhu, M. Y. Murashkin, E. J. Lavernia, R. Z. Valiev et S. P. Ringer, « Nanostructural hierarchy increases the strength of aluminium alloys », Nat. Commun., vol. 1, (DOI 10.1038/ncomms1062)
- ↑ (en) J. Villeneuve, M. Chaussidon et G. Libourel, « Homogeneous Distribution of 26Al in the Solar System from the Mg Isotopic Composition of Chondrules », Science, vol. 325, no 5943, , p. 985-988 (ISSN 0036-8075, DOI 10.1126/science.1173907)
- ↑ Photo d’un fragment naturel de roche contenant de l’aluminium
- ↑ (en) International Aluminium Institute.
- ↑ Les formes de corrosion de l'aluminium
- ↑ Séparateur à répulsion magnétique, sur le site espacenet.com, consulté le 21 janvier 2015
- ↑ Système de séparation des métaux non ferreux., sur le site espacenet.com, consulté le 21 janvier 2015
- ↑ Séparateur pour un mélange de particules ayant des caractéristiques différentes, sur le site espacenet.com, consulté le 27 janvier 2015
- ↑ www.celaa.fr
- ↑ http://www.actu-environnement.com/ae/news/nespresso-projet-metal-capsule-aluminium-dechets-23664.php4#video&xtor=EREC-107
- ↑ M. Prandi, « Rusal devient un actionnaire de référence de Norilsk Nickel », Les Échos, no 20074, , p. 26 (ISSN 0153-4831, lire en ligne).
- ↑ [PDF]+(en) The Bauxite Mining and Alumina Refining Process, sur le site emt-india.net
- ↑ « Hongrie. Controverse autour des boues toxiques », La Dépêche du Midi, (lire en ligne).
- ↑ HONGRIE : 1,1 million de mètres cubes de boue dans le Danube, afriqueactu.net, publié le 7 octobre 2010.
- ↑ Boues rouges en Hongrie : une catastrophe européenne majeure et prévisible, CDURABLE.info, publié le 7 octobre 2010.
- ↑ Hongrie/boues : 9 morts (nouveau bilan), LeFigaro.fr, publié le 13 octobre 2010.
- ↑ La Hongrie s’attend à une nouvelle inondation de boue rouge toxique, Libération, publié le 9 octobre 2010.
- ↑ Hongrie : une 2e marée rouge « probable », RTLinfo.be, publié le 9 octobre 2010.
Voir aussi
Articles connexes
- Institut pour l’histoire de l’aluminium
- Liste de producteurs d’aluminium
Métallurgie extractive de l’aluminium
- Alumine
- Bauxite
- Extraction de l’alumine
- Production de l’aluminium par électrolyse
Alliage d’aluminium
- Alliages d'aluminium pour corroyage
- Alliages d'aluminium pour fonderie
- Partinium
- Duralumin
- Al-SiC
- Cuproaluminium
- Alliage de Devarda
- Alnico
- Avional
- Zamak
- Alpax
Transformation de l’aluminium
- Fonderie d’aluminium
- Fabrication des feuilles et bandes d’aluminium
- Fabrication de semi-produits en alliage d’aluminium : tôles, profilés et pièces de fonderie.
- Satinage de l'aluminium, par microbillage avec des microbilles de verre.
Liens externes
- Informations de marché, sur le site de la Conférence ds Nations unies pour le commerce et le développement
- Alu-Scout - La plateforme interactive d`information et d’échange du domaine de l`aluminium
- Espace Alu - Musée de l'épopée de l'aluminium dans les Alpes
- Micrographies comparant la surface brillante et la surface mate du papier aluminium
- aluMATTER - un site web librement accessible qui vise à fournir des outils de formation en ligne innovants et interactifs relatifs à la science et aux technologies de l’aluminium
- Site de l’Institut pour l’histoire de l’aluminium (IHA).
- Iconothèque de l'aluminium de l'IHA.
- un dossier pluridisciplinaire sur l’aluminium
- Caractérisation de l’aluminium par Henri Sainte-Claire Deville (1854), article analysé sur le site BibNum.
- Le brevet Héroult d’électrolyse de l’aluminium (1886) en ligne et analysé sur le site BibNum.
- Fonderie non ferreux diffuse en ligne des informations techniques et économiques sur les alliages d'aluminium.
- (en) Institut international de l’aluminium, avec données mensuelle de production par zone géographique.
- INERIS - Fiche de données toxicologiques et environnementales de l'aluminium et de ses dérivés. 17/01/2005]
- L'aluminium au quotidien. Interview de Chris Exley
| s1 | s2 | g | f1 | f2 | f3 | f4 | f5 | f6 | f7 | f8 | f9 | f10 | f11 | f12 | f13 | f14 | d1 | d2 | d3 | d4 | d5 | d6 | d7 | d8 | d9 | d10 | p1 | p2 | p3 | p4 | p5 | p6 | |
| 1 | H | He | |||||||||||||||||||||||||||||||
| 2 | Li | Be | B | C | N | O | F | Ne | |||||||||||||||||||||||||
| 3 | Na | Mg | Al | Si | P | S | Cl | Ar | |||||||||||||||||||||||||
| 4 | K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | |||||||||||||||
| 5 | Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | |||||||||||||||
| 6 | Cs | Ba | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn | |
| 7 | Fr | Ra | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Uut | Fl | Uup | Lv | Uus | Uuo | |
| 8 | Uue | Ubn | * | Ute | Uqn | Uqu | Uqb | Uqt | Uqq | Uqp | Uqh | Uqs | Uqo | Uqe | Upn | Upu | Upb | Upt | Upq | Upp | Uph | Ups | Upo | Upe | Uhn | Uhu | Uhb | Uht | Uhq | Uhp | Uhh | Uhs | Uho |
| ↓ | |||||||||||||||||||||||||||||||||
| g1 | g2 | g3 | g4 | g5 | g6 | g7 | g8 | g9 | g10 | g11 | g12 | g13 | g14 | g15 | g16 | g17 | g18 | ||||||||||||||||
| * | Ubu | Ubb | Ubt | Ubq | Ubp | Ubh | Ubs | Ubo | Ube | Utn | Utu | Utb | Utt | Utq | Utp | Uth | Uts | Uto | |||||||||||||||
| Métalloïdes | Non-métaux | Halogènes | Gaz rares |
| Métaux alcalins | Métaux alcalino-terreux | Métaux de transition | Métaux pauvres |
| Lanthanides | Actinides | Superactinides | Éléments non classés |
- Portail de la chimie
- Portail des minéraux et roches
- Portail des sciences des matériaux