Point de fusion
Le point de fusion ou la température de fusion d'un corps représente la température à une pression donnée, à laquelle un élément pur ou un composé chimique fond c'est-à-dire passe de l'état solide à l'état liquide. Le point de congélation (ou point de solidification selon les matériaux) est la température de la transition inverse. Elle est habituellement mesurée sous pression atmosphérique normale (1 atmosphère) et il y a coexistence entre état solide et état liquide entre ces deux points. Pour une substance pure, les points de fusion et de congélation sont théoriquement égaux et constants à pression fixe. Le point de fusion/congélation le plus connu est probablement celui de l'eau (0 °C), celui-ci ayant étant pris comme zéro de l'échelle centigrade, souvent confondue avec l'échelle Celsius[1].
Il est possible de déterminer la nature d'une substance (identification) par la mesure de sa température de fusion. C'est pourquoi la température de fusion est une propriété caractéristique de la matière. Toutefois, cette information n'est pas suffisante pour permettre une identification formelle, plusieurs molécules pouvant avoir une température de fusion très proche. Elle permet par contre d'éliminer du champ du possible des molécules ayant une température de fusion différente de celle mesurée.

Théorie

La plupart des substances se liquéfient et se solidifient approximativement à la même température. Par exemple, pour le mercure, le point de fusion et de congélation sont 234,32 K (-38,82 °C). Cependant, plusieurs substances ont la caractéristique de pouvoir être en surfusion et peuvent donc geler à une température inférieure à leur point de congélation théorique. L'eau en est un exemple car la pression de surface des molécules d'eau pure est difficile à vaincre et on peut retrouver des gouttelettes d'eau jusqu'à −42 °C dans les nuages si elles ne contiennent pas un noyau de congélation[1].
Thermodynamique
Lorsqu'un corps solide pur est chauffé, la température augmente jusqu'à atteindre le point de fusion. Là, la température reste constante tant que le corps n'est pas passé entièrement sous phase liquide. La différence d'énergie pour causer la fusion complète n'est donc pas seulement celle qu'on doit ajouter pour atteindre la température critique mais également la chaleur latente (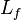 ) pour passer à l'état liquide. Du point de vue de la thermodynamique, l’enthalpie (
) pour passer à l'état liquide. Du point de vue de la thermodynamique, l’enthalpie (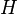 ) et l’entropie (
) et l’entropie (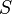 ) du matériau augmentent donc (
) du matériau augmentent donc ( ) à
) à 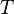 la température de fusion de telle façon qu’on peut les exprimer lors du changement d’un corps de masse m ainsi :
la température de fusion de telle façon qu’on peut les exprimer lors du changement d’un corps de masse m ainsi :
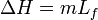 et
et  ce qui donne
ce qui donne 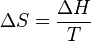
 Chaleur latente massique exprimée en J/kg
Chaleur latente massique exprimée en J/kg Variation d'enthalpie en J
Variation d'enthalpie en J Variation d'entropie en J/K
Variation d'entropie en J/K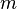 masse en kg
masse en kg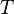 Température en K
Température en K
Caractéristiques
Contrairement à la température de vaporisation (point d'ébullition), la température de fusion est assez insensible aux changements de pression, car les volumes molaires de la phase solide et de la phase liquide sont assez proches[2],[3].
Généralement, lorsque l'on reste dans la même famille de composés chimiques, le point de fusion augmente avec la masse molaire. L'élément du tableau périodique ayant la plus haute température de fusion est le tungstène à 3 683 K (3 410 °C), ce qui en a fait un excellent choix pour les lampes à incandescence. Toutefois, le carbone (graphite) a une température de fusion de 3825°C. Le Ta4HfC5 est le matériau réfractaire qui a le point de fusion le plus élevé à 4 488 K (4 215 °C)[réf. nécessaire]. À l'autre bout du spectre, l’hélium ne se congèle qu'à une température proche du zéro absolu et sous une pression de 20 atmosphères.
Le point de fusion est donc un moyen de vérifier la pureté d'une substance : toute impureté fera varier le point de fusion de la substance testée.
Cas particuliers
La transition entre solide et liquide se produit cependant sur une certaine plage de température pour certaines substances. Par exemple, l’agar-agar fond à 85 °C mais se solidifie entre 31 °C et 40 °C par un processus d’hystérésis. D'autre part, les substances amorphes, comme le verre ou certains polymères, n'ont en général pas de point de fusion, car elles ne subissent pas de fusion proprement dite mais une transition vitreuse.
Il existe également d’autres exceptions :
- deux formes polymorphes ont souvent deux points de fusion différents ;
- pour les molécules, on parle de température de fusion moléculaire[réf. nécessaire] ;
- certaines substances n'ont pas de point de fusion observable. Ceci peut être dû à plusieurs phénomènes :
- la sublimation, c'est-à-dire le passage direct à l'état gazeux (par exemple l'iode ou le carbone),
- une décomposition à l'état solide (exemple des sels de diazonium),
- les polymères réticulés n'ont pas de point de fusion car la réticulation empêche tout glissement des chaînes les unes par rapport aux autres. Formellement, le « bloc de polymères » n'est qu'une seule et unique molécule.
Appareils de mesure

Il existe différents appareils de mesure de point de fusion reposant tous sur la restitution d'un gradient de température. Ils peuvent être constitués soit d'une plaque métallique chauffante telle le Banc Kofler ou le bloc Maquenne, soit d'un bain d'huile tel le tube de Thiele.
Dans le travail pratique de laboratoire on utilise des appareils de mesure de point de fusion automatique. Ils sont faciles à manier, fonctionnent plus vite, fournissent des résultats reproductibles et sont plus précis[4].
Température de fusion des corps purs sous pression atmosphérique
Le tableau suivant donne les températures de fusion des éléments à l'état standard à 1 atm en °C [5] :
| H -259 |
He -272 | ||||||||||||||||
| Li 181 |
Be 1 287 |
B 2 075 |
C 3 500 |
N -210 |
O -219 |
F -219 |
Ne -249 | ||||||||||
| Na 98 |
Mg 650 |
Al 660 |
Si 1 414 |
P 44 |
S 115 |
Cl -102 |
Ar -189 | ||||||||||
| K 64 |
Ca 842 |
Sc 1 541 |
Ti 1 668 |
V 1 910 |
Cr 1 907 |
Mn 1 246 |
Fe 1 538 |
Co 1 495 |
Ni 1 455 |
Cu 1 085 |
Zn 420 |
Ga 30 |
Ge 938 |
As 817 |
Se 221 |
Br -7 |
Kr -157 |
| Rb 39 |
Sr 777 |
Y 1 522 |
Zr 1 855 |
Nb 2 477 |
Mo 2 623 |
Tc 2 157 |
Ru 2 333 |
Rh 1 964 |
Pd 1 555 |
Ag 962 |
Cd 321 |
In 157 |
Sn 232 |
Sb 631 |
Te 450 |
I 114 |
Xe -112 |
| Cs 29 |
Ba 727 |
* |
Hf 2 233 |
Ta 3 017 |
W 3 422 |
Re 3 185 |
Os 3 033 |
Ir 2 446 |
Pt 1 768 |
Au 1 064 |
Hg -39 |
Tl 304 |
Pb 327 |
Bi 271 |
Po 254 |
At 302 |
Rn -71 |
| Fr 27 |
Ra 696 |
** |
Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Uut | Fl | Uup | Lv | Uus | Uuo |
| * |
La 920 |
Ce 799 |
Pr 931 |
Nd 1 016 |
Pm 1 042 |
Sm 1 072 |
Eu 822 |
Gd 1 313 |
Tb 1 359 |
Dy 1 412 |
Ho 1 472 |
Er 1 529 |
Tm 1 545 |
Yb 824 |
Lu 1 663 | ||
| ** |
Ac 1 050 |
Th 1 750 |
Pa 1 572 |
U 1 135 |
Np 644 |
Pu 640 |
Am 1 176 |
Cm 1 345 |
Bk 986 |
Cf 900 |
Es 860 |
Fm 1 527 |
Md 827 |
No 827 |
Lr 1 627 | ||
Température de fusion des polymères ou corps plastiques
Entre 125 °C et 325 °C pour les divers polymères ou corps plastiques, d'après S.A. plastiques Obra.
| Type | Sigles | Point de fusion | Température d'utilisation | Exemples |
|---|---|---|---|---|
| Acrylonitrile butadiène styrène | ABS | 130 °C | 60 °C / −35 °C | |
| Polyacétal copolymère ou Polyoxyméthylène | POMC ou POM | 165 °C | 100 °C / −40 °C | Ertacetal |
| Polyamide 6,6 | PA6-6 | 255 °C | 120 °C / −30 °C | Nylon, Zytel |
| Polyamide 6 | PA6 | 220 °C | 100 °C / −40 °C | Akulon, Ertalon |
| Polycarbonate | PC | 230 °C | 135 °C / −60 °C | Makrolon, Lexan, Arla, Resart |
| Polyester thermoplastique ou Polyéthylène téréphtalate | PETP ou PET | 255 °C | 100 °C / −20 °C | Arnite, Ertalyte |
| Polyester thermoplastique transparent | PETG | 255 °C | 150 °C / −20 °C | Griphen, Vivak, Vectan |
| Polyétheréthercétone | PEEK | 220 °C | (250 °C)? / −60 °C | |
| Polyéthylène basse densité | PEBD | ~ 100 °C | 70 °C / ? | |
| Polyéthylène haute densité 300 | PEHD 300 | 130 °C | 80 °C / −100 °C | |
| Polyéthylène très haute densité 500 | PEHD 500 | 135 °C | 80 °C / −100 °C | |
| Polyéthylène très haute densité 1000 | PEHD 1000 | 138 °C | 80 °C / −260 °C | |
| Polyméthacrylate de méthyle coulé | PMMA plexi gs | 180 °C | 70 °C / −40 °C | Plexiglas, Polivar, Perspex |
| Polyméthacrylate de méthyle extrudé | PMMA plexi XT | 168 °C | 70 °C / −40 °C | Perspex, Acrilex |
| Polypropylène | PP | 163 °C | 100 °C / −10 °C | |
| Polystyrène | PS | 160 °C | 60 °C / −10 °C | |
| Polystyrène expansé | PSE | ? | 80 °C / ? | Sagex Styropor, Neopor |
| Polytétrafluoroéthylène | PTFE | 325 °C | 260 °C / −200 °C | Téflon |
| Polyvinylchlorure surchloré ou Polychlorure de vinyle surchloré | PVC C ou CPVC | 190 °C | 100 °C / −10 °C | |
| Polyvinylchlorure ou Polychlorure de vinyle | PVC | 125 °C | 60 °C / −10 °C | |
| Polyvinylchlorure cellulaire ou expansé | PVC cellulaire | ? | ? / ? | Forex, Kömacel |
| Polyfluorure de vinylidène | PVDF | 173 °C | 140 °C / −40 °C | |
| Tissu bakelisé | HGW | ? | ? / ? | |
Notes et références
- 1 2 R. Feistel and W. Wagner, « A New Equation of State for H2O Ice Ih », (DOI 10.1063/1.2183324), p. 1021–1047
- ↑ La relation exacte est exprimée dans la formule de Clapeyron
- ↑ (en) « J10 Heat: Change of aggregate state of substances through change of heat content: Change of aggregate state of substances and the equation of Clapeyron-Clausius » (consulté le 19 février 2008)
- ↑ Appareils de mesure de point de fusion, sur le site kruess.com - consulté le 26 juillet 2012
- ↑ (en) David R. Lide, CRC Handbook of Chemistry and Physics, CRC Press Inc, , 90e éd., Relié, 2804 p. (ISBN 978-1-420-09084-0)
Articles connexes
- Fusion (physique)
- Thermostabilité
- DSC
- Point de ramollissement bille et anneau
- Liste des éléments chimiques par température de fusion
- Portail de la chimie
- Portail de la physique
- Portail des sciences des matériaux
