Étain
| Étain | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Informations générales | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Nom, symbole, numéro | Étain, Sn, 50 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Série chimique | métaux pauvres | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Groupe, période, bloc | 14, 5, p | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Masse volumique | 5,77 g·cm-3 (gris), 7,29 g·cm-3 (blanc)[1] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Dureté | 1,5 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Couleur | Gris argenté | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| No CAS | [2] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| No EINECS | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propriétés atomiques | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Masse atomique | 118,710 ± 0,007 u [1] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Rayon atomique (calc) | 145 pm (145 pm) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Rayon de covalence | 139 ± 4 pm [3] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Rayon de van der Waals | 217 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Configuration électronique | [Kr] 4d10 5s2 5p2 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Électrons par niveau d’énergie | 2, 8, 18, 18, 4 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| État(s) d’oxydation | 0, +2, +4 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Oxyde | Amphotère | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Structure cristalline | Tétragonal | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propriétés physiques | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| État ordinaire | solide | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Point de fusion | 231,928 °C (congélation)[4] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Point d’ébullition | 2 602 °C [1] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Énergie de fusion | 7,029 kJ·mol-1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Énergie de vaporisation | 295,8 kJ·mol-1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Volume molaire | 16,3 cm3·mol-1 [5] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Pression de vapeur | 5,78×10-21 Pa à 231,85 °C [5] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Vitesse du son | 2 500 m·s-1 à 20 °C | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Divers | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Électronégativité (Pauling) | 1,96 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Chaleur massique | 228 J·kg-1·K-1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Conductivité électrique | 9,17×106 S·m-1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Conductivité thermique | 66,6 W·m-1·K-1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Solubilité | sol. dans HCl, H2SO4 concentré chaud[6] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Énergies d’ionisation[7] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 1re : 7,34392 eV | 2e : 14,6322 eV | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 3e : 30,50260 eV | 4e : 40,73502 eV | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 5e : 72,28 eV | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Isotopes les plus stables | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Précautions | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
État pulvérulent : Xi Phrases R : 36/37, Phrases S : 26,
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Produit non contrôlé | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
État pulvérulent : Attention | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Unités du SI & CNTP, sauf indication contraire. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| modifier | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
L’étain, du latin stannum, est un élément chimique de la famille du carbone, moins couramment appelée famille des cristallogènes, de symbole Sn et de numéro atomique 50. De même que l'élément germanium situé juste au-dessus dans la classification périodique, l'étain existe aux états d'oxydation 0, +2 et +4. Il existe 10 isotopes stables de l'étain, principalement de masse 120, 118 et 116. Il est extrait essentiellement d'un minéral appelé cassitérite où il se trouve sous forme d'oxyde SnO2. Il est connu depuis l'antiquité où il servait pour protéger la vaisselle de l'oxydation et pour préparer le bronze. Il est toujours utilisé pour cet usage et pour la soudure. Cet élément est peu toxique.
Caractéristiques

C'est un métal gris-argent, malléable, moyennement ductile à température ambiante. Il est hautement cristallisé et la déformation d'une lame d'étain produit du bruit ; on dit que l'étain « crie » ou « pleure » (phénomène de maclage).
Il résiste à la corrosion par l'eau de mer et l'eau douce, mais peut être attaqué par les acides forts. Cette résistance est de nature cinétique puisque le potentiel normal du couple Sn2+Sn = -0,136 V. Il est donc thermodynamiquement attaqué par l'eau, et bien sûr par l'oxygène.
C'est une ressource non renouvelable.
Variétés allotropiques
À la pression atmosphérique, l'étain pur possède trois variétés allotropiques (il peut exister sous trois formes cristallines). Entre 13 °C et 162 °C, l'étain est sous forme 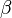 , c'est l'étain blanc, de masse volumique 7,28 g.cm-3. Au-dessus de 162 °C, on trouve la forme
, c'est l'étain blanc, de masse volumique 7,28 g.cm-3. Au-dessus de 162 °C, on trouve la forme 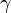 , structure orthorhombique, cassante, que l'on peut pulvériser avec un mortier. En dessous de 13 °C, l'étain blanc se transforme lentement en étain gris, de structure diamant, c'est la forme
, structure orthorhombique, cassante, que l'on peut pulvériser avec un mortier. En dessous de 13 °C, l'étain blanc se transforme lentement en étain gris, de structure diamant, c'est la forme 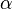 , de masse volumique 5,75 g.cm-3.
, de masse volumique 5,75 g.cm-3.
Cette transformation et le changement de densité qui l'accompagne affectent la tenue mécanique du matériau. En dessous de −50 °C, la transformation est rapide et l'étain devient pulvérulent (tombe en poussière). C'est la « peste de l'étain ». Ce phénomène « est décrit lors de la campagne de Russie par les soldats de Napoléon, bien placés pour faire cette observation, leurs boutons de pantalons étaient en étain[10] ».
Isotopes
L'étain possède 39 isotopes connus, de nombre de masse variant de 99 à 137, et 32 isomères nucléaires. Parmi eux, 10 sont stables (trois sont potentiellement radioactifs, mais aucune désintégration n'a pour l'instant été observée), ce qui fait de l'étain l'élément comportant le plus d'isotopes stables, suivi par le xénon. Il y a de grandes chances que cette propriété ait un rapport avec le fait que l'étain possède 50 protons, un nombre magique.
Historique
L'étain était connu dans l'Antiquité sur toute la planète. C'est un des composants de la métallurgie du Bronze. Le nom d'origine latine stannum ou stagnum fut d'abord utilisé pour un mélange d'argent et de plomb. Les navires phéniciens franchirent les colonnes d'Hercule et allèrent jusqu'en Bretagne et en Cornouaille (les mythiques « îles Cassitérides ») à la recherche des mines d'étain (en grec ancien κασσίτερος). Plus tard, Jules César a décrit l'exploitation de minerais d'étain dans les mines de Cornouailles en Grande-Bretagne. Retirer aux Gaulois et aux Grecs qui l'exportaient par le port de Massalia (Marseille) le contrôle de la route de l'étain depuis la Grande-Bretagne par la Gaule transalpine en empruntant le Rhône, faisait partie des objectifs de la conquête césarienne[réf. souhaitée].
Production
La métallurgie de l'étain est une réduction de l'oxyde SnO2 par le carbone à haute température[11].
Il existe également un circuit de recyclage qui produit 30% de l'étain. Ainsi, l'étain contenu dans un alliage appelé fer-blanc (acier recouvert de 0,3% d'étain pour le protéger) est récupéré par traitement à la soude à 70°C. L'acier reste à l'état métallique alors que l'étain est attaqué et produit des ions stanate SnO44-. Ceux-ci sont ensuite réduits en étain métallique par électrolyse[11].
La France ne possède plus de mine d'étain depuis 1975. Les dernières, en Bretagne (mine de Saint Renan), produisaient 500 t/an[11].
La Malaisie est le pays où se situent la plupart des réserves mondiales d'étain. La cassitérite y est notamment exploitée par dragage des fonds sous-marins, ce qui n'est pas sans poser de sérieux problèmes environnementaux.
Utilisations
Métal

- Vaisselle et décoration : généralement en « métal anglais », un alliage d'étain (de 70 à 94 %), d'antimoine (de 5 à 24 %) et de cuivre (jusqu'à 5 %).
- Figurines, soldats dits « de plomb », en étain ou alliage avec plomb, objets décoratifs.
- Les feuilles d’étain ont été utilisées pour la conservation de la viande et du Roquefort.
- L'étain a été utilisé pour l'emballage de produits pâteux à l'abri de l'air, remplaçant d'abord les vessies par le tube de peinture pour artistes à partir de 1841, puis des cosmétiques et le dentifrice ou des produits alimentaires au début du XXe siècle.
- Verre : pour fabriquer le verre plat, le procédé le plus répandu est le flottage sur lit d'étain en fusion (verre « float » ou verre flotté).
Bronze
Le bronze, mélange de cuivre et d'étain, est actuellement considéré comme le premier alliage qui a été réalisé et utilisé par l'homme. Son influence fut si grande qu'une période de l'histoire fut appelée « âge du bronze » en référence à cet alliage (d'environ 2000 à 800 av. J.-C.). Le nom « bronze » viendrait de Brindisi, ville d'Italie, célèbre dans l'antiquité par sa métallurgie du bronze. En Mésopotamie, à Ur, on a trouvé des objets en bronze datés de 5 000 ans av. J.-C. [citation nécessaire].
L'étain intervient sous forme alliée dans la composition de nombreux objets, instruments ou matériaux, notamment :
- Sculpture : l'alliage noble pour les sculptures est le bronze (environ 80 % cuivre, 20 % étain).
- Robinetterie : utilisation d'un alliage intermédiaire entre le laiton et le bronze qui comprend 10 % d'étain et 3 % de zinc.
- Tuyau d'orgue : utilisation d'un alliage comprenant 77,5 % d'étain, 22 % de plomb et 0,5 % de cuivre. Il donne une belle sonorité, résiste bien à la corrosion et garde une belle couleur pour les tuyaux de « montre ».
- Cloche : utilisation du bronze contenant entre 21,5 et 24 % d'étain (d'autant plus que la cloche est petite).
- Canon de l'artillerie à poudre.
Alliage avec le plomb
L'étain est un composant essentiel des alliages courants utilisés en facture d'orgue. Fondu généralement par le fabricant de tuyaux lui-même, on le trouve le plus fréquemment mélangé au plomb, avec souvent des traces d'autres métaux comme l'antimoine. La proportion varie entre 50 et 75 % d'étain, rarement jusqu'à 90 et même 100 % d'étain.
Autres alliages et composites
- Étamage : l'étamage consiste à recouvrir une pièce métallique d'une fine couche d'étain pour des raisons alimentaires ou pour garantir de bons contacts électriques. L'étain pur (sans plomb) peut cependant former des « whiskers », c'est-à-dire des fils micrométriques susceptibles de provoquer des courts-circuits. Le processus de formation des « whiskers », qui dure plusieurs mois, est mal compris (il semble que l'intensité du champ magnétique joue un rôle). Des remèdes existent (ajouts de traces d'autres métaux au moment du dépôt de la couche d'étain).
- Brasure (nommé abusivement soudure) : Le métal d'apport est constitué par un alliage, souvent d'étain (à raison de 2 à 63 %) avec le plomb, à bas point de fusion (185 °C). Du fait de la méfiance de plus en plus grande vis-à-vis du plomb, la composition évolue vers des alliages sans plomb, par exemple étain-cuivre ou étain-argent, beaucoup plus chers et nécessitant une température plus élevée (225 °C). De par leur bonne conductivité et de leur relativement basse température de fusion, ces alliages sont très couramment utilisés pour souder des composants électroniques sur des circuits imprimés.
- Monnaies : On incorpore souvent de l'étain dans les pièces de monnaie. Les pièces de 50 centimes, 20 centimes et 10 centimes d'Euro en contiennent 1 %.
- Fer-blanc : tôles fines d'acier doux recouvertes d'une mince couche d'étain, généralement par électro-déposition. Le fer-blanc est surtout utilisé pour fabriquer les emballages métalliques (boîtes de conserve).
- Supraconducteur : l'alliage étain-niobium Nb3Sn est supraconducteur à des températures relativement « élevées » (température critique de −254,15 °C). Ses performances : densité de courant de 750 A⋅mm-2 sous 12 teslas le désigne comme le successeur du niobium-titane pour les applications à grande échelle.
Principaux composés de l'étain et leurs utilisations
- L'oxyde d'étain SnO2 est utilisé entre 4 et 8% dans certains verres comme opacifiant[11].
- Le tétrachlorure d'étain SnCl4 qui permet de préparer les dérivés organoétains ou comme catalyseur de Friedel-Crafts pour les réactions d'acylation, d'alkylation et de cyclisation[11].
- Les stannates SnO44- sont des sources d'étain pour les étamages électrolytiques[11].
- L'octanoate d'étain (II) Sn(C7H15COO)2 s'utilise comme catalyseur pour la production de mousses de polyuréthane[11].
- Les Organoétains (50 000 t/ans utilisées dans le monde), dont :
- le plus utilisé, le tributylétain n-(C4H9)3Sn-H. Il est utilisé pour les peintures navales antifouling[11].
- les dialkylétains (20 940 t) sont utilisés comme stabilisant thermique du PVC[11].
- Le dilaurate de dibutylétain, (nC4H9)2Sn(OOCC11H23)2, sert de catalyseur pour la fabrication des caoutchoucs silicones[11].
- L'oxyde de tributylétain [(n-C4H9)3Sn]2O est un fongicide utilisé pour la préservation du bois[11]. On l'utilise dans des peintures pour coques de bateau pour empêcher la fixation des algues. Ce composé est toxique pour l'environnement, ce qui en fait limiter l'usage actuellement.
Couleur

L'étain utilisé en décoration a un brillant assez faible par rapport à celui d'autres métaux, mais suffisant pour être difficile à répliquer, sauf avec des peintures métallisées. La surface de l'étain oxydée (patinée) est plus sombre et moins brillante que celle de l'étain neuf.
La couleur étain est un nom de couleur en usage dans la mode, pour désigner une nuance de gris, qui ne peut avoir l'apparence du métal. Dans la décoration et le bâtiment, il s'utilise pour des surfaces grises ayant un certain brillant.
Dans les répertoires commerciaux, on trouve en fil à broder 169 étain[12] ; en matériaux de construction béton ciré étain[13].
L'étain est le composant principal d'un pigment jaune historique, l'or mussif, un bi-sulfure d'étain d'aspect doré, utilisé notamment dans l'art byzantin pour les icônes et les mosaïques. Il se compose de fines plaquettes donnant un éclat à la peinture. Il est référencé PY38 au Colour Index. C'est un produit vénéneux, abandonné aujourd'hui au profit de poudres de bronze[14].
Significations conventionnelles
- Les noces d'étain symbolisent les 10 ans de mariage dans le folklore français.
- L'étain est le 4e niveau dans la progression de la sarbacane sportive.
- Fabre d'Églantine proposa d'associer à chaque jour du calendrier républicain un des « objets qui composent la véritable richesse nationale », à la place des saints du calendrier romain. Le 26e jour du mois de nivôse dans le à l'Étain[15].
Voir aussi
Articles connexes
- Étain 100
- Tributylétain
- Organostanniques
- Étamage
- Imposex
Liens externes
- Les fausses idées reçues sur l'étain
- Informations de marché sur le site de la Conférence des Nations unies pour le commerce et le développement
- Les Whiskers d'étain
Notes et références
- 1 2 3 (en) David R. Lide, CRC Handbook of Chemistry and Physics, CRC Press Inc, , 90e éd., Relié, 2804 p. (ISBN 978-1-420-09084-0)
- ↑ Base de données Chemical Abstracts interrogée via SciFinder Web le 15 décembre 2009 (résultats de la recherche)
- ↑ (en) Beatriz Cordero, Verónica Gómez, Ana E. Platero-Prats, Marc Revés, Jorge Echeverría, Eduard Cremades, Flavia Barragán et Santiago Alvarez, « Covalent radii revisited », Dalton Transactions, , p. 2832 - 2838 (DOI 10.1039/b801115j)
- ↑ Procès-verbaux du Comité international des poids et mesures, 78e session, 1989, pp. T1-T21 (et pp. T23-T42, version anglaise).
- 1 2 http://environmentalchemistry.com/yogi/periodic/Sn.html
- ↑ (en) Thomas R. Dulski, A manual for the chemical analysis of metals, vol. 25, ASTM International, , 251 p. (ISBN 0803120664, lire en ligne), p. 71
- ↑ (en) David R. Lide, CRC Handbook of Chemistry and Physics, CRC, , 89e éd., p. 10-203
- 1 2 SIGMA-ALDRICH
- ↑ « Étain » dans la base de données de produits chimiques Reptox de la CSST (organisme québécois responsable de la sécurité et de la santé au travail), consulté le 25 avril 2009
- ↑ Robert Luft, Dictionnaire des corps purs simples de la chimie - Éléments, atomes et molécules, Association Cultures et Techniques, , p. 175.
- 1 2 3 4 5 6 7 8 9 10 11 Jean-Louis VIGNES - Gilles ANDRE - Frédéric KAPALA Données industrielles, économiques, géographiques sur les principaux produits chimiques, métaux et matériaux 8e Édition : 2005-2013
- ↑ « Nuancier DMC numéros et noms », sur sd-g1.archive-host.com.
- ↑ « Nuancier béton ciré », sur 3dco.fr.
- ↑ Jean Petit, Jacques Roire et Henri Valot, Encyclopédie de la peinture : formuler, fabriquer, appliquer, t. 3, Puteaux, EREC, , p. 46
- ↑ Fabre d'Églantine, Rapport fait à la Convention nationale dans la séance du 3 du second mois de la seconde année de la République Française, (lire en ligne), p. 12, 22.
| s1 | s2 | g | f1 | f2 | f3 | f4 | f5 | f6 | f7 | f8 | f9 | f10 | f11 | f12 | f13 | f14 | d1 | d2 | d3 | d4 | d5 | d6 | d7 | d8 | d9 | d10 | p1 | p2 | p3 | p4 | p5 | p6 | |
| 1 | H | He | |||||||||||||||||||||||||||||||
| 2 | Li | Be | B | C | N | O | F | Ne | |||||||||||||||||||||||||
| 3 | Na | Mg | Al | Si | P | S | Cl | Ar | |||||||||||||||||||||||||
| 4 | K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | |||||||||||||||
| 5 | Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | |||||||||||||||
| 6 | Cs | Ba | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn | |
| 7 | Fr | Ra | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Uut | Fl | Uup | Lv | Uus | Uuo | |
| 8 | Uue | Ubn | * | Ute | Uqn | Uqu | Uqb | Uqt | Uqq | Uqp | Uqh | Uqs | Uqo | Uqe | Upn | Upu | Upb | Upt | Upq | Upp | Uph | Ups | Upo | Upe | Uhn | Uhu | Uhb | Uht | Uhq | Uhp | Uhh | Uhs | Uho |
| ↓ | |||||||||||||||||||||||||||||||||
| g1 | g2 | g3 | g4 | g5 | g6 | g7 | g8 | g9 | g10 | g11 | g12 | g13 | g14 | g15 | g16 | g17 | g18 | ||||||||||||||||
| * | Ubu | Ubb | Ubt | Ubq | Ubp | Ubh | Ubs | Ubo | Ube | Utn | Utu | Utb | Utt | Utq | Utp | Uth | Uts | Uto | |||||||||||||||
| Métalloïdes | Non-métaux | Halogènes | Gaz rares |
| Métaux alcalins | Métaux alcalino-terreux | Métaux de transition | Métaux pauvres |
| Lanthanides | Actinides | Superactinides | Éléments non classés |
- Portail des minéraux et roches
- Portail de la chimie
- Portail des sciences des matériaux