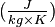Argon
| Argon | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Informations générales | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Nom, symbole, numéro | Argon, Ar, 18 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Série chimique | Gaz rare | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Groupe, période, bloc | 18 (VIIIA), 3, p | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Masse volumique | 1,7837 g·l-1 (0 °C, 1 atm)[1] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Couleur | incolore | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| No CAS | [3] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| No EINECS | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propriétés atomiques | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Masse atomique | 39,948 ± 0,001 u | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Rayon atomique (calc) | (71 pm) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Rayon de covalence | 106 ± 10 pm [4] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Rayon de van der Waals | 188 pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Configuration électronique | [Ne] 3s2 3p6 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Électrons par niveau d’énergie | 2, 8, 8 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| État(s) d’oxydation | 0 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Oxyde | inconnu | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Structure cristalline | Cubique à faces centrées | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propriétés physiques | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| État ordinaire | Gaz (non magnétique) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Point de fusion | -189,36 °C [1] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Point d’ébullition | -185,85 °C [1] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Énergie de fusion | 1,188 kJ·mol-1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Énergie de vaporisation | 6,43 kJ·mol-1 (1 atm, −185,85 °C)[1] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Température critique | -122,3 °C | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Point triple | −189,3442 °C [5] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Volume molaire | 22,414×10-3 m3·mol-1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Pression de vapeur | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Vitesse du son | 319 m·s-1 à 20 °C | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Divers | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
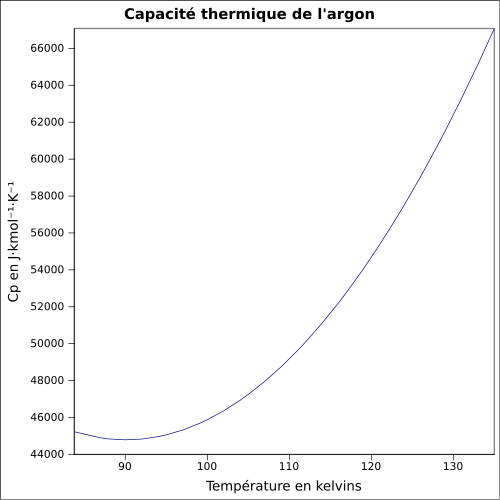
| Chaleur massique | 520 J·kg-1·K-1
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Conductivité thermique | 0,01772 W·m-1·K-1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Énergies d’ionisation[6] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 1re : 15,759610 eV | 2e : 27,62966 eV | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 3e : 40,74 eV | 4e : 59,81 eV | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 5e : 75,02 eV | 6e : 91,009 eV | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 7e : 124,323 eV | 8e : 143,460 eV | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 9e : 422,45 eV | 10e : 478,69 eV | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 11e : 538,96 eV | 12e : 618,26 eV | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 13e : 686,10 eV | 14e : 755,74 eV | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 15e : 854,77 eV | 16e : 918,03 eV | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 17e : 4 120,8857 eV | 18e : 4 426,2296 eV | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Isotopes les plus stables | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Précautions | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Phrases S : 38,
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
 A, | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
 Attention | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Unités du SI & CNTP, sauf indication contraire. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| modifier | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
L’argon est un élément chimique, de symbole Ar et de numéro atomique 18.
Il appartient au groupe des gaz nobles (aussi appelé « gaz rares » voire « gaz inertes »), avec l’hélium, le néon, le krypton, le xénon, le radon. L’ununoctium, de découverte plus récente, fait peut-être également partie de ce groupe. Malgré le nom générique de cette famille, l’argon (sur Terre) n’est pas à proprement parler un gaz « rare » : il figure, derrière le diazote et le dioxygène, au troisième rang d'importance des constituants de l’atmosphère terrestre (0,933 % en volume). Et il est, de ce fait, l’un des gaz nobles les plus utilisés.
La presque totalité de l'argon terrestre est l'isotope radiogénique argon 40 formé par la désintégration radioactive du potassium 40 dans la croûte terrestre. Par contre dans l'Univers, l'isotope le plus commun est l'argon 36, qui est l'isotope principal produit par le processus de nucléosynthèse stellaire aux supernovas.
Histoire
La présence dans l’air de l’argon (provenant du grec argos signifiant « paresseux ») fut suspectée par Henry Cavendish dès 1785 mais sa découverte par Lord Rayleigh et Sir William Ramsay attendit 1894.
Ils furent mis sur la piste par la différence de densité entre l’azote produit chimiquement et celui extrait de l’air par élimination de l’oxygène. La distillation fractionnée de l’air liquide leur permit d’en produire une quantité notable en 1898 et par la même occasion d’isoler le néon et le xénon.
L’argon a aussi été rencontré en 1882 aux travers de recherches indépendamment menées par H. F. Newall et W. N. Hartley.
Le symbole de l’argon est aujourd’hui Ar, mais a été A jusqu’en 1957.
La première molécule impliquant l’argon (HArF) a été synthétisée en 2000.
Occurrence
L’argon est isolé du reste de l’air liquide par fractionnement et est donc facile à produire en grande quantité puisque l’atmosphère en contient près de 1 % (0,933 %). L’atmosphère de Mars est grossièrement comparable quant à ses concentrations relatives en isotopes d'argon, puisque contenant 1,6 % d’argon 40 et 5 ppm d’argon 36.
Caractéristiques notoires
C’est un élément chimiquement inerte, incolore, sans saveur et inodore sous ses formes liquide et gazeuse. L’argon est 2,5 fois plus soluble dans l’eau que le diazote qui a approximativement la même solubilité que le dioxygène.
Il n’y a aucun véritable composé chimique connu qui contienne de l’argon. Seul le fluorohydrure d’argon HArF a été détecté dans des conditions très particulières[10] pour des températures inférieures à 27 K (soit -246 °C).
Isotopes
Les principaux isotopes de l'argon présents sur Terre sont l'argon 40 (99,6 %), 36 (0,34 %) et 38 (0,06 %).
Le potassium radioactif « naturel » (le 40K), a une demi-vie de 1,248×109 ans, et se désintègre en 2 produits :
- en argon 40 (11,2 %) stable, par capture électronique (ou émission de positron).
- en calcium 40 (88,8 %) également stable, par désintégration β-.
Ces propriétés ainsi que le rapport entre les sous-produits formés sont employés pour déterminer l’âge de roches par la méthode de la datation au potassium-argon.
Dans l’atmosphère terrestre, l’argon 37, ainsi que l’argon 39 (tous deux radioactifs), sont produits par l’activité des rayons cosmiques.
- L’argon 37 est produit par réaction du calcium 40 soumis aux radiations d’explosions nucléaires souterraines, il a une demi-vie de 35 jours.
- Sous la surface de la Terre, l’argon 39 est également produit par capture neutronique du potassium 39 ou par émission de particules alpha du calcium.[réf. nécessaire]
L'argon est remarquable parce que sa composition isotopique varie beaucoup entre diverses parties du système solaire. Aux endroits où la source principale de l'argon est la désintégration radioactive du potassium 40 des roches, l'argon 40 sera l'isotope majoritaire, comme sur les planètes telluriques retenant une atmosphère (Vénus, la Terre, et Mars). Par contre l'argon formé directement par la nucléosynthèse stellaire contient surtout le noyau argon 36 produit par la réaction alpha. Par exemple, l'argon du Soleil contient 84,6 % d'argon 36 selon les mesures du vent solaire. Il en est de même dans les planètes géantes, dont l'atmosphère est issue de l'accrétion du gaz primordial.
La prédominance de l'argon 40 radiogénique est responsable du fait que le poids atomique de l'argon terrestre est supérieur à celui du prochain élément, le potassium. Ceci semblait paradoxal lors de la découverte de l'argon en 1894, parce que Dmitri Mendeleïev avait rangé son tableau périodique des éléments par ordre de poids atomique croissant, mais l'inertie de l'argon implique qu'il doit être placé avant le potassium qui est un métal alcalin très réactif. Ce problème fut résolu par Henry Moseley, qui démontra en 1913 que le tableau périodique est vraiment rangé par ordre de numéro atomique croissant.
La très supérieure abondance atmosphérique de l'argon relatif aux autres gaz nobles peut aussi être attribuée à la présence de l'argon 40 radiogénique. L'isotope primordial argon 36 possède une abondance de seulement 31,5 ppm (= 9 340 ppm x 0,337 %), comparable à celle du néon (18,18 ppm).
Composés
L'argon possède une couche de valence complète avec sous-couches s et p remplies. Il est alors très stable et très résistant à se lier à d'autres éléments. Avant 1962, tous les gaz nobles y compris l'argon étaient considérés chimiquement inertes et incapables de former le moindre composé. Cependant des composés de gaz nobles plus lourds (krypton et xénon) ont été synthétisés depuis.
En 2000, le premier composé de l'argon fut synthétisé par des chercheurs à l'Université de Helsinki (Finlande). Lors de l'irradiation par la lumière ultraviolette d'argon congelé contenant une petite quantité du fluorure d'hydrogène (HF), une petite quantité de fluorohydrure d'argon (HArF) fut formée. Il est stable aux températures inférieures à 40 K (-233oC). En 2010, le cation métastable ArCF22+ fut observé.
Applications
L’argon est, entre autres, utilisé :
- pour la conservation de la viande dans l’industrie agro-alimentaire.
- pour l’éclairage puisqu’il ne réagit pas avec le filament d’une lampe à incandescence classique même aux températures élevées (dans les cas où le diazote ne convient pas comme gaz semi-inerte) ;
- comme gaz inerte de protection pour le soudage TIG avec électrodes non fusibles et le découpage (Ar+O2 selon convention) ;
- comme gaz inerte en chimie fine pour réaliser des manipulations en l’absence d’oxygène ;
- comme gaz inerte dans la lame d’air des vitrages isolants à faible émission;
- comme gaz inerte dans les réservoirs d’extinction d’incendie (allié à 50 % d’azote) ;
- comme atmosphère protectrice pour la fabrication de cristaux de silicium et de germanium ultra-pur pour l’industrie électronique ;
- en plongée sous-marine pour gonfler la combinaison étanche, à cause de ses propriétés d’isolant thermique non-réactif.
L’argon 39 a été employé notamment pour dater des eaux souterraines.
En récupération, lors de la cuisson d'écume d'aluminium dans des fours à plasma, l'argon stabilise la réaction d'inflammabilité de l'aluminium qui tend à s'auto-allumer.
L'argon est produit industriellement par distillation fractionnée d'air liquide dans un réacteur de séparation d'air cryogénique. C'est un procédé qui permet de séparer l'azote liquide, qui bout à 77,3 K, de l'argon qui bout à 87,3K et de l'oxygène liquide qui bout à 90,2 K. Environ 700 000 tonnes d'argon sont produites dans le monde entier chaque année[11].
40Ar, l'isotope le plus abondant de l'argon, est produit par la décroissance radioactive du 40K qui a une demi-vie de 1,25x109 ans par capture d'électrons ou émission de positrons. Grâce à cela, il est utilisé dans la datation potassium-argon pour déterminer l'âge des roches. L'argon est utilisé dans beaucoup de procédés industriels à haute température, où des substances ordinairement non réactives le deviennent. Par exemple, une atmosphère d'argon est utilisée dans les fours électriques graphites pour empêcher le graphite de brûler. Pour certains de ces procédés, la présence d'azote ou d'oxygène gazeux peut endommager le matériau. L'argon est utilisé dans de nombreux types de soudure à arc. Une atmosphère d'argon est également utilisée pour grossir les cristaux de sillicium et de germanium. L'argon est utilisé dans l'industrie avicole pour asphyxier les animaux, soit pour un abattage de masse après l'apparition d'une maladie, soit comme moyen d'abattage plus humaine que l'électronarcose. La relativement grande densité de l 'argon le fait rester près du sol lors du gazage. Sa nature non réactive le rend compatible avec les produits alimentaires.[citation nécessaire][12] L'argon est parfois utilisé pour éteindre les incendies là où il faut éviter d'endommager les équipements.
Dangers
Tout comme l’hélium, l’argon n’est pas dangereux à faible concentration. Toutefois, une inhalation d’une grande quantité comporte des risques d’asphyxie par privation d’oxygène (Risque d'anoxie); ceci peut se produire lors d'opérations de soudage dans un espace confiné.
Notes et références
- 1 2 3 4 (en) David R. Lide, CRC Handbook of Chemistry and Physics, CRC Press Inc, , 90e éd., Relié, 2804 p. (ISBN 978-1-420-09084-0)
- 1 2 3 (en) Robert H. Perry et Donald W. Green, Perry's Chemical Engineers' Handbook, USA, McGraw-Hill, , 7e éd., 2400 p. (ISBN 0-07-049841-5), p. 2-50
- ↑ Base de données Chemical Abstracts interrogée via SciFinder Web le 15 décembre 2009 (résultats de la recherche)
- ↑ (en) Beatriz Cordero, Verónica Gómez, Ana E. Platero-Prats, Marc Revés, Jorge Echeverría, Eduard Cremades, Flavia Barragán et Santiago Alvarez, « Covalent radii revisited », Dalton Transactions, , p. 2832 - 2838 (DOI 10.1039/b801115j)
- ↑ Procès-verbaux du Comité international des poids et mesures, 78e session, 1989, pp. T1-T21 (et pp. T23-T42, version anglaise).
- ↑ (en) David R. Lide, CRC Handbook of Chemistry and Physics, TF-CRC, , 87e éd. (ISBN 0849304873), p. 10-202
- ↑ SIGMA-ALDRICH
- 1 2 Entrée du numéro CAS « 7440-37-1 » dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 30 janvier 2009 (JavaScript nécessaire)
- ↑ « Argon » dans la base de données de produits chimiques Reptox de la CSST (organisme québécois responsable de la sécurité et de la santé au travail), consulté le 25 avril 2009
- ↑ Université d’Helsinki en 2000
- ↑ « Periodic Table of Elements: Argon – Ar », Environmentalchemistry.com (consulté le 12 septembre 2008)
- ↑ D. L. Fletcher, « Slaughter Technology », Symposium: Recent Advances in Poultry Slaughter Technology, 1999 (lire en ligne)
Voir aussi
- Chimie des gaz nobles
- Tableau périodique des éléments
Liens externes
- (en) Images de l'argon sous différentes formes
| s1 | s2 | g | f1 | f2 | f3 | f4 | f5 | f6 | f7 | f8 | f9 | f10 | f11 | f12 | f13 | f14 | d1 | d2 | d3 | d4 | d5 | d6 | d7 | d8 | d9 | d10 | p1 | p2 | p3 | p4 | p5 | p6 | |
| 1 | H | He | |||||||||||||||||||||||||||||||
| 2 | Li | Be | B | C | N | O | F | Ne | |||||||||||||||||||||||||
| 3 | Na | Mg | Al | Si | P | S | Cl | Ar | |||||||||||||||||||||||||
| 4 | K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | |||||||||||||||
| 5 | Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | |||||||||||||||
| 6 | Cs | Ba | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn | |
| 7 | Fr | Ra | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Uut | Fl | Uup | Lv | Uus | Uuo | |
| 8 | Uue | Ubn | * | Ute | Uqn | Uqu | Uqb | Uqt | Uqq | Uqp | Uqh | Uqs | Uqo | Uqe | Upn | Upu | Upb | Upt | Upq | Upp | Uph | Ups | Upo | Upe | Uhn | Uhu | Uhb | Uht | Uhq | Uhp | Uhh | Uhs | Uho |
| ↓ | |||||||||||||||||||||||||||||||||
| g1 | g2 | g3 | g4 | g5 | g6 | g7 | g8 | g9 | g10 | g11 | g12 | g13 | g14 | g15 | g16 | g17 | g18 | ||||||||||||||||
| * | Ubu | Ubb | Ubt | Ubq | Ubp | Ubh | Ubs | Ubo | Ube | Utn | Utu | Utb | Utt | Utq | Utp | Uth | Uts | Uto | |||||||||||||||
| Métalloïdes | Non-métaux | Halogènes | Gaz rares |
| Métaux alcalins | Métaux alcalino-terreux | Métaux de transition | Métaux pauvres |
| Lanthanides | Actinides | Superactinides | Éléments non classés |
- Portail de la chimie
- Portail de l’alimentation et de la gastronomie