Césium
| Césium | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Informations générales | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Nom, symbole, numéro | Césium, Cs, 55 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Série chimique | Métal alcalin | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Groupe, période, bloc | 1 (IA), 6, s | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Masse volumique | 1,873 g·cm-3 (20 °C)[1] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Dureté | 5,5 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Couleur | argenté-doré | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| No CAS | [2] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| No EINECS | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propriétés atomiques | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Masse atomique | 132,90545196 ± 0,00000006 u[1] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Rayon atomique (calc) | 260 pm (298 pm) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Rayon de covalence | 244 ± 11 pm [3] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Configuration électronique | [Xe] 6s1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Électrons par niveau d’énergie | 2, 8, 18, 18, 8, 1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| État(s) d’oxydation | 1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Oxyde | base forte | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Structure cristalline | cubique centré | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propriétés physiques | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| État ordinaire | solide | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Point de fusion | 28,44 °C [1] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Point d’ébullition | 671 °C [1] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Énergie de fusion | 2,092 kJ·mol-1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Énergie de vaporisation | 67,74 kJ·mol-1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Volume molaire | 70,94×10-6 m3·mol-1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Pression de vapeur | 2,5 Pa | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Divers | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Électronégativité (Pauling) | 0,79 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Chaleur massique | 240 J·kg-1·K-1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Conductivité électrique | 4,89×106 S·m-1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Conductivité thermique | 35,9 W·m-1·K-1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Énergies d’ionisation[4] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 1re : 3,893905 eV | 2e : 23,15744 eV | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Isotopes les plus stables | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Précautions | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
 C  F Phrases R : 11, 14/15, 34, Phrases S : 8, 16, 26, 36/37/39, 43, 45,
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
  B4, B6, E, | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
  Danger | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Unités du SI & CNTP, sauf indication contraire. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| modifier | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Le césium ou cæsium[8] est l'élément chimique de symbole Cs et de numéro atomique 55.
C'est un métal alcalin d'apparence argentée dorée dont le point de fusion de 28 °C est proche de la température ambiante (CNTP), à laquelle il peut demeurer à l'état liquide par surfusion ; le césium partage cette propriété avec le gallium et le rubidium, le mercure étant le seul métal liquide à température ambiante.
Ses propriétés chimiques sont semblables à celles du rubidium et du potassium, qui appartiennent à la même série chimique. Il est extrêmement réactif et pyrophorique, et réagit avec l'eau même à une température aussi basse que -116 °C.
On extrait le césium à partir de la pollucite, tandis que ses radioisotopes sont issus des déchets nucléaires, notamment le césium 137.

Histoire
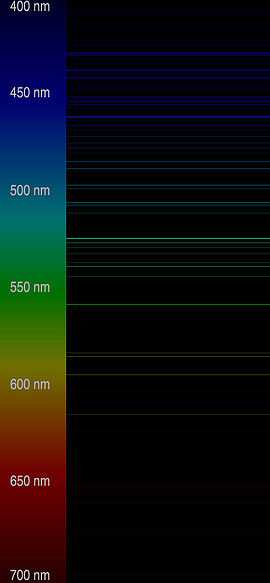
Le nom dérive du latin « caesius », ce qui signifie « bleu ciel », attribué du fait de la couleur bleu clair des deux lignes caractéristiques de son spectre d'émission[9].
La présence du césium a été décelée en 1860 par Robert Wilhelm Bunsen et Gustav Robert Kirchhoff par spectroscopie de l'eau minérale de Dürkheim[10]. Quelques mois après ils découvrirent le rubidium de la même façon.
Isotopes du césium
Le césium possède 40 isotopes connus, de nombre de masse variant entre 112 et 151 et 17 isomères nucléaires. Seul un isotope, 133Cs est stable faisant du césium un élément monoisotopique. Cet isotope étant également le seul présent dans la nature, il fait du césium un élément mononucléidique, ce qui permet de lui attribuer une masse atomique standard de Standard 132,9054519(2) u.
Le césium 135 a une période radioactive de 2,3 millions d’années et fait partie des déchets radioactifs à vie longue.
L'isotope radiogénique 137Cs (l'un des nombreux produits de fission de l'uranium) est le plus connu, car il a été utilisé dans les études hydrologiques et écologiques à la suite d'une contamination générale de l'atmosphère induite, à partir de 1945, par l'utilisation des bombes atomiques et des essais nucléaires (puis l'accident de Tchernobyl), et, dans une moindre mesure, à cause des rejets de centrales nucléaires ou de sites de retraitement, stockage, etc. Son suivi a par exemple permis de mesurer à quelle vitesse l'eau des nappes se renouvelait, la cinétique environnementale du césium (notamment dans la chaîne alimentaire) ou si une grotte était ou non isolée du monde extérieur. Il a une période radioactive de 30,15 ans. Il se désintègre en baryum 137m (de courte période radioactive), puis en une forme de baryum non radioactif.
Les déchets radioactifs, les retombées d'essais nucléaires atmosphériques ou de l'accident de Tchernobyl peuvent contenir du césium 135 à très longue période radioactive, du césium 134 (période de 2 ans), et du césium 137 (période de 30 ans).
Gisements
La demande mondiale est de moins de 25 000 kilogrammes par an et les réserves suffisent pour des millénaires[10].
Plusieurs gisements sont connus: Bikita, Zimbabwe (Bikita Minerals, 2004) Karibib Desert, Namibia. Afghanistan (Orris and Bliss, 2002, p. 10), Brazil (Quemeneur and Lagache, 1999), India (Chandrasekharam, 2000), Italy (Roskill Information Services Ltd., 1984, p. 12), Sweden (Roskill Information Services Ltd., 1984, p. 14), Tibet (Mianping and others, 1995), United States (Burt, 1993, p. 759), Maine (Sundelius, 1963, p. 94) South Dakota (Strod, 1957). Spain (Solid Resources Ltd., 2004) Chile (Sociedad Química y Minera de Chile, 2004) Canada (Pakeagama pegmatite) (Cumming, 1999) et Bernic Lake[11] au Manitoba.
Les deux tiers des réserves mondiales sont à Bernic Lake au Manitoba, une mine de pegmatite granitique dans une amphibolite exploitée par Tanco[12] située environ 180 km à l’est-nord-est de Winnipeg, près de la frontière Manitoba–Ontario.
Utilisation
- Forage : Le formiate de césium saturé dans l’eau est thermiquement stable, stable à la pression, et assez dense (2,3 g·cm−3) pour que certains sédiments y flottent. Le formiate de césium permet de produire une boue de forage plus dense (inventée au début des années 1990), qui peut être injectée dans le tube d’un forage profond afin de mieux contrebalancer la pression hydrostatique du fond du puits ce qui facilite l’injection et contrôle la remontée des fluides naturels. Ainsi un fluide plus dense qui remonte autour du tube entraîne plus facilement les roches broyées vers la surface. C'est ainsi qu'ont été forés les puits du plus gros projet mondial de forage pétrolier et gazier au monde, en mer du nord, dans le champ pétrolier et gazier d'Elgin-Franklin-Glenelg[13]
- Centrifugation : Les sels de césium donnent des solutions aqueuses denses. On les met dans le fond des éprouvettes de centrifugation, surmontées du mélange à séparer et parfois d’une solution moins dense au-dessus. Un gradient de densité se forme et lors de la centrifugation les composants du mélange se séparent selon leur niveau de densité.
- Horloge atomique : l'isotope stable 133Cs permet d'obtenir une exactitude de 2×10-14 (soit une seconde sur 1 600 000 ans). La seconde est définie depuis 1967 comme la durée de 9 192 631 770 périodes de la radiation correspondant à la transition entre deux niveaux hyperfins de l'état fondamental de l'atome de césium 133.
- Photomultiplicateurs : ces tubes à vide utilisent l'émission par une photocathode, puis la multiplication d'électrons par une succession d'électrodes (dynodes) - jusqu'à 12 ou 14. La photocathode comprend souvent des composés de césium, notamment dans l'infrarouge. Par rapport aux détecteurs à semi-conducteurs, le photomultiplicateur est beaucoup plus encombrant et délicat à utiliser.
- L'isotope 137Cs est utilisé :
- dans les laboratoires d'étude de la physique, comme source de radioactivité pour les Compteurs de Radioactivité Beta (C.R.A.B.) qui comptent les impulsions correspondant au nombre de désintégrations de noyaux de césium 137, lors d'expériences visant à démontrer l'aspect aléatoire de la désintégration radioactive.
- comme indicateur de retombées d'essais nucléaires, d'accidents de l'industrie nucléaire, dont de fuite des centrales nucléaires ; il a par exemple été libéré, entre autres éléments radioactifs, en quantités importantes lors des essais nucléaires atmosphériques au début des années 1960, puis lors des accidents toujours en cours de Tchernobyl et de Fukushima.
- en médecine, comme source de rayonnement radioactif pour traiter le cancer du col de l'utérus et le cancer de la vessie.
- Le chlorure de césium est désormais utilisé comme remède en médecine alternative. Cette utilisation fait suite à la théorie faisant un lien entre la progression des métastases cancéreuses et le pH intracellulaire. Ainsi, cet élément alcalin pénètre la cellule cancéreuse par la Na+/K+-ATPase et bloque le glucose tentant d'entrer par la membrane plasmique. La dose journalière est de 0,5 à 3 grammes de chlorure de césium en solution afin de créer l'effet de saturation létal aux cellules fermentatrices cancéreuses.[réf. nécessaire]. Cela peut amener des troubles cardiaques et n’est pas efficace contre le cancer[14].
Comportement du césium dans l'environnement
La cinétique des isotopes du césium (radioéléments) dans l'environnement est étudiée depuis les retombées des essais nucléaires et avec plus d'intérêt depuis la catastrophe de Tchernobyl.
Interactions avec les matériaux de construction
Les ions césium apportés par l'eau (pluie, lessivage, immersion, etc) peuvent être intégrés dans certains matériaux poreux (brique…) ou s'adsorber sur les mortiers, ciments, bétons.
Le césium en solution aqueuse s'adsorbe plus ou moins rapidement selon la température, le temps de contact et la teneur de la solution en césium, d'une manière relativement bien corrélée au modèle isotherme d'adsorption de Freundlich[15]. L'interaction principale entre l'ion césium et le ciment est l'adsoprtion (de 0,0395 à 22,34 μg.cm-2 pour une solution de 0,0069 à 8,837 mg.L-1). Plus la température élevée, plus cette adsorption est rapide.
Décontamination, extraction sélective
Après la catastrophe de Fukushima, pour décontaminer les sols et parois de béton (ou d'asphalte) des zones les plus radioactives de la centrale et des environs proches, un robot hydrodécapeur spécial à très très haute pression a été mis au point ; il arrache littéralement la peinture et la surface des ciments. L'opérateur doit ensuite récupérer et traiter les résidus aqueux.
Des progrès ont été expérimentalement faits dans les années 2000 concernant l'extraction sélective par solvant du 137Cs et 90Sr[16], dont par le Calix[4]arene-crown-6[17], ce qui pourrait contribuer à réduire la radioactivité de certains déchets nucléaires (tout en augmentant celle du résidu).
Dans le sol et la strate herbacée
Dans les sols argileux, le radiocésium est fortement absorbé dans les argiles pures du sol. Il est alors peu mobile et ne contamine pas les eaux profondes ou superficielles (hormis en présence d'érosion).
Il est par contre beaucoup plus biodisponible dans la couche humique ou argilo-humique[18],[19] ,[20], où il peut être mobilisé (absorbé) par les racines et les rhizomes de certaines plantes, et éventuellement concentré (fougères par exemple). Les mycéliums des champignons peuvent aussi l'absorber, dont ceux de champignons à fructification souterraine (truffes, truffe du cerf en particulier) qui peuvent le concentrer ou également le véhiculer via la rhizosphère et les mycorhizes vers les plantes.
L'INRA de Montpellier a tenté de modéliser la circulation du césium via les plantes et le sol dans les années 1990, sur la base de données montrant que le taux et la vitesse d'absorption par les plantes dépendaient des espèces considérées, mais aussi de la concentration en potassium du sol, de la densité racinaire et de la distribution profonde des racines.
La présence de matière organique dans l'argile diminue la fixation du césium dans le sol et favorise son transfert vers la plante (jusqu'à 90 % en plus). Siobhan Staunton de l'INRA (ENSAM) notait néanmoins en 1996[21] qu'une grande part du césium pompé par la plante est excrétée et non transférée vers les parties supérieures. Peu après une pollution de surface, ce sont les plantes à racines superficielles qui sont contaminées, puis, 10 à 20 ans après en moyenne, ce sont les plantes se nourrissant plus profondément ou certains champignons.
On ignore encore si les arbres seront concernés après quelques décennies ou quelques siècles, et combien de temps les sangliers resteront contaminés.
C'est dans les écosystèmes forestiers que le césium 137 se montre le plus durablement présent (il y est moins lessivé), biodisponible et localement en voie de concentration (dans les régions où il a plu lors du nuage de Tchernobyl, les sols forestiers sont devenus le principal stock de césium, et notamment dans les creux et en montagne en pied de versant où il a pu s'accumuler au point d'y voir la radioactivité augmenter malgré la période radioactive du césium) [22]. Le césium est invisible, mais les analyses faites depuis 1986 montrent une gamme d'effets insidieux de contamination, avec un « degré exceptionnellement élevé de transfert de radiocésium dans les produits forestiers comme le gibier et certains produits végétaux comestibles »[22].
Dans la pyramide alimentaire
Pour les raisons décrites ci-dessus, au sein des réseaux trophiques forestiers, les animaux consommant certaines racines, rhizomes et tubercules et surtout des champignons peuvent durablement se contaminer.
Plusieurs études laissent penser que le sanglier serait l'animal le plus vulnérable à la bioaccumulation, en raison de son comportement de mycophage fouisseur. Par exemple, dans les zones contaminées du sud et sud/ouest de l'Allemagne, dans les 20 ans qui ont suivi les retombées de l'accident de Tchernobyl, la radioactivité moyenne de la viande de chevreuil a régulièrement diminué, mais non celle du sanglier qui est resté constante, malgré le fait que la radioactivité ambiante moyenne diminuait aussi[23]. Ainsi trouvait-on encore en Allemagne en 2008 des sangliers dont la chair dépassait plusieurs milliers de Bq/kg. Durant 10 ans (de 1998 à 2008), les analyses de 656 sangliers tués par des chasseurs dans les bois de l'Arrondissement de Ravensbourg (sud de l'Allemagne, à la frontière suisse) ont montré une très forte variabilité des teneurs en 137Cs, s'échelonnant de moins de 5 Bq/kg à 8 266 Bq/kg (soit plus de 13 fois le seuil légal pour la consommation), avec - (comme partout où ce type d'analyse a été fait) une tendance saisonnière (expliquée par les changements saisonniers de choix alimentaires, la fourniture d'agrainage en hiver, les conditions météorologiques, et peut-être un comportement particulier du césium chez le sanglier…)[23].
Les valeurs de tag (Aggregated transfer factor) pour les sangliers de la région de Ravensburg ont varié de 0 008 m2kg-1 à 0 062 m2kg-1 pour la période 2000 - 2008[23].
Cinétique dans l'organisme humain
Sur le long terme, la contamination se fait surtout par ingestion et absorption gastro-intestinale. Le césium est ensuite transporté par le sang et tend à se fixer à la place de son analogue chimique, le potassium.
Toxicité du césium 137
Pour le 137Cs, les effets des fortes doses ont été étudiés, mais les effets des faibles doses et des expositions chroniques étaient mal documentés. L'étude des conséquences de Tchernobyl a permis de montrer que :
- La charge corporelle en 137Cs est corrélée avec celle de l'alimentation[24].
- En zone contaminée, le lait maternel contient du 137Cs, et celui-ci passe dans le sang et l'organisme du nouveau-né[25],[26]. En zone contaminée de Biélorussie, la part du 137Cs ingéré par une mère transférée au bébé allaité est d'environ 15 %[27].
- Il existe une corrélation entre charge corporelle en césium et dérèglement de l'immunité humorale et cellulaire, selon une étude portant sur des enfants vivant en zone contaminée[28]. Le césium peut contaminer le lait maternel et avoir des effets délétères chez l'enfant[29].
- Y. I. Bandazhevsky et d'autres ont plusieurs années après l'accident détecté une augmentation des pathologies cardiovasculaires[30].
- Une radiotoxicité est démontrée pour le foie[31] et le rein[32], ce qui explique probablement les troubles du métabolisme de la vitamine D associés à de faibles doses de 137Cs (également observé chez le rat exposé au 137Cs en laboratoire). Ces troubles pourraient augmenter le risque de rachitisme et de défaut de la minéralisation (problèmes osseux, dentaires..)[33]. Chez le rat, alors que les faibles doses semblent sans effet sur le squelette de l'adulte, une contamination in utero des embryons, via une exposition chronique de la mère (à de faibles doses) durant la grossesse semble perturber le métabolisme de la vitamine D, tant au niveau hormonal que moléculaire et contrairement à ce qui avait été observé chez le modèle adulte, des troubles de la calcification du squelette sont observés[34].
Traitement des intoxications au césium
Le bleu de Prusse pris par la bouche absorbe le césium et le thallium dans le tube digestif, puis est éliminé dans les selles qu’il colore en bleu très foncé. Le césium et le thallium sont alors insolubles et non disponibles pour les plantes et les autres organismes vivants, ce qui réduit leurs impacts écologiques.
Mesures de la pollution de l'environnement
- L'institution japonaise l'AIST (Institut national de science industrielle avancée et de la technologie) a développé la mesure de la contamination de l'eau et des sols par l'isotope radiogénique césium après l'accident nucléaire de Fukushima au Japon le 11 mars 2011[35],[36],[37]. Le développement avec le bleu de Prusse a débuté en 2005[35].
Références
- 1 2 3 4 (en) David R. Lide, CRC Handbook of Chemistry and Physics, CRC Press Inc, , 90e éd., Relié, 2804 p. (ISBN 978-1-420-09084-0)
- ↑ Base de données Chemical Abstracts interrogée via SciFinder Web le 15 décembre 2009 (résultats de la recherche)
- ↑ (en) Beatriz Cordero, Verónica Gómez, Ana E. Platero-Prats, Marc Revés, Jorge Echeverría, Eduard Cremades, Flavia Barragán et Santiago Alvarez, « Covalent radii revisited », Dalton Transactions, , p. 2832 - 2838 (DOI 10.1039/b801115j)
- ↑ (en) David R. Lide, CRC Handbook of Chemistry and Physics, CRC, , 89e éd., p. 10-203
- 1 2 Entrée de « Caesium » dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 29 mars 2011 (JavaScript nécessaire)
- 1 2 SIGMA-ALDRICH
- ↑ « Césium » dans la base de données de produits chimiques Reptox de la CSST (organisme québécois responsable de la sécurité et de la santé au travail), consulté le 25 avril 2009
- ↑ La ligature æ, sous cette graphie, est obligatoire.
Article « cæsium », Dictionnaire de définitions, Antidote 8, version 2, [Logiciel], Montréal, Druide informatique, 2012. - ↑ Image des Raies spectrales d'émission du césium. Voir juste ici à droite :
- 1 2 http://pubs.usgs.gov/of/2004/1432/2004-1432.pdf
- ↑ http://rruff.info/doclib/cm/vol38/CM38_877.pdf
- ↑ http://www.cabot-corp.com/wcm/download/en-us/sp/TANCO1.pdf
- ↑ B.L. Fitzgerald, A.J. McCourt ( Baroid Drilling Fluids) ; M. Brangetto (ELF Exploration UK plc), “Drilling Fluid Plays Key Role in Developing the Extreme HTHP, Elgin/Franklin Field” ; Society of Petroleum Engineers Doi:10.2118/59188-MS ; Conference Paper : IADC/SPE Drilling Conference, 23-25 February 2000, New Orleans, Louisiana ; ISBN 978-1-55563-353-0 (résumé)
- ↑ http://www.pharmacorama.com/ezine/20090921153409.php
- ↑ Konstantin Volchek; Muhammed Yusuf Miah; Wenxing Kuang; Zack DeMaleki; F. Handan Tezel (2011) Adsorption of cesium on cement mortar from aqueous solutions ; Journal of Hazardous Materials (October 2011), 194, Complete, pg. 331-337 (résumé)
- ↑ Chao Xu; Jianchen Wang; Jing Chen (2012), "Solvent Extraction of Strontium and Cesium: A Review of Recent Progress" ; Solvent Extraction and Ion Exchange (October 2012), 30 (6), pg. 623-650 (résumé)
- ↑ J.-F. Dozol, V. Lamare, N. Simon, R. Ungaro, and A. Casnati (2000) Extraction of Cesium by Calix[4]arene-crown-6: From Synthesis to Process 757 (), 12-25
- ↑ Fielitz, U.: Überprüfung von Ökosystemen nach Tschernobyl hinsichtlich der Strahlenbelastung der Bevölkerung, 2001 ; Forschungsvorhaben StSch 4206 im Auftrag des BUNR. 65 S.
- ↑ Hecht, H. & K.O. Honikel, adiocäsium in Wald und Wild (Hsg.), 1997, 2. Veranstaltung, Bundesanstalt für Fleischforschung, Kulmbach
- ↑ Haffelder, M. Radiocäsium in Waldökosystemen des Hinteren Bayrischen Waldes nach dem Reaktorunfall von Tschernobyl unter besonderer Berücksichtigung der Äsungspflanzen des Schalenwildes, 1995, Diss. Uni. Ulm. S. 178
- ↑ Paris, Le sol, un patrimoine menacé ? Le point scientifique, Congrès : Forum, Paris, 24 octobre 1996
- 1 2 George Shaw, Radionuclides in forest ecosystems ; Radioactivity in the Environment Volume 10, 2007, Pages 127-155 ; Radioactivity in the Terrestrial Environment doi:10.1016/S1569-4860(06)10006-6 (Résumé et 1re page. En ligne : 22 mars 2007)
- 1 2 3 Tatiana Semizhon, Victoria Putyrskaya, Gregor Zibold, Eckehard Klemt, Time-dependency of the 137Cs contamination of wild boar from a région in Southern Germany in the years 1998 to 2008 ; Journal of Environmental Radioactivity Volume 100, Issue 11, November 2009, Pages 988-992 doi:10.1016/j.jenvrad.2009.06.023
- ↑ Handl, J., D. Beltz, W. Botsch, S. Harb, D. Jakob, R. Michel, and L. D. Romantschuk. 2003. Evaluation of radioactive exposure from 137Cs in contaminated areas of Northern Ukraine. Health Phys 84:502-17
- ↑ Johansson, L., A. Björeland, and G. Agren. 1998. Tranfer of 137Cs to infants via human breast milk. Radiat Prot Dosimetry 79:165-67.
- ↑ Thornberg, C., and S. Mattsson. 2000. Increased 137Cs metabolism during pregnancy. Health Phys 78:502-6.
- ↑ Johansson, L., A. Björeland, and G. Agren. 1998. Tranfer of 137Cs to infants via human breast milk. Radiat Prot Dosimetry 79:165-67.
- ↑ Titov, L. P., G. D. Kharitonic, I. E. Gourmanchuk, and S. I. Ignatenko. 1995. Effects of radiation on the production of immunoglobulins in children subsequent to the Chernobyl disaster. Allergy Proc 16:185-93.
- ↑ Document de 6 pages intitulé "Effets du césium 137 sur le métabolisme de la Vitamine D3 (ou Cholécalciférol) après une contamination chronique via le lait maternel", Émilie Tissandié, 3e année de thèse (Thèse : Effets des radionucléides sur le métabolisme de la vitamine D3 chez le rat)
- ↑ Bandazhevskaya, G. S., V. B. Nesterenko, V. I. Babenko, T. V. Yerkovich, and Y. I. Bandazhevsky. 2004. Relationship between caesium (137Cs) load, cardiovascular symptoms, and source of food in 'Chernobyl' children -- preliminary observations after intake of oral apple pectin. Swiss Med Wkly 134:725-9.
- ↑ Stojadinovic, S., and M. Jovanovic. 1966. Activity of transaminases in the rat serum after internal contamination with 137Cs and 90Sr. Strahlentherapie 131:633-6.
- ↑ Nikula, K. J., B. A. Muggenburg, W. C. Griffith, W. W. Carlton, T. E. Fritz, and B. B. Boecker. 1996. Biological effects of 137CsCl injected in beagle dogs of different ages. Radiat Res 146:536-47.
- ↑ Tissandié, E., Y. Gueguen, J. M. Lobaccaro, J. Aigueperse, P. Gourmelon, F. Paquet, and M. Souidi. 2006a. Chronic contamination with 137Cesium affects Vitamin D3 metabolism in rats. Toxicology 225:75-80.
- ↑ Document déjà cité d'Emilie Tissandié, intitulé "Effets du césium 137 sur le métabolisme de la Vitamine D3 après une contamination chronique via le lait maternel", page 5-6.
- 1 2 (ja) « プルシアンブルーを利用して多様な形態のセシウム吸着材を開発 –汚染水や土壌などさまざまな環境に適用可能– », sur AIST,
- ↑ (ja) « 土壌中のセシウムを低濃度の酸で抽出することに成功 –プルシアンブルーナノ粒子吸着材で回収し放射性廃棄物の大幅な減量化へ– », sur AIST,
- ↑ (en) Shinichi Saoshiro, « New Japan method eyed to remove radiation from soil », sur Reuters, Edwina Gibbs,
Voir aussi
- Essai nucléaire
- Catastrophe de Tchernobyl
- Radioactivité
- Toxicologie nucléaire
- Césium 137
Bibliographie
- (en) F.S. Messiha (1984), Cesium: A bibliography update ; Pharmacology Biochemistry and Behavior (January 1984), 21, Supplement 1, pg. 113-129
Liens externes
- (en) Réaction d'un mélange de césium & d'eau en vidéo
- (en) Toxicological Profile for Cesium, ATSDR, U.S. Department of Health and Human Services.
- (en) Images du césium sous différentes formes
Images (le césium et un de ses minerais)

usgov.jpg)
| s1 | s2 | g | f1 | f2 | f3 | f4 | f5 | f6 | f7 | f8 | f9 | f10 | f11 | f12 | f13 | f14 | d1 | d2 | d3 | d4 | d5 | d6 | d7 | d8 | d9 | d10 | p1 | p2 | p3 | p4 | p5 | p6 | |
| 1 | H | He | |||||||||||||||||||||||||||||||
| 2 | Li | Be | B | C | N | O | F | Ne | |||||||||||||||||||||||||
| 3 | Na | Mg | Al | Si | P | S | Cl | Ar | |||||||||||||||||||||||||
| 4 | K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | |||||||||||||||
| 5 | Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | |||||||||||||||
| 6 | Cs | Ba | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn | |
| 7 | Fr | Ra | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Uut | Fl | Uup | Lv | Uus | Uuo | |
| 8 | Uue | Ubn | * | Ute | Uqn | Uqu | Uqb | Uqt | Uqq | Uqp | Uqh | Uqs | Uqo | Uqe | Upn | Upu | Upb | Upt | Upq | Upp | Uph | Ups | Upo | Upe | Uhn | Uhu | Uhb | Uht | Uhq | Uhp | Uhh | Uhs | Uho |
| ↓ | |||||||||||||||||||||||||||||||||
| g1 | g2 | g3 | g4 | g5 | g6 | g7 | g8 | g9 | g10 | g11 | g12 | g13 | g14 | g15 | g16 | g17 | g18 | ||||||||||||||||
| * | Ubu | Ubb | Ubt | Ubq | Ubp | Ubh | Ubs | Ubo | Ube | Utn | Utu | Utb | Utt | Utq | Utp | Uth | Uts | Uto | |||||||||||||||
| Métalloïdes | Non-métaux | Halogènes | Gaz rares |
| Métaux alcalins | Métaux alcalino-terreux | Métaux de transition | Métaux pauvres |
| Lanthanides | Actinides | Superactinides | Éléments non classés |
- Portail de la chimie

