
Plomb (II) nitrate
?? propos de ce ??coles s??lection Wikipedia
Cette s??lection de wikipedia a ??t?? choisi par des b??n??voles aidant les enfants SOS de Wikipedia pour cette s??lection Wikipedia pour les ??coles. Une bonne fa??on d'aider d'autres enfants est de parrainer un enfant
| Plomb (II) nitrate | |
|---|---|
 | |
 | |
Plomb (II) nitrate | |
Autres noms Nitrate de plomb | |
| Identificateurs | |
| Num??ro CAS | 10099-74-8 |
| Num??ro RTECS | OG2100000 |
| Propri??t??s | |
| Formule mol??culaire | Pb (NO 3) 2 |
| Masse molaire | 331,2 g / mol |
| Apparence | Solide blanc inodore |
| Densit?? | 4,53 g / cm?? |
| Point de fusion | Se d??compose ?? 290-470 ?? C |
| Solubilit?? dans l'eau | 52 g / 100 ml (20 ?? C) |
| Solubilit?? dans l'acide nitrique dans l'??thanol dans du methanol | insoluble 1 g / ml 2500 1 g / 75 ml |
| Structure | |
| Crystal structure | Cubique ?? faces centr??es |
| Coordination g??om??trie | cuboctahedral |
| Risques | |
| FS | MSDS externe |
| Indice de l'UE | 082-001-00-6 |
| Classification UE | Toxique (T) Dangereux pour l'environnement (N) Repr. 1/3 |
| Phrases-R | R61, R20 / 22, R33, R62, R50 / 53 |
| Phrases S | S53, S45, S60, S61 |
| NFPA 704 |  0 3 3 OX |
| Point d'??clair | Ininflammable |
| Des compos??s apparent??s | |
| D'autres anions | Plomb (II) chromate Plomb (II) de sulfure |
| D'autres cations | Le nitrate de sodium Le nitrate de magn??sium |
| Des compos??s apparent??s | L'oxyde de plomb (II) Acide nitrique |
| Page de donn??es suppl??mentaire | |
| Structure et propri??t??s | n, ε r, etc. |
| Thermodynamique donn??es | comportement de phase Solide, liquide, gaz |
| Les donn??es spectrales | UV, IR, RMN , MS |
| Sauf indication contraire, les donn??es sont donn??es pour le mat??riel dans leur ??tat standard (?? 25 ?? C, 100 kPa) | |
| R??f??rences d'Infobox | |
Plomb (II) nitrate est un compos?? inorganique avec la formule chimique Pb ( NO 3) 2. Il se produit g??n??ralement comme incolore cristal ou poudre blanche et, contrairement ?? la plupart des autres de plomb (II) des sels , est soluble dans l'eau .
Connu depuis les Moyen Age par l'dulcis nom d'aplomb, la production de plomb (II) nitrate de soit m??tallique plomb ou l'oxyde de plomb dans l'acide nitrique ??tait ?? petite ??chelle, pour une utilisation directe dans la fabrication d'autres des compos??s de plomb. En t??te du 19??me si??cle (II) nitrate a commenc?? ?? ??tre produit commercialement en Europe et aux ??tats-Unis. Historiquement, la principale utilisation est en tant que mati??re premi??re dans la production de pigments pour peintures au plomb, mais ces peintures ont ??t?? remplac??es par des peintures moins toxiques ?? base de dioxyde de titane. Autres usages industriels inclus chaleur stabilisation nylon et des polyesters, et dans des rev??tements de papier photothermographique. Depuis autour de l'ann??e 2000, le plomb (II) nitrate a commenc?? ?? ??tre utilis?? dans cyanuration de l'or.
Plomb (II) nitrate est toxique, un agent oxydant, et est class?? comme probablement canc??rog??ne pour les humains par le Centre international de recherche sur le cancer. Par cons??quent, il doit ??tre manipul??e et stock??e avec les mesures de s??curit?? appropri??es pour ??viter l'inhalation, l'ingestion et contact avec la peau. En raison de sa nature dangereuse, les applications limit??es de plomb (II) nitrate sont sous surveillance constante.
Histoire
Depuis le Moyen Age, le plomb (II) nitrate a ??t?? produit comme mati??re premi??re pour la production de pigments color??s dans les peintures au plomb, tels que jaune de chrome (plomb (II) de chromate), orange de chrome (plomb (II) chromate hydroxyde) et similaires des compos??s de plomb. Ces pigments ont ??t?? utilis??s pour teinture et l'impression calicot et d'autres textiles.
En 1597, l'Allemand alchimiste Andreas Libavius d'abord d??crit le compos??, frappe les noms m??di??vales de aplomb dulcis et chaux aplomb dulcis, qui signifie ??plomb douce", en raison de son go??t. Bien qu'?? l'origine pas compris pendant les si??cles suivants, le propri??t?? d??cr??pitation de plomb (II) nitrate conduit ?? son utilisation dans des matchs et sp??ciale explosifs tels que l'azoture de plomb.
Le processus de production a ??t?? et est encore chimiquement simple, efficace dissolution du plomb dans l'eau-forte ( acide nitrique ), et par la suite la r??colte pr??cipiter. Cependant, la production est rest??e ?? petite ??chelle pendant de nombreux si??cles, et la production commerciale de plomb (II) nitrate comme mati??re premi??re pour la fabrication d'autres compos??s de plomb n'a pas ??t?? signal?? jusqu'en 1835. En 1974, l' US la consommation de compos??s de plomb, ?? l'exclusion des pigments et des additifs d'essence, ??tait de 642 tonnes.
Chimie
La chimie aqueuse
Plomb (II) nitrate facilement dissout dans l'eau pour donner une solution limpide, incolore. Comme substance ionique, la dissolution du plomb (II) nitrate implique dissociation en ses ions constitutifs.
- Pb (NO 3) 2 ( s ) → Pb 2+ ( aq) + 2 NO 3 - (aq)
Toute solution sera contenant le plomb (II) r??agir avec un cation contenant la solution anion iodure pour produire un pr??cipit?? du jaune orang?? vif plomb (II) d'iodure. Cette r??action est souvent utilis?? pour d??montrer les pr??cipitations, en raison du changement de couleur frappante observ??e, sous le nom de Pot-o-Or ou Golden Rain:
- Pb 2+ (aq) + 2 I - (aq) → PbI 2 (s)
Similaire r??actions de m??tath??se ont lieu dans la phase solide lors de solides appropri??s, tels que l'iodure de potassium et le plomb (II) nitrate, on m??lange et broie finement en utilisant un mortier et un pilon.
- Pb (NO 3) 2 (s) + 2 KI (s) PbI 2 → (s) + 2 KNO 3 (s)
La couleur du m??lange r??sultant d??pend de la quantit?? relative de la des r??actifs utilis??s, et le degr?? de broyage; en tout ??tat de cause, la couleur sera plus p??le que celle du plomb (II) d'iodure pur d?? ?? la pr??sence de solides blancs dans le m??lange.
En dehors de plomb (II) nitrate, plomb (II) ac??tate est le seul autre compos?? de plomb soluble commun. Presque tous les autres compos??s de plomb sont insolubles dans l'eau, m??me lorsqu'il est coupl?? avec des anions couramment tr??s solubles. Par exemple, plomb (II) chlorure, le bromure de plomb (II) et plomb (II) d'iodure, collectivement connu sous le nom de plomb halog??nures, ne sont que faiblement solubles dans l'eau (moins de 0,01 mol / l) ?? la temp??rature ambiante, et seulement l??g??rement plus proche du point d'??bullition. Cela signifie que le plomb (II) nitrate a une importance particuli??re en tant que point de d??part pour la production de compos??s de plomb insolubles par double d??composition.
Hot solutions d'halog??nures de plomb peuvent ??tre port??es ?? la pr??cipitation par le refroidissement de cr??er plumeux, cristaux iris??s suspension dans l'eau, dont la couleur cristal d??pend de l'halog??nure particulier (chlorure = blanc, le bromure = buff, iodure = jaune). Ces cristaux apparaissent soudainement, ne n??cessitant qu'une nucl??ation site une fois que la temp??rature de la solution a diminu?? suffisamment pour que la solution soit sursatur??e. Cet effet est utilis?? pour la d??monstration de la solubilit?? dans les salles de classe.
Lorsque concentr??e d'hydroxyde de sodium est ajout?? ?? une solution plomb (II) une solution de nitrate, nitrates de base sont form??es, m??me bien apr??s la point d'??quivalence. Jusqu'?? la moiti?? par le point d'??quivalence, Pb (NO 3) 2 ?? Pb (OH) 2 pr??domine, puis apr??s ce point Pb (NO 3) 2 ?? 5PB (OH) 2 est form??. Aucune simples Pb (OH) 2 est form?? ?? au moins pH 12.
Crystal structure
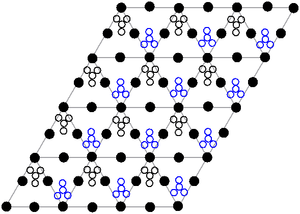
Le Structure de cristal de plomb solide (II) nitrate a ??t?? d??termin??e par diffraction de neutrons. Le compos?? cristallise dans le syst??me cubique, avec les atomes de plomb dans un ?? faces centr??es syst??me cubique. Son groupe d'espace est Pa3 Z = 4 ( Bravais de notation de maille), avec chaque face du cube de longueur 784 picom??tres.
Les points noirs repr??sentent les atomes de plomb, les points blancs les groupes nitrate 27 picom??tres-dessus du plan des atomes de plomb, et les points bleus les groupes nitrate ?? la m??me distance au-dessous de ce plan. Dans cette configuration, chaque atome de plomb est li?? ?? douze atomes d'oxyg??ne ( longueur de la liaison: 281 h). Toutes les longueurs N-O obligataires sont identiques, ?? 127 picom??tres.
Int??r??ts de recherche dans la structure de cristal de plomb (II) nitrate reposait en partie sur la possibilit?? de rotation interne libre des groupes de nitrate dans le r??seau cristallin ?? des temp??ratures ??lev??es, mais cela ne se est pas concr??tis??.
Complexation
Plomb (II) nitrate int??ressante est associ??e ?? chimie supramol??culaire en raison de sa la coordination de l'azote et de l'oxyg??ne des compos??s donneurs d'??lectrons. L'int??r??t est en grande partie th??orique, mais avec plusieurs applications potentielles. Par exemple, en combinant le nitrate de plomb et penta??thyl??neglycol (EO 5) dans une solution de l'ac??tonitrile et du methanol puis lentement ??vaporation produit un nouveau mat??riau cristallin [Pb (NO 3) 2 (EO 5)]. Dans la structure cristalline de ce compos??, la cha??ne EO 5 est enroul?? autour de l'ion de plomb dans un plan ??quatorial similaire ?? celui d'une ??ther couronne. Les deux nitrate bident?? les ligands sont en configuration trans. Le total nombre de coordination est de 10, avec l'ion de plomb dans un bicouronn?? antiprisme carr?? g??om??trie mol??culaire.
Le complexe form?? par le plomb (II) nitrate, plomb (II) et un perchlorate ligand bident?? N-bithiazole donneur est binucl??aire, par un groupe pontant les atomes nitrate de plomb avec un nombre de coordination de 5 et 6. Un aspect int??ressant de ce type de complexes est la pr??sence d'un espace physique dans le sph??re de coordination; ce est ?? dire, les ligands ne sont pas plac??s de fa??on sym??trique autour de l'ion m??tallique. Ce est potentiellement due ?? un plomb seule paire d'??lectrons, ??galement trouv?? dans les complexes de plomb avec un ligand imidazole.
Ce type de chimie ne est pas unique pour le sel de nitrate; autres plomb (II) des compos??s tels que plomb (II) forment ??galement des complexes bromure, le nitrate, mais est souvent utilis?? en raison de ses propri??t??s de solubilit?? et sa nature bidentate.
L'oxydation et la d??cr??pitation
Plomb (II) nitrate est un agent oxydant. En fonction de la r??action, cela peut ??tre d?? au Pb 2+ (aq) ion, qui a un ??cart potentiel de r??duction (E 0) de -0,125 V, ou l'ion nitrate, dans des conditions acides qui poss??de un E 0 de 0,956 V.
Lorsqu'il est chauff??, le plomb (II) des cristaux de nitrate ?? d??composer plomb (II) oxyde, le dioxyg??ne et le dioxyde d'azote, accompagn?? par un bruit de craquement. Cet effet est appel?? d??cr??pitation.
En raison de cette propri??t??, le nitrate de plomb est parfois utilis?? dans pyrotechniques tels que feux d'artifice.
Pr??paration et la production
Plomb (II) nitrate ne se produit pas naturellement. Le compos?? peut ??tre obtenu par dissolution m??tallique de plomb dans une solution aqueuse d'acide nitrique :
- Pb 3 (s) + 8 H + (aq) + 2 NO 3 - (aq) → 3 Pb 2+ (aq) + 2 NO (g) + 4H 2 O (l)
Plus commun??ment, le plomb (II) nitrate est obtenu par dissolution plomb (II) oxyde, qui est facilement disponible en tant que min??ral , dans l'acide nitrique aqueux:
- PbO (s) + 2 H + (aq) → Pb 2+ (aq) + H 2 O (l)
Dans les deux cas, ??tant donn?? que le solvant est de l'acide nitrique concentr?? (qui contiennent du plomb (II) nitrate a une tr??s faible solubilit??) et la solution r??sultante contient des nitrates , des ions de cristaux anhydres de plomb (II) nitrate former spontan??ment:
- Pb 2+ + 2 NO 3 - → Pb (NO 3) 2 (s)
La plupart disponibles dans le commerce de plomb (II) nitrate, ainsi que mat??riau ??chelle du laboratoire, est produit en cons??quence. L'offre est en sacs de 25 kg jusqu'?? 1000 kg grands sacs, et dans des r??cipients de laboratoire, ?? la fois par les producteurs g??n??rales de produits chimiques de laboratoire et par les producteurs de plomb et des compos??s de plomb. Pas de production ?? grande ??chelle a ??t?? rapport??.
Dans le traitement ?? l'acide nitrique des d??chets contenant du plomb, par exemple, dans le traitement des leaders de bismuth d??chets provenant de raffineries de plomb, de solutions impures de plomb (II) sont r??alis??s sous forme de nitrate sous-produit. Ces solutions sont pr??sent??es pour ??tre utilis?? dans la processus de cyanuration or.
Applications
En raison de la nature dangereuse du plomb (II) nitrate, il existe une pr??f??rence pour l'utilisation dans des applications industrielles alternatives. Dans la majeure anciennement application de peintures au plomb, il a ??t?? largement remplac??e par dioxyde de titane. Autres applications historiques de plomb (II) nitrate, comme dans les matchs et feux d'artifice, ont diminu?? ou cess?? ainsi. Les applications actuelles de plomb (II) nitrate comprennent l'utilisation comme stabilisateur de chaleur en nylon et les polyesters, en tant que rev??tement pour papier photothermographique, et rodenticides.
A l'??chelle du laboratoire, le plomb (II) nitrate fournit l'un des deux sources commodes et fiables de le t??troxyde de diazote. En s??chant soigneusement plomb (II) nitrate et ensuite en le chauffant dans un r??cipient en acier, le dioxyde d'azote est produit avec le dioxyg??ne suivant l'??quation de decripitation ci-dessus. En variante, le dioxyde d'azote est form?? lorsque l'acide nitrique concentr?? est ajout?? ?? des tournures de cuivre ; dans ce cas, le monoxyde d'azote substantielle peut ??galement ??tre produit. Dans les deux cas, le dioxyde d'azote r??sultant existe en ??quilibre avec son dim??re:
- 2 NO 2 ⇌ N 2 O 4
Afin d'??liminer les impuret??s ou l'autre, le m??lange gazeux est condens?? et une distillation fractionn??e pour donner un m??lange de NO 2 et de N 2 O 4. Comme la dim??risation est exothermique, des temp??ratures basses favorisent N 2 O 4 en tant que l'esp??ce dominante.
Pour am??liorer la processus de lixiviation dans le cyanuration de l'or, du plomb (II) une solution de nitrate est ajout??. Bien qu'un processus vrac, que des quantit??s limit??es (de 10 ?? 100 milligrammes de plomb (II) nitrate par kg d'or) est n??cessaire. Tant la cyanuration lui-m??me, ainsi que l'utilisation de compos??s de plomb dans le processus, sont r??put??s controvers??e en raison de la nature toxique des compos??s.
S??curit??
Plomb (II) nitrate est toxique, et l'ingestion peut conduire ?? une intoxication aigu?? par le plomb, comme ce est applicable pour tous les compos??s solubles de plomb. Tous compos??s inorganiques du plomb sont class??s par la Centre international de recherche sur le cancer (CIRC) comme probablement canc??rog??ne pour l'homme (cat??gorie 2A). Ils ont ??t?? li??s ?? le cancer du rein et gliome chez les animaux exp??rimentaux et de cancer du rein, cancer du cerveau et le cancer du poumon chez les humains, bien que des ??tudes sur des travailleurs expos??s au plomb sont souvent compliqu??es par une exposition simultan??e ?? l'arsenic . Le plomb est connu de remplacer le zinc dans un certain nombre de enzymes, y compris δ-aminol??vulinique d??shydratase d'acide (porphobilinog??ne synthase) dans le voie de biosynth??se de l'h??me et pyrimidine-5'-nucl??otidase, important pour le m??tabolisme correcte de l'ADN .
Pour ??viter l'inhalation, l'ingestion et l'exposition de la peau, de plomb (II) nitrate doit ??tre manipul?? dans une sorbonne, avec le visage, le corps et la protection des mains. Des instructions sp??ciales pour la manutention sont inclus dans tous les Fiches de donn??es de s??curit?? (FDS). Apr??s utilisation, tout le mat??riel et de ses contenants doivent ??tre ??limin??s comme d??chets dangereux. D??versement d'rejet dans l'environnement doivent ??tre ??vit??s.

