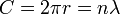Introduction ?? la m??canique quantique
Saviez-vous ...
Enfants SOS b??n??voles ont aid?? ?? choisir des articles et faites autre mat??riel p??dagogique Avant de vous d??cider ?? propos de parrainer un enfant, pourquoi ne pas en apprendre davantage sur diff??rents organismes de parrainage premiers ?
| M??canique quantique |
|---|
 Dualit?? onde-particule |
| Introduction Glossaire ?? Histoire |
Fond
|
Concepts fondamentaux
|
Exp??riences
|
Formulations
|
??quations
|
Interpr??tations
|
Sujets avanc??s
|
Les scientifiques
|

La m??canique quantique (QM, ou la th??orie quantique) est une science physique traiter avec le comportement de la mati??re et de l'??nergie ?? l'??chelle de atomes et subatomiques particules / ondes . QM constitue ??galement la base pour la compr??hension contemporaine de la fa??on dont de tr??s grands objets tels que des ??toiles et des galaxies , et cosmologiques ??v??nements tels que le Big Bang, peut ??tre analys?? et expliqu??. La m??canique quantique est la fondation de plusieurs disciplines connexes, y compris les nanotechnologies, la physique de la mati??re condens??e , chimie quantique , la biologie structurale, la physique des particules , et de l'??lectronique .
Le terme ??m??canique quantique?? a ??t?? invent?? par Max Born en 1924. L'acceptation par la communaut?? de la physique g??n??rale de la m??canique quantique est due ?? sa pr??diction pr??cise du comportement physique des syst??mes, y compris les syst??mes o?? la m??canique newtonienne ??choue. M??me la relativit?? g??n??rale est limit?? de mani??re m??canique quantique ne est pas pour la description des syst??mes ?? l'??chelle atomique ou moins, ?? des ??nergies tr??s basses ou tr??s ??lev??es, ou dans les temp??ratures les plus basses. Gr??ce ?? un si??cle d'exp??rimentation et de science appliqu??e, la th??orie de la m??canique quantique se est av??r??e tr??s fructueuse et pratique.
Vue d'ensemble
Les fondements de la m??canique quantique datent du d??but des ann??es 1800, mais les vrais d??buts de la date de QM des travaux de Max Planck en 1900. Albert Einstein et Niels Bohr vite fait d'importantes contributions ?? ce qu'on appelle maintenant la ??vieille th??orie quantique." Cependant, ce ne est qu'en 1924 qu'un tableau plus complet a ??merg?? avec Louis de Broglie hypoth??se ondes de mati??re et de l'importance r??elle de la m??canique quantique est devenu clair. Certains des plus ??minents scientifiques de contribuer par la suite dans le milieu des ann??es 1920 ?? ce qu'on appelle maintenant les ??nouveaux m??canique quantique" ou "nouvelle physique" ont Max Born, Paul Dirac , Werner Heisenberg, Wolfgang Pauli, et Erwin Schr??dinger. Plus tard, le champ a ??t?? ??largi avec le travail par Julian Schwinger, Sin-Itiro Tomonaga et Richard Feynman pour le d??veloppement de ??lectrodynamique quantique en 1947 et par Murray Gell-Mann en particulier pour le d??veloppement de Chromodynamique quantique.
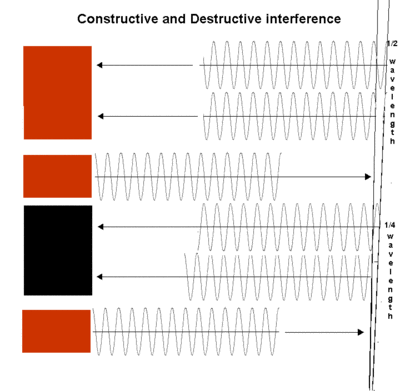
Les premiers chercheurs diff??rent dans leurs explications de la nature fondamentale de ce que nous appelons maintenant rayonnement ??lectromagn??tique . Certains maintenu que d'autres fr??quences de la lumi??re et du rayonnement ??lectromagn??tique sont constitu??s de particules, tandis que d'autres ont affirm?? que le rayonnement ??lectromagn??tique est un ph??nom??ne d'onde. En physique classique ces id??es sont mutuellement contradictoires. Depuis les premiers jours de scientifiques QM ont reconnu que ni id??e en elle-m??me peut expliquer rayonnement ??lectromagn??tique.
En 1690, Christian Huygens a expliqu?? les lois de la r??flexion et de la r??fraction sur la base d'une th??orie de l'onde. Sir Isaac Newton croyait que la lumi??re est compos??e de particules infiniment petites qui il a d??sign?? "corpuscules". En 1827, Thomas Young et Augustin Fresnel a fait des exp??riences sur interf??rence qui a montr?? qu'un la th??orie corpusculaire de la lumi??re ??tait insuffisante. Ensuite, en 1873 James Clerk Maxwell a montr?? qu'en faisant osciller un circuit ??lectrique, il devrait ??tre possible de produire des ondes ??lectromagn??tiques. Sa th??orie a permis de calculer la vitesse d'un rayonnement ??lectromagn??tique sur la seule base de mesures ??lectriques et magn??tiques, et la valeur calcul??e correspond de tr??s pr??s ?? l'empirique mesur??e vitesse de la lumi??re . En 1888, Heinrich Hertz fait un appareil ??lectrique qui effectivement produit ce que nous appellerions aujourd'hui des micro-ondes - essentiellement rayonnement ?? une faible fr??quence que la lumi??re visible. Tout jusqu'?? ce point sugg??r?? que Newton avait ??t?? tout ?? fait tort de consid??rer la lumi??re comme corpusculaire.
Des exp??riences plus r??centes ont indiqu?? que un mod??le de paquet ou quantique a ??t?? n??cessaire pour expliquer certains ph??nom??nes. Lorsque la lumi??re frappe un conducteur ??lectrique, il am??ne les ??lectrons ?? se ??loigner de leurs positions initiales. Le ph??nom??ne observ?? ne pouvait se expliquer en supposant que la lumi??re fournit de l'??nergie dans des paquets pr??cis. Dans un dispositif photo??lectrique comme le posem??tre dans un appareil photo, la lumi??re frappant le d??tecteur m??tallique provoque ??lectrons de se d??placer. Plus grand intensit??s de lumi??re ?? une fr??quence peut causer plusieurs ??lectrons de se d??placer, mais ils ne seront pas aller plus vite. En revanche, plus ??lev??e fr??quences lumineuses peuvent provoquer des ??lectrons de se d??placer plus rapidement. Ergo, l'intensit?? des contr??les l??gers actuelle, mais la fr??quence des contr??les l??gers tension. Ces observations ont soulev?? une contradiction par rapport aux ondes sonores et vagues de l'oc??an, o?? seule l'intensit?? a ??t?? n??cessaire de pr??voir l'??nergie de l'onde. Dans le cas de la lumi??re, la fr??quence semble pr??dire l'??nergie. Quelque chose ??tait n??cessaire pour expliquer ce ph??nom??ne et de concilier les exp??riences qui avaient montr?? la lumi??re d'avoir la nature des particules avec des exp??riences qui avaient montr?? ?? avoir nature ondulatoire.
Malgr?? le succ??s de la m??canique quantique, il a quelques ??l??ments controvers??s. Par exemple, le comportement des objets microscopiques d??crits dans la m??canique quantique est tr??s diff??rent de notre exp??rience quotidienne, ce qui peut provoquer une certaine incr??dulit??. La plupart de la physique classique est maintenant reconnu ??tre compos?? de cas particuliers de la th??orie de la physique quantique et / ou de la th??orie de la relativit??. Dirac a th??orie de la relativit?? ?? porter sur la physique quantique afin qu'il puisse correctement face ?? des ??v??nements qui se produisent ?? une fraction importante de la vitesse de lumi??re. La physique classique, cependant, traite ??galement de l'attraction de masse (gravit??), et personne n'a encore ??t?? en mesure d'apporter gravit?? dans une th??orie unifi??e avec la th??orie quantique relativis??.
Spectroscopie et au-del??
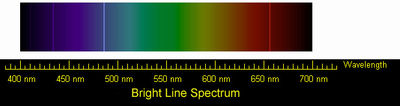
Il est assez facile de voir un spectre produit par une lumi??re blanche quand elle passe ?? travers un prisme, le bord biseaut?? d'un miroir ou une vitre en verre conique, ou ?? travers des gouttes de pluie pour former un arc en ciel. Lorsque les ??chantillons qui sont compos??es exclusivement d'un seul ??l??ment chimique par exemple l'hydrog??ne, sont amen??s ?? ??mettre de la lumi??re, ils peuvent ??mettre de la lumi??re ?? plusieurs fr??quences caract??ristiques. Le profil de fr??quence produit est caract??ristique de cet ??l??ment. Au lieu d'avoir une large bande rempli de couleurs allant du violet au rouge, il y aura des bandes isol??es de couleurs simples s??par??s par l'obscurit??. Un tel affichage se appelle un spectre de raies. Certaines lignes vont au-del?? des fr??quences visibles et ne peuvent ??tre d??tect??s par film photographique sp??ciale ou d'autres dispositifs. Les scientifiques ont ??mis l'hypoth??se qu'un atome peut ??mettre de la lumi??re la fa??on dont la cha??ne sur un magnifique violon rayonne son - non seulement avec un fr??quence fondamentale (dans laquelle la totalit?? de la cha??ne se d??place de la m??me mani??re ?? la fois) mais avec plusieurs harmoniques sup??rieures (form??e lorsque la cha??ne se divise en deux moiti??s et d'autres divisions qui vibrent en coordination avec l'autre que lorsque la moiti?? de la corde va une mani??re que l'autre moiti?? de la cha??ne qui va dans le sens oppos??). Pour un long temps, personne ne pourrait trouver une fa??on math??matique de relier les fr??quences du spectre d'un ??l??ment de ligne.
En 1885, Johann Jakob Balmer (1825-1898) compris comment les fr??quences de l'hydrog??ne atomique sont li??s les uns aux autres. La formule est simple:
o?? 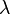 est la longueur d'onde, R est le Constante de Rydberg et n est un nombre entier (n = 3, 4, ...) Cette formule peut ??tre g??n??ralis??e ?? se appliquer aux atomes qui sont plus compliqu??s que l'hydrog??ne, mais nous allons rester avec l'hydrog??ne pour cette exposition g??n??rale. (Ce est la raison pour laquelle le d??nominateur de la premi??re fraction est exprim??e en carr??).
est la longueur d'onde, R est le Constante de Rydberg et n est un nombre entier (n = 3, 4, ...) Cette formule peut ??tre g??n??ralis??e ?? se appliquer aux atomes qui sont plus compliqu??s que l'hydrog??ne, mais nous allons rester avec l'hydrog??ne pour cette exposition g??n??rale. (Ce est la raison pour laquelle le d??nominateur de la premi??re fraction est exprim??e en carr??).
Le d??veloppement suivant a ??t?? la d??couverte du Effet Zeeman, nomm?? d'apr??s Pieter Zeeman (1865-1943). L'explication physique de l'effet Zeeman a ??t?? ??labor?? par Hendrik Antoon Lorentz (1853-1928). Lorentz ??mis l'hypoth??se que la lumi??re ??mise par l'hydrog??ne a ??t?? produit par la vibration des ??lectrons. Il ??tait possible d'obtenir des commentaires sur ce qui se passe au sein de l'atome parce ??lectrons se d??pla??ant cr??ent un champ magn??tique et peut donc ??tre influenc?? par l'imposition d'un champ magn??tique externe d'une mani??re analogue ?? la fa??on dont un aimant de fer va attirer ou repousser un autre aimant .
L'effet Zeeman pourrait ??tre interpr??t?? comme signifiant que les ondes lumineuses sont originaires par des ??lectrons vibrants dans leurs orbites, mais la physique classique ne pouvait pas expliquer pourquoi les ??lectrons ne devraient pas tomber hors de leurs orbites et dans le noyau de leurs atomes, ni la physique classique pourrait expliquer pourquoi leur orbites seraient de nature ?? produire la s??rie de fr??quences discr??tes obtenues par la formule de Balmer et affich??es dans les spectres de ligne. Pourquoi les ??lectrons ne ont pas produit un spectre continu?
Vieille th??orie quantique
La m??canique quantique d??velopp??s ?? partir de l'??tude des ondes ??lectromagn??tiques par spectroscopie qui comprend la lumi??re visible vu dans les couleurs de l'arc en ciel, mais aussi d'autres vagues y compris les vagues plus ??nergiques comme la lumi??re ultraviolette, les rayons X et les rayons gamma et les vagues avec des longueurs d'onde, y compris infrarouge ondes, micro-ondes et les ondes radio. Seuls les ondes qui voyagent ?? la vitesse de la lumi??re sont inclus dans cette description. Aussi, lorsque le mot ??particule?? est utilis?? ci-dessous, il se r??f??re toujours ?? particules ??l??mentaires ou subatomiques.
La constante de Planck
La physique classique pr??dit qu'une corps noir du radiateur serait produire de l'??nergie infinie, mais ce r??sultat n'a pas ??t?? observ??e dans le laboratoire. Si rayonnement du corps noir a ??t?? dispers?? dans un spectre, alors la quantit?? d'??nergie rayonn??e ?? diverses fr??quences pass?? de z??ro ?? une extr??mit??, a culmin?? ?? une fr??quence li??e ?? la temp??rature de l'objet rayonnant, puis est retomb?? ?? z??ro. En 1900, Max Planck a d??velopp?? une ??quation empirique qui pourrait expliquer les courbes d'??nergie observ??s, mais il ne pouvait pas l'harmoniser avec la th??orie classique. Il a conclu que les lois classiques de la physique ne se appliquent pas ?? l'??chelle atomique comme cela avait ??t?? pr??c??demment suppos??.
Dans ce compte th??orique, Planck a permis toutes les fr??quences possibles, toutes les longueurs d'onde possibles. Toutefois, il a limit?? l'??nergie qui est livr??. "En physique classique, ... l'??nergie d'un oscillateur donn?? d??pend seulement sur l'amplitude, et cette amplitude est soumise ?? aucune restriction." Mais, selon la th??orie de Planck, l'??nergie ??mise par un oscillateur est strictement proportionnelle ?? sa fr??quence. Plus la fr??quence est grande, plus l'??nergie. Pour arriver ?? cette conclusion th??orique, il a postul?? que un corps rayonnant compos??e d'un nombre ??norme d'oscillateurs ??l??mentaires, certains vibrant ?? une fr??quence et d'autres ?? l'autre, avec toutes les fr??quences de z??ro ?? l'infini ??tant repr??sent??s. L'??nergie E de l'une quelconque oscillateur n'a pas ??t?? autoris?? ?? prendre ne importe quelle valeur arbitraire, mais ??tait proportionnelle ?? un multiple entier de la fr??quence f de l'oscillateur. C'est,
o?? n = 1, 2, 3, ... La proportionnalit?? constante h est appel??e La constante de Planck.
Une des applications les plus directs est de trouver l'??nergie de photons . Si h est connue, et la fr??quence du photon est connue, l'??nergie des photons peut ??tre calcul??. Par exemple, si un faisceau de lumi??re illumine une cible, et sa fr??quence est de 540 ?? 10 12 hertz, puis l'??nergie de chaque photon serait h ?? 540 ?? 10 12 joules. La valeur de h lui-m??me est extr??mement faible, environ 6.6260693 ?? 10 -34 seconde Joule. Cela signifie que les photons dans le faisceau de lumi??re ont une ??nergie d'environ 3,58 x 10 -19 joules ou (dans un autre syst??me de mesure) d'environ 2,23 eV.
Lorsque l'??nergie d'une onde est d??crite de cette mani??re, il semble que la vague r??alise son ??nergie en petits paquets. Cette d??couverte semblait alors refaire la vague dans une particule. Ces paquets d'??nergie r??alis??es avec la vague ont ??t?? appel??s quanta par Planck. La m??canique quantique a commenc?? avec la d??couverte que l'??nergie est fournie dans les paquets dont la taille est li??e ?? des fr??quences de toutes les ondes ??lectromagn??tiques (et ?? la couleur de la lumi??re visible puisque dans ce cas la fr??quence d??termine la couleur). Soyez conscient, toutefois, que ces descriptions en termes de paquets, ondes et d'importation de particules concepts macro-monde dans le monde quantique, o?? ils ne ont aucun int??r??t provisoire ou la pertinence.
Dans les premi??res recherches sur la lumi??re, il y avait deux fa??ons concurrentes pour d??crire la lumi??re, soit comme une onde qui se propage ?? travers l'espace vide, ou comme petites particules voyageant dans les lignes droites. Parce que Planck a montr?? que l'??nergie de la vague est compos??e de paquets, l'analogie de particules se est favoris?? pour aider ?? comprendre comment la lumi??re fournit de l'??nergie en multiples de certaines valeurs de consigne d??sign??s comme quanta d'??nergie. N??anmoins, l'analogie d'onde est ??galement indispensable pour aider ?? comprendre d'autres ph??nom??nes lumineux. En 1905, Albert Einstein utilis?? la constante de Planck pour expliquer l'effet photo??lectrique en postulant que l'??nergie dans un faisceau de lumi??re se produit dans des concentrations qu'il appelle quanta de lumi??re, plus tard appel??s photons . Selon cette consid??ration, un seul photon d'une fr??quence donn??e d??livre une quantit?? invariable d'??nergie. En d'autres termes, les photons individuels peuvent fournir plus ou moins d'??nergie, mais uniquement en fonction de leurs fr??quences. Bien que la description qui d??coule de la recherche de Planck ressemble compte corpusculaire de Newton, le photon de Einstein ??tait encore dit avoir une fr??quence, et l'??nergie du photon a ??t?? comptabilis??e proportionnelle ?? cette fr??quence. Le compte de particules avait ??t?? compromise une fois de plus.
Tant l'id??e d'une vague et l'id??e d'une particule sont mod??les d??riv??s de notre exp??rience quotidienne. Nous ne pouvons pas voir photons individuels. Nous ne pouvons ??tudier leurs propri??t??s indirectement. Nous regardons certains ph??nom??nes, tels que l'arc en ciel de couleurs que nous voyons quand une fine pellicule d'huile repose sur la surface d'une flaque d'eau, et l'on peut expliquer ce ph??nom??ne ?? nous en comparant la lumi??re avec des vagues. Nous regardons d'autres ph??nom??nes, comme la fa??on dont un m??tres photo??lectrique dans notre cam??ra fonctionne, et nous expliquer par analogie aux particules en collision avec l'??cran de d??tection dans le compteur. Dans les deux cas, nous prenons des concepts de notre exp??rience quotidienne et les appliquer ?? un monde que nous ne avons jamais vu.
Ni forme d'explication, ondes ou de particules, ne est enti??rement satisfaisante. En g??n??ral, tout mod??le ne peut rapprocher ce qu'il mod??les. Un mod??le ne est utile que dans la gamme des conditions o?? il est capable de pr??dire la vraie chose avec pr??cision. physique newtonienne est encore un bon pr??dicteur de la plupart des ph??nom??nes dans notre vie quotidienne. Pour nous rappeler que les deux ??vague?? et ??particules?? sont des concepts import??s de notre monde macro pour expliquer le monde des ph??nom??nes ?? l'??chelle atomique, certains physiciens tels que George Gamow ont utilis?? le terme " wavicle ??pour d??signer tout ce que ce est vraiment l??. Dans la discussion qui suit, ??vague?? et ??particules?? peuvent tous deux ??tre utilis??s selon l'aspect des ph??nom??nes de m??canique quantique est en discussion.
R??duit (ou de Dirac) la constante de Planck
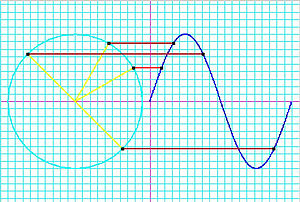
La constante de Planck repr??sentait ?? l'origine de l'??nergie qui exerce une onde lumineuse en fonction de sa fr??quence. Une ??tape dans le d??veloppement de ce concept est apparu dans les travaux de Bohr. Bohr a utilis?? un mod??le ??plan??taire?? ou une particule de l'??lectron, et ne pouvait pas comprendre pourquoi un facteur de 2π ??tait essentiel de ses formules obtenues exp??rimentalement. Plus tard, de Broglie postul?? que les ??lectrons ont des fr??quences, tout comme le font les photons, et que la fr??quence d'un ??lectron doivent se conformer aux conditions d'un vague qui peut exister dans une certaine orbite debout. Ce est-??-dire, le d??but d'un cycle d'une onde ?? un point de la circonf??rence d'un cercle (puisque ce est ce est une orbite) doit co??ncider avec la fin de certains cycle. Il peut y avoir aucun espace, aucune longueur le long de la circonf??rence qui ne participe pas ?? la vibration, et il ne peut y avoir aucun chevauchement de cycles. Ainsi, la circonf??rence de l'orbite, C, doit ??tre ??gale ?? la longueur d'onde, λ, de l'??lectron multipli??e par un entier positif (n = 1, 2, 3 ...). La connaissance de la circonf??rence, on peut calculer les longueurs d'onde qui correspondent ?? cette orbite, et connaissant le rayon, r, de l'orbite peut calculer sa circonf??rence. Pour mettre tout cela en forme math??matique,
et donc
et l'apparition du facteur de 2π est consid??r??e se produire simplement parce qu'il est n??cessaire pour calculer les longueurs d'onde possibles (et donc les fr??quences possibles) lorsque le rayon de l'orbite est d??j?? connue.
Encore une fois en 1925 lorsque Werner Heisenberg a d??velopp?? sa th??orie quantique compl??te, les calculs impliquant l'analyse d'onde appel??s s??rie de Fourier ??tait fondamentale, et donc la version "r??duite" de la constante (h / 2π) de Planck est devenu une valeur inestimable, car il comprend un facteur de conversion pour faciliter les calculs impliquant l'analyse d'onde. Enfin, lorsque ce qui a r??duit la constante de Planck est apparu naturellement dans l'??quation de Dirac, il a ensuite ??t?? donn??e une autre d??signation, "Dirac constante." Par cons??quent, il est appropri?? de commencer par une explication de ce que cette constante est, m??me si les th??ories qui ont fait sa une utilisation pratique doivent encore ??tre discut??es.
Comme indiqu?? plus haut, l'??nergie de ne importe quelle onde est donn??e par la fr??quence multipli??e par la constante de Planck. Une onde est constitu?? de cr??tes et de creux. Dans une vague, un cycle est d??fini par le retour d'une certaine position dans la m??me position comme du haut de l'une cr??te ?? l'autre cr??te. Un cycle est en fait math??matiquement li??es ?? un cercle, et les deux ont 360 degr??s. Un dipl??me est une unit?? de mesure de la quantit?? du tour n??cessaire pour produire un arc d'une certaine longueur ?? une distance donn??e. Un courbe sinuso??dale est g??n??r??e par un point sur la circonf??rence d'un cercle qui tourne en tant que cercle. (Voir une d??monstration ?? l'adresse: Rotation Applet) Il n'y a 2π radians par cycle dans une vague, ce qui est math??matiquement li??es ?? la fa??on dont un cercle a 360 ?? (qui sont ??gaux ?? deux π radians). (A radian est tout simplement l'angle si la distance le long de la circonf??rence du cercle est mesur??e ??gale au rayon du cercle, puis les lignes sont tir??es vers le centre du cercle. Cela forme un angle ??gal ?? 1 radian.) Depuis une cycle est 2π radians, lorsque h est divis??e par 2π les deux facteurs "2 π" annulera laissant juste le radian ?? combattre. Donc, divisant h par 2π d??crit une constante qui, lorsqu'il est multipli?? par la fr??quence d'une onde, donne l'??nergie en joules par radian. La constante de Planck La r??duction est ??crit dans les formules math??matiques que H, et est lu comme "h-bar".
 .
.
La constante de Planck Le r??duite permet le calcul de l'??nergie d'une vague en unit??s par radian au lieu d'en unit??s par cycle. Ces deux constantes h et H sont simplement des facteurs de conversion entre les unit??s d'??nergie et les unit??s de fr??quence. La r??duction de la constante de Planck est utilis?? plus souvent que h (constante de Planck) seul dans les formules math??matiques de la m??canique quantique pour de nombreuses raisons, dont l'une est que la vitesse angulaire ou pulsation est habituellement mesur??s en radians par seconde afin utilisant ?? qui fonctionne en radians en ira enregistrer un calcul de mettre radians en degr??s ou vice-versa. Aussi, lorsque les ??quations pertinentes ?? ces probl??mes sont ??crits en termes de H, les facteurs 2π apparaissant fr??quemment dans num??rateur et le d??nominateur peuvent annuler, l'enregistrement d'un calcul. Cependant, dans d'autres cas, comme dans les orbites de l'atome de Bohr, h / 2π a ??t?? obtenue naturellement pour le moment angulaire des orbites. Une autre expression pour la relation entre l'??nergie et la longueur d'onde est donn??e en ??lectrons-volts pour l'??nergie et angstr??ms pour longueur d'onde: E photons (eV) = 12400 / λ (A) - il semble ne pas impliquer h du tout, mais ce est seulement parce qu'un syst??me diff??rent d'unit??s a ??t?? utilis?? et maintenant, num??riquement, le facteur de conversion appropri?? est 12400.
Bohr atome

En 1897, la particule appel??e ??lectrons a ??t?? d??couvert. Au moyen de la or physiciens des exp??riences de feuille d??couvert que la mati??re est, ?? volume ??gal, en grande partie de l'espace. Une fois que ce ??tait clair, il a ??mis l'hypoth??se que les entit??s de charge n??gative appel??es ??lectrons charg??s positivement entourent noyaux . Donc, dans un premier temps tous les scientifiques croyaient que l'atome doit ??tre comme un syst??me solaire en miniature. Mais cette simple analogie pr??dit que les ??lectrons, dans environ un centi??me de microseconde, crash dans le noyau de l'atome. La grande question du d??but du 20??me si??cle ??tait: ??Pourquoi ne ??lectrons maintiennent normalement une orbite stable autour du noyau?"
En 1913, Niels Bohr a supprim?? ce probl??me important en appliquant l'id??e de quanta discrets (non continu) pour les orbites des ??lectrons. Ce compte est devenu connu comme le Mod??le de Bohr de l'atome. Bohr essentiellement th??oris?? que les ??lectrons ne peuvent habiter certaines orbites autour de l'atome. Ces orbites ont pu ??tre obtenus en regardant les raies spectrales produites par des atomes.
Bohr a expliqu?? les orbites des ??lectrons peuvent prendre en rapportant le moment angulaire des ??lectrons dans chaque orbite "autoris??e" ?? la valeur de h, la constante de Planck. Il a conclu que un ??lectron dans l'orbitale plus bas a un moment angulaire discr??te ??gale ?? h / 2π. Chaque orbite apr??s l'orbite initiale doit pr??voir le moment cin??tique de l'??lectron ??tant un multiple entier de cette valeur minimale. Il d??peint ??lectrons dans les atomes comme ??tant analogue ?? plan??tes en orbite solaire. Toutefois, il a pris la constante de Planck d'??tre une quantit?? fondamentale qui introduit des exigences particuli??res ?? ce niveau subatomique et qui explique l'espacement de ces orbites ??plan??taires??.
Bohr consid??r?? comme un tour en orbite pour ??tre ??quivalent ?? un cycle dans un oscillateur (comme dans les premi??res mesures de Planck pour d??finir la constante h) qui est ?? son tour semblable ?? un cycle dans une vague. Le nombre de tours par seconde est (ou d??finit) ce que nous appelons la fr??quence de cet ??lectron ou orbitale. Pr??cisant que la fr??quence de chaque orbite doit ??tre un multiple entier de la constante de Planck h permettrait seulement certaines orbites, et serait ??galement fixer leur taille.
Bohr g??n??ralis??e La formule de Balmer de l'hydrog??ne en rempla??ant le terme d??nominateur dans quart avec un carr?? de la variable explicite:
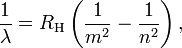 m = 1,2,3,4,5, ..., et n> m
m = 1,2,3,4,5, ..., et n> m
o?? λ est la longueur d'onde de la lumi??re, R H est la Constante de Rydberg de l'hydrog??ne, et les nombres entiers n et m d??signent les orbites entre lesquelles les ??lectrons peuvent transiter. Cette g??n??ralisation pr??dit beaucoup plus spectres de ligne que ce qui avait ??t?? pr??c??demment d??tect??e, et la confirmation exp??rimentale de cette pr??diction suivie.
Il se ensuit que si presque imm??diatement 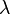 est quantifi??e comme la formule ci-dessus indique, puis l'??lan de tout photon doit ??tre quantifi??. La fr??quence de la lumi??re,
est quantifi??e comme la formule ci-dessus indique, puis l'??lan de tout photon doit ??tre quantifi??. La fr??quence de la lumi??re, 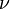 , ?? une longueur d'onde donn??e
, ?? une longueur d'onde donn??e 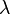 est donn??e par la relation
est donn??e par la relation
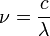 et:
et: 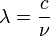 et en multipliant par h / h = 1,
et en multipliant par h / h = 1,
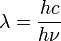 , Et nous savons que
, Et nous savons que
- E = hv sorte
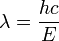 que nous pouvons r????crire comme:
que nous pouvons r????crire comme:
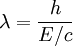 , Et E / c = p (momentum) afin
, Et E / c = p (momentum) afin
 ou
ou 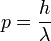
Commen??ant avec des spectres de ligne, les physiciens ont pu d??duire empiriquement les r??gles selon lesquelles les orbites des ??lectrons sont d??termin??s et de d??couvrir quelque chose de vital sur les ??lans impliqu??s - qu'ils sont quantifi??es.
Bohr prochaine r??alis?? ?? quel moment angulaire d'un ??lectron dans son orbite, L, est quantifi??, ce est ?? dire, il a d??termin?? qu'il ya une certaine valeur constante K telle que quand il est multipli?? par constante de Planck h, il donnera l'??lan angulaire qui rapporte ?? la plus basse orbitale. Quand il se est multipli?? par entiers successifs, il donnera ensuite les valeurs des autres orbitales possibles. Il a d??termin?? plus tard que K = 1 / 2π. (Voir l'argumentation d??taill??e au .)
La th??orie de Bohr repr??sent?? ??lectrons en orbite autour du noyau d'un atome d'une mani??re qui ??tait ??tonnamment diff??rent de ce que nous voyons dans le monde de notre exp??rience quotidienne. Il a montr?? que lorsqu'un ??lectron chang?? orbites, il ne bougeait pas dans une trajectoire continue d'une orbite autour du noyau ?? l'autre. Au lieu de cela, il a soudainement disparu de son orbite originale et r??apparu dans une autre orbite. Chaque distance ?? laquelle un ??lectron peut orbite est une fonction d'une quantit?? d'??nergie quantifi??. Le plus pr??s du noyau un orbites des ??lectrons, le moins d'??nergie qu'il faut pour rester dans cette orbital. Les ??lectrons qui absorbent un photon acqu??rir un quantum d'??nergie, donc ils sautent ?? une orbite qui est plus ??loign?? du noyau, tandis que les ??lectrons qui ??mettent un photon perdent un quantum d'??nergie et ainsi de sauter ?? une orbitale int??rieure. Les ??lectrons ne peuvent pas gagner ou perdre un quantum fractionnaire de l'??nergie, et ainsi, il est soutenu, ils ne peuvent pas avoir une position qui est ?? une distance fractionn??e entre autoris??s orbitales. Orbitales autoris??s ont ??t?? d??sign??s par des nombres entiers ?? l'aide de la lettre n avec la plus ?? l'int??rieur ??tant d??sign?? orbitale n = 1, le c??t?? ??tant sur n = 2, et ainsi de suite. Toute orbital avec la m??me valeur de n est appel?? une coquille d'??lectrons.
Le mod??le de Bohr de l'atome ??tait essentiellement deux dimensions parce qu'il repr??sente les ??lectrons comme des particules dans des orbites circulaires. Dans ce contexte, deux dimensions signifie quelque chose qui peut ??tre d??crite sur la surface d'un avion. Unidimensionnelle signifie quelque chose qui peut ??tre d??crit par une ligne. Parce que les milieux peuvent ??tre d??crits par leur rayon, qui est un segment de droite, tant??t le mod??le de Bohr de l'atome est d??crite comme une dimension.
Dualit?? onde-particule

Niels Bohr a d??termin?? qu'il est impossible de d??crire la lumi??re de mani??re ad??quate par le seul usage de l'analogie soit d'onde ou de l'analogie de particules. Il ??nonce donc principe de compl??mentarit??, qui est une th??orie de paires, telles que l'appariement des ondes et des particules ou l'appariement de position et l'impulsion. Louis de Broglie a travaill?? sur les cons??quences math??matiques de ces conclusions. En m??canique quantique, on a constat?? que les ondes ??lectromagn??tiques peuvent r??agir dans certaines exp??riences comme si elles ??taient des particules et dans d'autres exp??riences comme si elles ??taient des ondes. On a ??galement d??couvert que les particules subatomiques pouvaient parfois ??tre d??crits comme des particules et parfois comme des ondes. Cette d??couverte a conduit ?? la th??orie de la dualit?? onde-particule par Louis-Victor de Broglie en 1924, qui stipule que les entit??s subatomiques ont des propri??t??s des deux ondes et particules en m??me temps.
Le mod??le de l'atome de Bohr a ??t?? agrandie sur la d??couverte par de Broglie que l'??lectron poss??de des propri??t??s ondulatoires. En accord avec les conclusions de de Broglie, les ??lectrons ne peuvent appara??tre dans des conditions qui permettent une onde stationnaire. Une onde stationnaire peut ??tre faite si une cha??ne est fix??e sur les deux extr??mit??s et fait vibrer (comme il le ferait dans un instrument ?? cordes). Cette illustration montre que les seules ondes stationnaires qui peuvent se produire sont ceux qui ont une amplitude nulle aux deux extr??mit??s fixes. Les vagues cr????es par un instrument ?? cordes semblent osciller en place, changeant simplement la cr??te de creux dans un mouvement de va-et-vient. Une onde stationnaire ne peut ??tre form?? lorsque la longueur de l'onde tient l'entit?? vibrant disponibles. En d'autres termes, aucun des fragments partiels de sommets d'ondulation ou des creux sont autoris??s. Dans un milieu vibrant rond, la vague doit ??tre une formation continue des cr??tes et des creux tout autour du cercle. Chaque ??lectron doit ??tre sa propre onde stationnaire dans son propre discr??te orbitale.
D??veloppement de la m??canique quantique moderne
La th??orie de la m??canique quantique complet
Werner Heisenberg a fait la th??orie compl??te m??canique quantique en 1925 ?? l'??ge de 23. Apr??s son mentor, Niels Bohr, Werner Heisenberg a commenc?? ?? travailler sur une th??orie du comportement quantique des orbitales ??lectroniques. Parce que les ??lectrons ne ont pas pu ??tre observ??es dans leurs orbites, Heisenberg a sur la cr??ation d'une description math??matique de la m??canique quantique construites sur ce qui pourrait ??tre observ??, ce est la lumi??re ??mise par des atomes dans leur spectres atomiques caract??ristique. Heisenberg a ??tudi?? l'??lectron orbitale sur le mod??le d'une boule charg??e sur un ressort, un oscillateur, dont le mouvement est anharmonique (pas tout ?? fait r??guli??re). Pour une image du comportement d'une boule charg??e sur une mer de printemps: Frais vibrant. Heisenberg a d'abord expliqu?? ce genre de mouvement observ?? en termes des lois de la m??canique classique connus pour appliquer dans le monde macro, puis appliqu?? des restrictions de propri??t??s quantiques, discr??tes (non continues), ?? l'image. Cela provoque des lacunes ?? appara??tre entre les orbitales pr??vues de sorte que la description math??matique, il a formul?? repr??senterait alors que l'??lectron orbitales pr??dit sur la base des spectres atomique.
En abordant le probl??me que Bohr lui donna ?? r??soudre, Heisenberg a pris la position strat??gique qu'il ne traiterait pas avec des quantit??s non observables. Il serait commencer ?? formuler des ??quations en utilisant uniquement les quantit??s qui pourraient ??tre observ??s. Cette strat??gie l'a conduit ?? commencer par la preuve exp??rimentale r??elle ?? port??e de main: les mesures avaient ??t?? bien ??tabli pour des donn??es telles que (1) les fr??quences (et les ??nergies reli??es math??matiquement) ??mis ou absorb??s par des transitions d'??lectrons de l'une des orbites fixes Bohr, connus d'??tre associ??s ?? des spectres de ligne lumineux, (2) le ??amplitude de transition?? ou la probabilit?? de transition ?? partir de ne importe quelle orbite accord?? ?? une quelconque orbite donn??e, connu ?? partir de la r??sistance des diff??rentes lignes dans le spectre lumineux, etc. De formules classiques qui serait caract??risent ces ph??nom??nes Heisenberg cr???? des formules analogues qui tiennent compte des conditions quantiques. Formules qui ont suivi des d??cisions fondamentales formul??es ?? ce point ont abouti ?? de bons r??sultats, mais les r??sultats qui ??taient parfois pas ce que l'on pourrait se attendre. Dans le papier, dans lequel il a pr??sent?? la m??canique quantique au monde pr??vient-il, "Une difficult?? importante se pose, toutefois, si l'on consid??re deux quantit??s x (t), y (t), et de demander apr??s leur produit .... Alors que dans x classique (t) y (t) est toujours ??gale ?? Y (t) x (t), ce ne est pas n??cessairement le cas dans la th??orie quantique ". Lorsque les valeurs pr??dites sont expos??es sous forme de matrice et multiplications sont effectu??es, la nature de la difficult?? appara??t dans une forme qui est plus familier aux math??maticiens.Plus important encore, les études empiriques valident les résultats théoriques et suggèrent qu'il ya quelque chose d'une importance profonde en ce que la différence entre x (t) y (t) et y (t) x (t) est une valeur liée à la constante de Planck.
Schéma d'une table des fréquences de transition (produite lorsque les électrons changent orbitales):
| États Electron | S1 | S2 | S3 | S4 | S5 | .... | |
|---|---|---|---|---|---|---|---|
| S1 | f1 ??? 1 | f2 ??? 1 | f3 ??? 1 | ??? une f4 | f5 ??? 1 | ..... | |
| S2 | f1 ??? 2 | f2 ??? 2 | f3 ??? 2 | f4 ??? 2 | f5 ??? 2 | ..... | |
| S3 | f1 ??? 3 | f2 ??? 3 | f3 ??? 3 | f4 ??? 3 | f5 ??? 3 | ..... | |
| S4 | f1 → 4 | f2 → 4 | f3 → 4 | f4 → 4 | f5 → 4 | ..... | |
| S5 | f1 → 5 | f2 → 5 | f3 → 5 | f4 → 5 | f5 → 5 | ..... | |
| S ..... | ..... | ..... | ..... | ..... | ..... | ..... |
Sch??ma d'une table li??e montrant les amplitudes de transition:
| États Electron | S1 | S2 | S3 | S4 | S5 | .... | |
|---|---|---|---|---|---|---|---|
| S1 | a1 ??? 1 | a2 ??? 1 | a3 ??? 1 | ??? une a4 | a5 ??? 1 | ..... | |
| S2 | a1 ??? 2 | a2 ??? 2 | a3 ??? 2 | a4 ??? 2 | a5 ??? 2 | ..... | |
| S3 | a1 ??? 3 | a2 ??? 3 | a3 ??? 3 | a4 ??? 3 | a5 ??? 3 | ..... | |
| S4 | a1 ??? 4 | a2 ??? 4 | a3 ??? 4 | a4 ??? 4 | a5 ??? 4 | ..... | |
| S5 | a1 ??? 5 | a2 ??? 5 | a3 ??? 5 | a4 ??? 5 | a5 ??? 5 | ..... | |
| S ..... | ..... | ..... | ..... | ..... | ..... | ..... |
Comme relaté ci-dessus, Heisenberg a développé modes de relation significative l'information dans des tableaux comme ceux-ci de façon mathématique. Remplissage empiriquement dans les valeurs de tableaux portant sur ??????des quantités quantique est pas une procédure simple, puisque les relevés effectués sur un seul et même système que l'on donne la valeur, mais a le potentiel de changer d'autres valeurs. Donc, un grand nombre de copies identiques du système en question doivent être préparés, et une seule mesure faite sur chaque système. Plusieurs expériences pour déterminer les mêmes caractéristiques sont faites, et les résultats sont en moyenne. Même alors, des mesures précises de toutes les caractéristiques du système comme ils le feraient apparaître simultanément ne peuvent être fournis en raison de l'incertitude quantique. Une détermination précise de la valeur une caractéristique crée nécessairement une incertitude sur la valeur de son corrélat. "Certaines paires de observables tout simplement ne peuvent pas être mesurées simultanément à un niveau arbitrairement élevé de précision. " Si des mesures simultanées sont faites de caractéristiques corrélées (telles que la position et l'impulsion) dans plusieurs systèmes identiques, il y aura inévitablement des différences dans les mesures de telle sorte que la différence entre leurs produits est égale ou supérieure à  / 2 ».
/ 2 ».
En 1925, Heisenberg a publié un document intitulé «ré-interprétation de la mécanique quantique des relations cinématiques et mécaniques" se rapportant ses découvertes. Ainsi se termina la vieille théorie quantique et a commencé à l'âge de la mécanique quantique. Le document de Heisenberg a donné quelques détails qui pourraient aider les lecteurs à établir la façon dont il fait parvint à obtenir ses résultats pour les modèles unidimensionnels qu'il a utilisé pour former l'hypothèse que révélé tellement utile. Dans son article, Heisenberg a proposé de "jeter tout espoir d'observer des quantités jusqu'ici non observables, telles que la position et la période de l'électron", et se limiter strictement aux quantités réellement observables. Il avait besoin de règles mathématiques permettant de prédire les relations réellement observées dans la nature, et les règles qu'il produit travaillé différemment en fonction de l'ordre dans lequel ils ont été appliqués. "Il est rapidement devenu évident que la non-commutativité (en général) des quantités cinématiques de la théorie quantique était l'idée nouvelle technique vraiment essentiel dans le papier. "
Le type spécial de multiplication qui avéré être nécessaire dans sa formule a été plus élégamment décrite par l'utilisation de tableaux spéciaux des numéros appelés matrices . Dans les situations ordinaires, il n'a pas d'importance dans quel ordre les opérations impliquées dans la multiplication sont effectuées, mais la multiplication de matrices ne pas commuer . Essentiellement cela signifie qu'il importe que des opérations d'ordre donné sont effectuées en. Multipliant matrice A par la matrice B est pas la même que la multiplication matrice B par la matrice A. En symboles, A × B est en général pas égal à B × A. (La chose importante dans la théorie quantique est qu'il est avéré à la matière que l'on mesure expérimentalement première vitesse et mesure ensuite immédiatement la position, ou vice-versa.) La convention de matrice avéré être un moyen pratique d'organiser l'information et en indiquant clairement l'exacte séquence dans laquelle les calculs doit être faite, et cela se reflète dans une forme symbolique les résultats inattendus obtenus dans le monde réel.
Heisenberg approché la mécanique quantique de la perspective historique qui a traité un électron comme une oscillation de particules chargées. L'utilisation de Bohr de cette analogie avait déjà lui a permis d'expliquer pourquoi les rayons des orbites des électrons ne pourrait avoir sur certaines valeurs. Il découle de cette interprétation des résultats expérimentaux disponibles et la théorie quantique qui Heisenberg créé par la suite qu'un électron pouvait pas être à toute position intermédiaire entre deux "autorisée" orbites. Par conséquent électrons ont été décrits comme "sauter" d'une orbite à. L'idée qu'un électron pourrait maintenant être à un endroit et un instant plus tard, soit dans un autre lieu, sans avoir voyagé entre les deux points était l'une des premières indications de la "spookiness" des phénomènes quantiques. Bien que l'échelle est plus petite, la "sauter" d'une orbite à est aussi étrange et inattendu comme ce serait le cas où quelqu'un est sorti d'une porte à Londres dans les rues de Los Angeles. tunnel Quantum est un cas dans lequel les électrons semblent pour être en mesure de se déplacer dans la voie "fantasmagorique" que Heisenberg attribuée à leurs actions au sein des atomes.
Amplitudes de position et de mouvement qui ont une période de 2 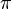 comme un cycle dans une vague sont appelées variables de séries de Fourier. Heisenberg a décrit les propriétés des particules ressemblant à de l'électron dans une vague comme ayant position et l'impulsion dans ses mécanique matricielle. Lorsque ces amplitudes de position et l'impulsion sont mesurés et multipliés ensemble, ils donnent l'intensité. Toutefois, il a constaté que lorsque la position et la vitesse ont été multipliés ensemble dans cet ordre respectif, puis l'élan et la position ont été multipliés ensemble dans cet ordre respectif, il y avait une différence ou un écart d'intensité entre eux de h / 2
comme un cycle dans une vague sont appelées variables de séries de Fourier. Heisenberg a décrit les propriétés des particules ressemblant à de l'électron dans une vague comme ayant position et l'impulsion dans ses mécanique matricielle. Lorsque ces amplitudes de position et l'impulsion sont mesurés et multipliés ensemble, ils donnent l'intensité. Toutefois, il a constaté que lorsque la position et la vitesse ont été multipliés ensemble dans cet ordre respectif, puis l'élan et la position ont été multipliés ensemble dans cet ordre respectif, il y avait une différence ou un écart d'intensité entre eux de h / 2 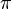 . Heisenberg ne comprendrait pas la raison de cet écart jusqu'à deux ans de plus avait passé, mais pour le moment, il se satisfait de l'idée que le calcul a travaillé et a fourni une description exacte du comportement quantique de l'électron.
. Heisenberg ne comprendrait pas la raison de cet écart jusqu'à deux ans de plus avait passé, mais pour le moment, il se satisfait de l'idée que le calcul a travaillé et a fourni une description exacte du comportement quantique de l'électron.
mécanique matrice a été la première définition complète de la mécanique quantique, ses lois, et les propriétés qui décrivent entièrement le comportement de l'électron. Il a ensuite été étendu à appliquer à toutes les particules subatomiques. Très peu de temps après la mécanique matricielle a été introduit dans le monde, Schrödinger, agissant de manière indépendante, a produit une théorie de l'onde quantique qui ne semblait pas avoir similitudes que ce soit à la théorie de Heisenberg. Il était plus facile de calcul et d'éviter certaines des idées bizarres qui sonne comme «sauts quantiques» d'un électron d'une orbite à l'autre. Mais dans un court laps de temps de Schrödinger lui-même avait montré que les deux théories produites essentiellement les mêmes résultats dans toutes les situations. Enfin, Dirac fait l'idée de non-commutativité au centre de sa propre théorie et prouvé les formulations de Heisenberg et Schrödinger d'être des cas particuliers de sa propre théorie.
Équation d'onde de Schrödinger
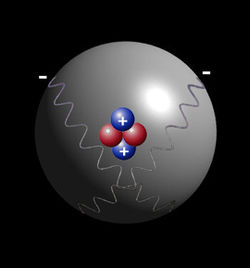
Parce que les particules pourraient être décrits comme des vagues, plus tard, en 1925, Erwin Schrödinger analysé ce qu'est un électron ressemblerait comme une vague autour du noyau de l'atome. En utilisant ce modèle, il a formulé son équation d'ondes de particules. Plutôt que d'expliquer l'atome par analogie aux satellites en orbites planétaires, il traite tout comme des ondes de sorte que chaque électron a sa propre fonction d'onde unique. Une fonction d'onde est décrite dans l'équation de Schrödinger par trois propriétés (plus tard Wolfgang Pauli a ajouté un quatrième). Les trois propriétés étaient (1) une désignation "orbital", indiquant si l'onde de particules est celle qui est plus proche du noyau avec moins d'énergie ou une qui est plus éloignée du noyau avec plus d'énergie, (2) la forme de l'orbite, soit une indication que orbitales ne sont pas seulement des formes sphériques, mais d'autres, et (3) le moment magnétique de l'orbital, qui est une manifestation de la force exercée par la charge de l'électron lors de sa rotation autour du noyau.
Ces trois propriétés ont été appelés collectivement la fonction d'onde de l'électron et on dit pour décrire l' état ??????quantique de l'électron. "État quantique" signifie que les propriétés collectives de l'électron décrivant ce que nous pouvons dire au sujet de son état ??????à un moment donné. Pour l'électron, l'état quantique est décrit par son wavefunction, qui est désignée en physique par la lettre grecque  (psi, prononcé «soupirer»). Les trois propriétés de l'équation de Schrödinger qui décrivent la fonction d'onde de l'électron et, par conséquent, également de décrire l'état quantique de l'électron comme décrit dans le paragraphe précédent sont chacun appelés nombres quantiques. La première propriété qui décrit l'orbitale a été numérotés selon le modèle de Bohr, où n est la lettre utilisée pour décrire l'énergie de chaque orbitale. Ceci est appel?? le nombre quantique principal. Le prochain nombre quantique qui décrit la forme de l'orbite est appelé le nombre quantique azimutal et elle est représentée par la lettre l (L minuscule). La forme est due à la quantité de mouvement angulaire orbital de la. Le taux de changement de la vitesse angulaire de tout système est égal au couple externe résultante agissant sur ??????ce système. En d'autres termes, le moment angulaire représente la résistance d'un objet de filature d'accélérer ou de ralentir sous l'influence d'une force extérieure. Le nombre quantique azimutal "l" représente la quantité de mouvement angulaire orbital de l'électron autour de son noyau. Cependant, la forme de chaque orbitale a sa propre lettre. Donc, pour la lettre "l" il ya d'autres lettres pour décrire les formes de "l" . La première forme est sphérique et est décrit par la lettre s . La forme suivante est comme un haltère et est décrit par la lettre p . Les autres formes d'orbitales deviennent plus compliquées (voir orbitales atomiques) et sont décrits par les lettres d , f et g . Pour la forme d'un atome de carbone, voir atome de carbone. Le troisième nombre quantique de l'équation de Schrödinger décrit le moment magnétique de l'électron et est désigné par la lettre m et parfois comme la lettre m avec un indice l parce que le moment magnétique dépend du deuxième nombre quantique l .
(psi, prononcé «soupirer»). Les trois propriétés de l'équation de Schrödinger qui décrivent la fonction d'onde de l'électron et, par conséquent, également de décrire l'état quantique de l'électron comme décrit dans le paragraphe précédent sont chacun appelés nombres quantiques. La première propriété qui décrit l'orbitale a été numérotés selon le modèle de Bohr, où n est la lettre utilisée pour décrire l'énergie de chaque orbitale. Ceci est appel?? le nombre quantique principal. Le prochain nombre quantique qui décrit la forme de l'orbite est appelé le nombre quantique azimutal et elle est représentée par la lettre l (L minuscule). La forme est due à la quantité de mouvement angulaire orbital de la. Le taux de changement de la vitesse angulaire de tout système est égal au couple externe résultante agissant sur ??????ce système. En d'autres termes, le moment angulaire représente la résistance d'un objet de filature d'accélérer ou de ralentir sous l'influence d'une force extérieure. Le nombre quantique azimutal "l" représente la quantité de mouvement angulaire orbital de l'électron autour de son noyau. Cependant, la forme de chaque orbitale a sa propre lettre. Donc, pour la lettre "l" il ya d'autres lettres pour décrire les formes de "l" . La première forme est sphérique et est décrit par la lettre s . La forme suivante est comme un haltère et est décrit par la lettre p . Les autres formes d'orbitales deviennent plus compliquées (voir orbitales atomiques) et sont décrits par les lettres d , f et g . Pour la forme d'un atome de carbone, voir atome de carbone. Le troisième nombre quantique de l'équation de Schrödinger décrit le moment magnétique de l'électron et est désigné par la lettre m et parfois comme la lettre m avec un indice l parce que le moment magnétique dépend du deuxième nombre quantique l .
De mai 1926, Schrödinger a publié une preuve que la mécanique de la matrice de Heisenberg et ses propres mécanique ondulatoire ont donné des résultats équivalents: ils étaient mathématiquement la même théorie. Pourtant, les deux hommes étaient en désaccord sur l'interprétation de cette théorie. Heisenberg a vu aucun problème à l'existence de sauts quantiques discontinues, tandis que Schrödinger espère que une théorie basée sur des propriétés continues comme des vagues pourrait éviter ce «non-sens à propos de sauts quantiques» (selon les mots de Wilhelm Wien).
Principe d'incertitude
En 1927, Heisenberg a fait une nouvelle découverte sur la base de sa théorie quantique qui a eu des conséquences plus pratiques de cette nouvelle façon de regarder la matière et de l'énergie à l'échelle atomique. Dans la formule de la mécanique matricielle de Heisenberg, il a rencontré une erreur ou la différence de h / 2 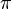 entre la position et de l'élan. Le plus certain de la position d'une particule est déterminé, moins certain que le mouvement est connu, et h / 2
entre la position et de l'élan. Le plus certain de la position d'une particule est déterminé, moins certain que le mouvement est connu, et h / 2 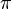 est la limite inférieure de l'incertitude. Cette conclusion est venu à être appelé "indétermination principe de Heisenberg», ou l'incertitude d'Heisenberg.
est la limite inférieure de l'incertitude. Cette conclusion est venu à être appelé "indétermination principe de Heisenberg», ou l'incertitude d'Heisenberg.
Pour les particules se déplaçant dans la mécanique quantique, il est tout simplement un certain degré d'exactitude et de précision qui manque. L'observateur peut être précis lors de la prise d'une mesure de la position ou peut être précis lors de la prise d'une mesure de l'élan, mais il est une imprécision inverse lorsque l'on mesure les deux en même temps que dans le cas d'une particule en mouvement comme l'électron. Dans le cas le plus extrême, une précision absolue d'une variable entraînerait imprécision absolue en ce qui concerne l'autre.
Heisenberg, dans un enregistrement de la voix d'une conférence au début sur ??????le principe d'incertitude pointant vers un modèle de Bohr de l'atome, a déclaré:
- "Vous pouvez dire, eh bien, cette orbite est vraiment pas une orbite complète. En fait, à chaque instant l'électron ne dispose que d'une position inexactes et une vitesse inexactes et entre ces deux inexactitudes, il ya cette relation d'incertitude. Et que par cette idée qu'il était possible de dire ce que une telle orbite était. "
Une conséquence du principe d'incertitude était que l'électron ne pouvait plus être considéré comme dans un emplacement exact dans son orbite. Plutôt l'électron devait être décrit par chaque point où l'électron pourrait habiter. Le calcul des points de localisation probable pour l'électron dans son orbitale connue créé l'image d'un nuage de points dans une forme sphérique pour l'orbitale d'un atome d'hydrogène, qui progressivement disparu les points sur plus proche du noyau et loin du noyau. Cette image peut être appelée une distribution de probabilité . Par conséquent, le nombre de Bohr de l'atome n pour chaque orbital est devenu connu comme un n-sphère à l'atome trois dimensions et a été décrit comme un nuage de probabilité où l'électron de l'atome entouré à la fois.
Cela a conduit à la description plus détaillée de Heisenberg que, si une mesure de l'électron n'a pas été prises qu'il ne pouvait pas être décrite dans une situation particulière, mais est partout dans le nuage d'électrons à la fois. En d'autres termes, la mécanique quantique ne peuvent pas donner des résultats exacts, mais seulement les probabilités de l'apparition d'une variété de résultats possibles. Heisenberg est allé plus loin et a déclaré que le chemin d'une particule en mouvement ne vient que dans l'existence une fois que nous l'observons. Cependant étrange et contre-intuitif cette affirmation peut sembler, la mécanique quantique ne nous dit encore l'emplacement de l'orbite, son nuage de probabilité de l'électron. Heisenberg parlait de la particule elle-même, et non son orbitale qui est dans une distribution de probabilité connue.
Il est important de noter que, bien que Heisenberg ensembles infinis de positions pour l'électron dans ses matrices, cela ne signifie pas que l'électron pourrait être n'importe où dans l'univers. Plutôt il ya plusieurs lois qui montrent l'électron doit être dans l'une distribution de probabilité localisée. Un électron est décrit par son énergie dans l'atome de Bohr qui a été reporté à la mécanique des matrices. Par conséquent, un électron dans un certain n-sphère doit être dans une certaine plage à partir du noyau en fonction de son énergie. Cela limite son emplacement. En outre, le nombre de places peut être un électron est aussi appelé "le nombre de cellules dans son espace des phases ". Le principe d'incertitude de fixer une limite inférieure à la façon dont on peut finement hacher l'espace des phases classique, de sorte que le nombre de places qui peut être un électron dans son orbitale devient finie. L'emplacement d'un électron dans un atome est défini comme étant dans son orbite, mais arrête au niveau du noyau et avant la prochaine n-sphère orbitale commence.
La physique classique avait montré depuis Newton que si la position des étoiles et des planètes et des détails sur leurs mouvements étaient connus alors où ils seront à l'avenir peut être prédit. Pour les particules subatomiques, Heisenberg a nié cette notion montrant que, en raison du principe d'incertitude on ne peut pas connaître la position précise et dynamique d'une particule à un instant donné, de sorte que son mouvement futur ne peut pas être déterminée, mais seulement une gamme de possibilités pour le mouvement avenir de la particule peut être décrite.
Le terme eigenstate est dérivé du mot allemand / hollandais "eigen," ce qui signifie «inhérent» ou «caractéristique». Le mot eigenstate est descriptive de l'état mesurée d'un objet qui possède des caractéristiques quantifiables comme la position, l'élan, etc. L'état mesuré et décrit doit être un « observable »(c.-à quelque chose qui peut être mesuré expérimentalement soit directement ou indirectement, comme la position ou dynamique), et doit avoir une valeur définie. Dans le monde de tous les jours, il est naturel et intuitif de penser à tout l'être dans son propre état ??????propre. Tout semble avoir une position définitive, une dynamique certaine, une valeur définitive de la mesure, et un moment précis de l'événement. Cependant, la mécanique quantique affirme qu'il est impossible d'identifier les valeurs exactes pour la dynamique d'une certaine particule comme un électron dans un endroit donné à un moment précis dans le temps, ou, à défaut, qu'il est impossible de donner un emplacement exact pour une telle objet lorsque l'élan a été mesurée. En raison du principe d'incertitude, les énoncés concernant à la fois la position et la vitesse des particules ne peuvent être données en termes d'une gamme de probabilités, une «distribution de probabilité". L'élimination de l'incertitude dans l'un terme maximise l'incertitude en ce qui concerne le second paramètre.
Il est donc devenu nécessaire de disposer d'un moyen de formuler clairement la différence entre l'état de quelque chose qui est incertain de la façon venons de décrire, comme un électron dans un nuage de probabilité, et efficacement opposer à l'état de quelque chose qui est pas incertain, quelque chose qui a une valeur définie. Quand quelque chose est dans la condition d'être définitivement "épinglé-bas" à certains égards, il est dit de posséder un état ??????propre . Par exemple, si la position d'un électron a été rendue définitive, il est dit avoir un état ??????propre de la position.
Une valeur définie, telle que la position d'un électron qui a été localisé avec succès, est appelée la valeur propre de l'état propre de la position. Le mot allemand «eigen" a été d'abord utilisé dans ce contexte par le mathématicien David Hilbert en 1904. équation d'onde de Schrödinger donne des solutions de fonction d'onde, ce qui signifie les possibilités où l'électron pourrait être, tout comme le fait la distribution de probabilité de Heisenberg. Comme indiqué ci-dessus, quand un effondrement de la fonction d'onde se produit parce que quelque chose a été fait pour localiser la position d'un électron, l'état de l'électron devient un état ??????propre de la situation, ce qui signifie que la position a une valeur connue.
Le principe d'exclusion de Pauli
Le Principe d'exclusion de Pauli stipule qu'aucun électrons (ou autrefermion) peuvent être dans le même état ??????quantique comme un autre au sein d'un atome.
Wolfgang Pauli a développé le principe d'exclusion de ce qu'il appelait un «degré quantique à deux valeurs de la liberté" pour tenir compte de l'observation d'un doublet, ce qui signifie une paire de lignes, dans le spectre de l'atome d'hydrogène. L'observation signifiait qu'il n'y avait plus d'énergie dans l'électron orbital du moment magnétique que ce qui avait été décrit précédemment. Au début de 1925, les jeunes physiciens Uhlenbeck et Goudsmit introduit une théorie que l'électron tourne dans l'espace de la même manière que la terre tourne sur son axe. Ceci expliquerait le moment magnétique manquant et permettre deux électrons dans la même orbitale être différente si leurs spins étaient dans des directions opposées, satisfaisant ainsi le principe d'exclusion.
Selon l'équation de Schrödinger, il ya trois états quantiques de l'électron, mais si deux électrons peuvent être dans la même orbitale, il doit y avoir un autre nombre quantique (le degré quantique à deux valeurs de la liberté) de distinguer les deux électrons de l'autre . Un seul électron ne peut pas avoir les mêmes quatre nombres quantiques comme un autre électron dans la même orbitale atomique. Lorsque deux électrons sont dans le même n-sphère et partagent donc le même nombre quantique principal, ils doivent donc avoir un autre nombre quantique unique de forme l , moment magnétique m ou de spin s . Lorsque les électrons ne sont pas dans une orbitale autour du noyau d'un atome, tel que dans la formation de gaz dégénérés, ils doivent toujours suivre le principe d'exclusion de Pauli lorsque dans un espace confiné.
Équation d'onde de Dirac
En 1928, Paul Dirac a travaillé sur une variation de l'équation de Schrödinger qui représentait une quatrième propriété de l'électron dans son orbitale. Paul Dirac a présenté le quatrième nombre quantique appelé le nombre quantique de spin désigné par la lettre s à la nouvelle équation de Dirac de la fonction d'onde de l'électron. En 1930, Dirac combiné matrice de la mécanique de Heisenberg avec la mécanique ondulatoire de Schrödinger dans une représentation unique de la mécanique quantique dans ses Principes de la mécanique quantique . L'image quantique de l'électron était maintenant terminée.
Tout le développement ci-dessus de la théorie quantique était basée principalement sur ??????le spectre atomique de l'atome d'hydrogène. Cela est dû au fait que chaque atome de chaque élément unique, produit un motif de raies spectrales lorsque la lumière provenant de chaque autre type d'élément est passé à travers un prisme. Les scientifiques ne pouvaient pas étudier l'électron et le noyau de l'atome lui-même parce qu'ils ne peuvent pas être vus. Même aujourd'hui, avec effet tunnel à balayage haute résolution microscopes électroniques nous ne pouvons obtenir des images de l'atome comme une fuzzball floue. Toutefois, les lignes spectrales de l'atome révèlent les orbites des électrons et l'énergie qui peut être attendu. Il a été essentiellement l'étude de l'analyse spectroscopique de la première atome d'hydrogène puis l'atome d'hélium qui a conduit à la théorie quantique. Par conséquent, les formules mathématiques ont été faites pour adapter l'image du spectre atomique. Voilà pourquoi la mécanique quantique est parfois désigné comme une forme de la physique mathématique.
L'intrication quantique
Albert Einstein a rejeté principe d'incertitude de Heisenberg dans la mesure où il semblait impliquer plus d'une limitation nécessaire sur la capacité humaine de savoir réellement ce qui se passe dans le domaine quantique. Dans une lettre à Max Born en 1926, Einstein célèbre pour avoir déclaré que "Dieu ne joue pas aux dés". Le nu prescription de niveau de la surface pour faire des prédictions de la mécanique quantique, basé sur la règle de Born pour calculer des probabilités, est devenu connu comme l' interprétation de Copenhague de la mécanique quantique. Bohr a passé de nombreuses années à développer et à affiner cette interprétation à la lumière des objections d'Einstein. Après les années 1930, la conférence Solvay, Einstein jamais contesté l'interprétation de Copenhague sur des points techniques, mais n'a pas cessé une attaque philosophique sur l'interprétation, sur le terrain du réalisme et de la localité. Einstein, en essayant de montrer que la théorie quantique était pas une théorie complète, a reconnu que la théorie prédit que deux ou plusieurs particules ayant interagi dans le passé peuvent présenter de fortes corrélations lorsque différentes mesures sont faites sur eux. Il voulait que cela soit expliqué d'une manière classique par leur passé commun, et de préférence pas par un "sinistre action à distance ". L'argument est travaillé dans un célèbre article consacré à ce qui est maintenant appelé le paradoxe EPR (Einstein-Podolsky-Rosen, 1935). En supposant que ce qui est maintenant généralement appelé " réalisme local », l'EPR tente de montrer de la théorie quantique que les particules possèdent simultanément la position et l'élan, alors que selon l'interprétation de Copenhague, un seul de ces deux propriétés existe seulement brièvement, dans le moment où il qui est mesuré. Einstein a examiné cette conclusion une preuve que la théorie quantique était incomplète, car il refuse de discuter de propriétés physiques qui existent objectivement dans la nature. La caractéristique de la théorie quantique conduisant à ces paradoxes est appelé l'intrication quantique. Cela signifie que les propriétés de plusieurs objets distincts ne peuvent pas être décrits par les considérer séparément, même après prise en compte de l'histoire de leur interaction passé. Le papier 1935 Einstein, Podolsky et Rosen est actuellement la publication la plus citée d'Einstein dans des revues de physique.
Réponse originale de Bohr à Einstein était que les particules faisaient partie d'un système indivisible. Le défi d'Einstein a conduit à des décennies de recherche importante dans l'intrication quantique. La recherche semble confirmer l'objection de Bohr que les deux particules intriquées doivent être considérés ensemble comme un tout, et d'ailleurs, que les difficultés ne se posent en insistant sur ??????la réalité des résultats de mesures qui ne sont pas faites de toute façon. En outre, Dieu fait jeter les dés, si ceux assez particulières. Un dé réelle jet peut être complètement comprise à la mécanique classique, et le résultat est simplement une fonction des conditions initiales. Cependant le résultat de jeter les dés quantiques n'a pas antécédent; aucune cause ou une explication à tout.
Interpr??tations
Selon le principe de correspondance et le théorème d'Ehrenfest comme un système devient plus grand ou plus massive ( l'action >> h ) la dynamique classique tend à émerger, à quelques exceptions près, comme superfluidit??. cela, nous pouvons généralement ignorer la mécanique quantique lorsqu'ils traitent avec des objets de tous les jours; la place de la description classique suffira. Même si, en essayant de donner un sens de la théorie quantique est un processus continu qui a engendré un certain nombre de interprétations de la théorie quantique, allant du classique interprétation de Copenhague à variables cachées et de nombreux mondes. Il semble y avoir aucune fin en vue pour les réflexions philosophiques sur le sujet; Cependant le succès empirique ou technique de la théorie est incomparable; toutes les théories physiques fondamentales sont modernes théories quantique, la relativité étant englobés dans les théories quantiques des champs.