Eutrophisation
L'eutrophisation (du grec eu : « bien, vrai » et trophein : « nourrir ») est le processus par lequel des nutriments s'accumulent dans un milieu et/ou un habitat (terrestre et/ou aquatique[1],[2]).
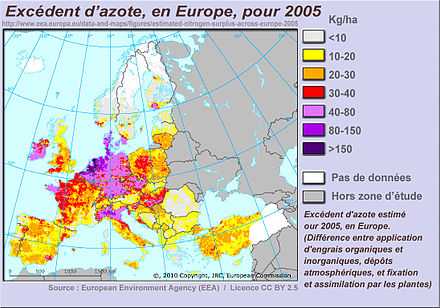
(ici pour 2005, selon les données disponibles de la Commission européenne et de l'Agence européenne de l'environnement)
Le degré d'eutrophisation décrit l'état trophique (agronomique ou écologique) d'un milieu terrestre ou aquatique ou d'un agroenvironnement où des êtres vivants sont exposés à un « excès » chronique de nutriments[1]. Quand elle a une origine anthropique, depuis les révolutions agricoles et industrielles, l'eutrophisation apparait généralement conjointement à une acidification du milieu, qui peut aussi rendre les espèces plus vulnérables à certaines pollutions et maladies[2]. Dans les cas extrêmes, on parle de dystrophisation.
Elle existe localement dans la nature (dans les milieux dits eutrophes et mésotrophes), mais quand elle est anormalement active sur des milieux naturellement pauvres en nutriments elle est considérée comme un phénomène indésirable, voire dangereux pour la biodiversité car l'eutrophisation favorise quelques espèces des milieux « riches » et à croissance rapide (et souvent envahissantes[3]), au détriment de la biodiversité quand elle affecte des milieux naturellement non-eutrophe. Elle pose aussi des problèmes de Santé environnementale.
Dans les milieux aquatiques, l'eutrophisation peut être source de phénomènes épisodiques ou chroniques d'anoxie (eau) du milieu et d'étouffement puis de mort de nombreuses espèces, car dans l'eau, ces nutriments dopent la production de phytoplancton et de quelques espèces aquatiques, en augmentant la turbidité et la sédimentation, ce qui prive le fond et la colonne d'eau de lumière et peut causer l'anoxie périodique ou chronique du milieu, en favorisant des biofilms bactériens et des bactéries dont certaines (cyanophycées) pouvant sécréter des toxines.
L'eutrophisation a des coûts sociaux-environnementaux[4] et juridiques et financiers[5] importants.
Les nutriments concernés sont principalement l'azote (provenant surtout des nitrates agricoles et des eaux usées, et secondairement de la pollution automobile), et le phosphore (provenant surtout des phosphates agricoles et des eaux usées). L'ensoleillement et/ou la température de l’eau (qui tend à augmenter avec le dérèglement climatique) peuvent exacerber l'eutrophisation.
Histoire sémantique du concept d'eutrophisation
Au contraire d'un milieu oligotrophe (mot désignant un milieu naturellement pauvre en éléments nutritifs), un milieu est dit eutrophe quand il est naturellement riche en éléments nutritifs, sans que cela interfère négativement avec ses fonctions écosystémiques et les services écosystémiques fournis par le milieu.
À partir des années 1970, alors que les milieux cultivés, semi-naturels et naturels étaient régulièrement enrichis en engrais ou modifiés par des apports d'eaux usées, de boues d'épuration et retombées atmosphériques riches en azote[6], le terme eutrophisation a été inventé et utilisé pour qualifier la dégradation des grands lacs comme le lac d'Annecy[7], le lac du Bourget, le Lac de Nantua ou le lac Léman[8] par excès de nutriments (de même pour les réservoirs de barrages[9],[10]). Au début du XXIe siècle, il a un sens proche de dystrophie et vient souvent comme qualificatif de sens négatif pour des milieux aquatiques d'eau douce ou marins.
Un milieu aquatique pauvre en éléments nutritifs est dit oligotrophe ; dans le cas intermédiaire, on qualifie le milieu de mésotrophe. Les facteurs naturels produisent des milieux plus ou moins chargés en nutriments (hors de toute intervention humaine) ; l'état d'eutrophisation d'un milieu aquatique doit donc être apprécié en fonction du contexte naturel et ne peut pas se baser sur des indicateurs absolus.
Les causes de l'eutrophisation

L'eutrophisation devient un problème écologique (et économique) quand il y a déséquilibre entre un apport (excessif) et la consommation naturelle de nutriments par l'écosystème :
- azote, principalement issue d'une « pollution diffuse »[11], introduit dans le milieu terrestres et/ou aquatique sous trois formes minérales qui sont l’ammonium (ou azote ammoniacal, le plus directement et rapidement toxique pour les organismes aquatiques), les nitrites (ou azote nitreux) et les nitrates (ou azote nitrique), chacune de ces formes ayant une écotoxicité et une toxicité différente),
- carbone (carbonates, hydrogénocarbonates, matières organiques…)
- phosphore, qui est généralement le facteur limitant dans les milieux naturels d'eau douce (tandis que l'azote est limitant en milieu marin (loi de Liebig). Ce sont souvent les phosphates (orthophosphates, polyphosphates) qui permettent l'emballement du processus, mais le taux de saturation en phosphore n'est pas à lui seul un bon indicateur de risque[12].
Ce milieu déséquilibré est dit dystrophe et peut devenir hypertrophe. Pour les trois nutriments évoqués ci-dessus, des variations de conditions du milieu abiotique (oxydo-réduction) ou biotique (sous l'influence de l'activité bactérienne et des racines, ainsi que du métabolisme végétal, fongique et animal) peuvent faire passer l'azote, le carbone et le phosphore de l'une de leurs formes à une autre. Or ces formes sont plus ou moins toxiques ou écotoxiques.
C'est dans les années 1960 avec la subite et rapide dégradation des lacs en aval de zones fortement urbanisées qu'on a pris conscience de ce phénomène[13].
Ce processus a comme principales origines :
- des épandages agricoles de fumiers, lisiers ou engrais chimiques trop fréquents ou trop concentrés (en azote et phosphore). Une carence en potassium peut parfois aussi être en cause ;
- des rejets industriels et/ou urbains d'eaux usées ou de boues d'épuration trop riches en nitrates, ammonium, phosphore et matières organiques incomplètement traitées ;
- la déforestation et les coupes rases qui aggravent le ruissellement du phosphore (doublement ou triplement des teneurs de l'eau en aval après la coupe au Québec selon Carignan et al, 2000 et des nitrates (augmentation d'un facteur 6 au Québec), et les incendies de forêts qui sont suivis d'une augmentation des nitrates dans l'eau de ruissellement (jusqu'à 60 fois plus, selon des mesures faites au Canada)[14],[15],[16] ;
- l'adjonction de polyphosphates dans les lessives...
La conjonction de ces phénomènes a fait de l'eutrophisation un processus fréquent, atteignant même les zones océaniques, pouvant provoquer l'extension de zones mortes), ou le développement d'algues toxiques, telles Dynophysis, sur les littoraux, par exemple en Bretagne (France). Dans certaines régions, comme en Bretagne, les marées vertes et certaines algues toxiques semblent principalement dues au rejet du lisier provenant de l'élevage porcins (densément implanté en Bretagne)[17].
Dans l'acception courante, l'eutrophisation est donc souvent synonyme de pollution, bien que cette dernière puisse revêtir bien d'autres aspects : contamination biologique (bactéries, parasites…), chimique (pesticides, métaux, solvants…) ou physique (chaleur, radionucléides…).
La pêche en milieux fermés ou cours d'eau très lents (canaux notamment) est une cause d'eutrophisation voire d'anoxie (eau) lorsque les réempoissonnements sont excessifs et/ou que des boules d'amorce riches en nutriments sont jetées dans des étangs fermés, canaux ou cours d'eau à courant lent (cause de turbidité). Une étude récente a montré que la pêche en mer est aussi à l'origine d'un impact important sur le cycle marin de l'azote.
Milieux touchés

Bien qu'il puisse aussi contenir des nutriments (nitrates, rabattus au sol par les pluies notamment), on ne parle pas d'eutrophisation de l'air (ou de l'atmosphère), car l'air n'est pas considéré comme un milieu vivant ou un habitat où une espèce pourrait accomplir la totalité de son cycle de vie en tant que tel. Le cycle de l'azote est néanmoins un cycle biogéochimique qui se déroule dans les trois milieux eau-air-sol et à leurs interfaces[18].
De manière générale, la notion d'eutrophisation décrit une modification ou une altération écologique du milieu (qui est à la fois une source et une conséquence) [19]. Dans ce domaine (comme dans d'autres[20], il existe un lien fort entre "eau" et "sol" notamment car les nitrates sont particulièrement solubles dans l'eau (qui est le vecteur principal de l'azote et du phosphore dans la plupart des cas d'eutrophisation ou de dystrophisation).
La notion d'eutrophisation décrit aussi les « réponses » de l'écosystème et du milieu concernés à l'apport de nutriments « supplémentaires ». On distingue généralement l'eutrophisation des sols et l'eutrophisation des milieux aquatiques, mais l'eau et les sols sont en interactions constantes du point de vue des échanges de nutriments et du cycle biogéochimique des nutriments. Les végétaux et les bactéries jouent un rôle majeur dans ces cycles.
Certains scientifiques vont cependant plus loin et n'hésitent pas à parler d'une eutrophisation généralisée de la biosphère (Peterson, B. J., & Melillo, J. M. (1985). The potential storage of carbon caused by eutrophication of the biosphere. Tellus B, 37(3), 117-127), ce qui ne signifie pas qu'elle soit homogène (et dans un contexte général d'eutrophisation, il peut exister des sols dont les complexes argilo-humiques ont été dégradés qui se sont appauvris en nutriments).
L'eutrophisation des milieux aquatiques et des zones humides
Pour l’OCDE l'eutrophisation de l'eau est l' « enrichissement des eaux en matières nutritives qui entraîne une série de changements symptomatiques, tels que l’accroissement de la production d’algues et de macrophytes, la dégradation de la qualité de l'eau et autres changements symptomatiques considérés comme indésirables et néfastes aux divers usages de l'eau »[21].
Elle peut concerner ou affecter les eaux douces (les plus concernées car proches des sources anthropiques de nitrates et phosphates), mais aussi saumâtres et salées (marines ou intérieures), le milieu marin (profond ou superficiel), des berges ou des sédiments, et en particulier :
- les eaux dormantes (mares riches en feuilles mortes ou collectant des eaux usées, des eaux polluées par des engrais, étangs, lacs, lagunes[22]..);
- les cours d'eau ayant un débit faible ou qui accueillent des effluents trop riches ou en trop grandes quantités issus par exemple, d'exploitations agricoles, humaines ou industrielles;
- les estuaires, golfes, baies et autres étendues semi-fermées où l'eutrophisation est plus visible. Cette eutrophisation est en partie due au fait que ces milieux sont situés à l'aval des bassins versants qui drainent de grandes quantité de nutriments, surtout quand le ruissellement y a été accentué par les activités humaines (labour, drainage, déforestation, imperméabilisation, etc). Ainsi l'ONU alertait en 2003 dans son rapport GEO 3 sur le fait qu'en 1998, plus de 60 % des estuaires et baies des États-Unis étaient « modérément ou gravement dégradés par la contamination causée par les éléments nutritifs », en particulier à cause des apports d'azote principalement[23]. Une centaine de zones mortes sont apparues en mer, en aval des estuaires. La plus grande mesure plus de 20 000 km2, en aval du Mississippi.
L'eutrophisation des milieux terrestres
Tout sols vivant et fonctionnels contient au moins un peu d'eau. Les plantes terrestres pompent de l'azote et du phosphore dans l'eau, et les sols perdent une partie de leurs nutriments dans l'eau, qui transportent aussi de l'azote et du phosphore issu des excrétas, excrément, urines et de la décomposition de la matière organique et de la nécromasse.
Un phénomène général d'« eutrophisation des sols » naturels et agricoles[24] est constaté dans une grande partie du monde par les agronomes et pédologues[25] dont en France par l'INRA[25],[26] et plus largement en Europe et dans tous les pays riches. Le droit européen de l'environnement prend ce problème en compte via notamment la Directive cadre sur l'eau, la Directive nitrate et des « plafonds d'émission nationaux de certains polluants atmosphériques »[27] et la lutte contre les pollutions transfrontières [28].
Dans le monde de la Recherche, les spécialistes du domaine, à l'INRA et à l'Irstea par exemple en France cherchent aussi à mieux comprendre les processus d'« eutrophisation des sols » [29] ; Des chercheurs alertent sur le fait que le développement de solutions présentées comme vertes (agrocarburants par exemple) peut aussi contribuer à aggraver l'eutrophisation[24].
Les espèces qui profitent le plus de l'eutrophisation sont souvent aussi des « mange-lumière » (c'est-à-dire qu'elles inhibent le développement des autres espèces en les privant de lumière [30].
Des relations complexes existent entre l'azote et le phosphore[31], avec des relations d'aggravation ou au contraire de pondération du phénomène d'eutrophisation (selon les conditions biogéochimiques [32] et édaphiques qui semblent également jouer un rôle atténuateur, neutre ou aggravant selon les cas [33]
Le processus
L'eutrophisation peut se décomposer en plusieurs étapes :
- des nutriments phosphorés et azotés, notamment des orthophosphates et nitrate, sont déversés en grande quantité dans le milieu aquatique;
- les eaux ainsi enrichies permettent la multiplication rapide d'espèces aquatiques (efflorescence algale, ou bloom), en particulier la prolifération d'algue ou de Cyanobactéries[34]. Ces espèces sont difficilement éliminées par les organismes présent dans l'écosystème[35]. Elles vont donc se minéraliser et tomber au fond du milieu aquatique;
- la décomposition de la matière organique morte favorise la croissance des bactéries hétérotrophes qui consomment de l'oxygène dissout. Le dioxygène étant très limité dans l'eau (environ 30 fois moins que dans le même volume d'air), celui-ci est rapidement épuisé. Le développement éventuel de plantes flottantes — telles les lentilles d'eau (Lemna sp.), empêche le passage de la lumière et donc l'effet naturellement désinfectant des UV solaires, ainsi que la production photosynthétique d'oxygène dans les couches d'eau inférieures, tout en gênant les échanges gazeux avec l'atmosphère. La consommation d’O2 devient supérieure à la production d’O2;
- le milieu devient alors facilement hypoxique puis anoxique, favorable à l'apparition de composés réducteurs et de gaz délétères (thiols, méthane);
- des synergies aggravantes sont fréquentes avec l'acidification des océans, l'acidification des sols et le phénomène dit de pluies acides notamment observée dans les landes et en Forêt[36]. L'acidification, comme l'eutrophisation touche à la fois des milieux terrestres et aquatiques, parfois à longue distance via des apports aéroportés d'eutrophisants qui contribuent à des phénomènes d'eutrophisation transfrontaliers[37], via les précipitations notamment (cf Galloway, J. N., & Cowling, E. B. (1978). The effects of precipitation on aquatic and terrestrial ecosystems: a proposed precipitation chemistry network. Journal of the Air Pollution Control Association, 28(3), 229-235.)
Les oiseaux d'eau via leurs fientes et en raison de densité de population pouvant être très élevées sur les points migratoires et les zones de nidifications contribuent (via leur alimentation à la dispersion de leurs fientes) à transporter des nutriments d'un point à un autre, avec des effets tantôt localement réducteurs ou tantôt aggravants de l'eutrophisation[38]
Il peut en résulter des processus listés ci-dessus la mort d'organismes aquatiques aérobies — insectes, crustacés, poissons, mais aussi végétaux —, dont la décomposition, consommatrice d'oxygène, amplifie alors le déséquilibre et entretient un cercle vicieux (Zone morte).
Effets



Les effets d'un enrichissement en nutriments sont plus ou moins visibles et graves selon le milieu qu'elle affecte. Une partie de ces effets est réversible, et une autre définitive (c'est par exemple le cas pour le processus d'accélération de la transformation des zones humides ou lacs peu profonds en marais, puis en prairie ou en mégaphorbiaies et finalement en forêt ; Le comblement d'une mare ou d'un marais peut être fortement accéléré par l'apport de nutriments « artificiels », avec d'autres facteurs connexes à l'occupation humaine à prendre en compte ; dont par exemple la présence d'arbres au-dessus de l'eau (source de feuilles mortes) et/ou l'absence du spectre faunistiques naturel de l'eau et des berges qui se nourrissait dans l'eau tout en exportant les nutriments (par exemple, amphibiens, canards ou élan mangeant des algues, des invertébrés et des plantes aquatiques, par dizaines de kilogrammes par jour dans le cas de l'élan). L'atterrissement d'une petite mare en sous-bois peut se faire en quelques décennies, alors que les lacs naturels se comblent eux en dizaines de milliers voire en millions d'années). La disparition d'une espèce si elle concerne toute son aire de répartition est également irréversible.
Les inconvénients principaux de l'eutrophisation sont la diminution de la biodiversité et de la qualité de l'eau en tant que ressource.
Elle a aussi indirectement des effets négatifs sur le tourisme (à la suite de la perte de transparence de l'eau, du développement d'algues filamenteuses et de blooms planctoniques dans l'eau, et d'une flore banale et peu diversifiée sur terre, avec souvent l'apparition d'odeurs putrides et de phénomènes d'envasement, qui sont quelques-uns des indices visibles de problèmes trophiques :
- augmentation du volume de microalgues et d'algues fixées ou en suspension[39];
- augmentation de la biomasse du zooplancton gélatineux;
- dégradation des qualités organoleptiques de l'eau (aspect, couleur, odeur, saveur);
- envasement plus rapide et apparition de vase putride, sombre et malodorante source de méthane;
- développement de phytoplancton ou bactéries cyanophycées éventuellement toxique;
- développement de pathogènes par diminution de la pénétration des UV solaires (qui ont un pouvoir désinfectant);
- diminution d'indice biotique;
- diminution de la biodiversité (animale, fongique et végétale) sur terre, et de la biodiversité marine en mer [40];
- diminution du rendement de la pêche (quoique l'effet puisse être contraire).
Parfois les algues peuvent boucher les prises d'eau, les filtres, entraver le fonctionnement d'écluses voire du moteur de petits bateaux pour les algues filamenteuses
Coûts économiques
Outre le gaspillage financier dû au lessivage des engrais chimiques par les pluies et le ruissellementou à l'évaporation d'une partie des nitrates dans l'air.
A titre d'exemple :
- une évaluation a porté à 2,2 milliards de dollars (1,75 milliard d’euros) le coût annuel de l’eutrophisation par l’azote et le phosphore aux États-Unis, ceci pour les seules eaux douces et hors coûts induits par la dégradation des ressources halieutiques et zones mortes liée aux blooms planctoniques et pullulations d’algues, qui n’ont pu être chiffrés ; En 2007 dans ce pays, 90 % des rivières dépassaient pour leur taux d’azote et de phosphore les seuils de l’EPA et toutes les écorégions étaient touchées. Les valeurs-seuil ont été dépassées en 2007 dans 12 des 14 écorégions. Les coûts pris en compte sont ceux des pertes d’usages récréatif et de valeur immobilière des berges de lacs et eaux eutrophes, ainsi que les coûts d’épuration, de gestion et restauration des milieux et des coûts liés la perte de biodiversité[41]).
- Une autre étude, conduite par 200 experts, issus de 21 pays d'Europe, a chiffré le coût des effets de la pollution azotée sur l'air, les sols et les écosystèmes, et la santé environnementale en Europe à 70 à 320 milliards d’euros par an ; soit entre 150 et 735 euros par personne et par an ; C'est plus que le double du bénéfice estimé apporté à l'agriculture[42]. Selon les auteurs, « réduire notre consommation de protéines animales -qui dépasse de 70 % les recommandations nutritionnelles- aurait un impact significatif. 80 % de l'azote utilisé en agriculture sert en effet à produire de la nourriture pour l'élevage » et moins se déplacer en véhicule polluant, et changer les pratiques agricoles permettrait d'importants progrès.
Le cas des grands lacs
Dans les années 1950 à 1970, les Grands Lacs d'Amérique du Nord étaient devenus les déversoirs naturels d'égouts des villes riveraines et de l'amont et du ruissellement agricole des bassins environnant.
Riche en azote et en phosphore, l'urine des habitants suffisait à fortement dégrader la qualité du milieu aquatique. À cela s'ajoutaient d'autres pollutions comme celles liées au lessivage des intrants agricoles et celles issues des nombreux engins à moteur de l'époque, très polluants, qui pouvaient contaminer les eaux par le lessivage de leurs fumées et leurs rejets d'huile et de plomb tétraéthyle.
Les remèdes (déseutrophisation)

Les castors, en ouvrant des clairières tout en en faisant remonter le niveau de l'eau, ont créé les conditions favorables à une haute strate herbacée appréciée des grands herbivores. Castors et élans limitent ici conjointement l'eutrophisation de l'eau (de même que les risques de sécheresse, d'inondation en aval et d'incendie de forêt)
Les symptômes de l'eutrophisation révèlent que l'apport en un ou plusieurs nutriment(s) atteint ou dépasse la capacité immédiate des plantes et de l'écosystème à les absorber. Autrement dit : la limite des capacités auto-épuratrice des milieux aquatiques ou du sol et de l'écosystèmes qu'il supporte sont atteintes (momentanément ou de manière chronique).
Divers moyens de lutte et d'atténuation (« déseutrophisation »[43]) sont nécessaires et existent, d'abord testé pour les lacs, dont en France[44],[45] ; ils consistent par exemple[21],[46] à :
- supprimer l'utilisation excessive d'eutrophisants en amont du bassin versant, notamment en utilisant des engrais verts (légumineuses en particulier[47]), ce qui ne règle cependant pas le problème des apports aéroportés d'azote issu d'épandages distants), tout en veillant aux respect des équilibres NPK et du rapport C/N ;
- mettre en place des Culture intermédiaire piège à nitrates (CIPAN)
- diminuer l'utilisation de pesticides et leur arrivée dans les cours d'eau où, en tuant de nombreux organismes, ou en limitant la flore "supérieure", ceux-ci peuvent contribuer à aggraver l'eutrophisation ou à l'induire ;
- utiliser plus rationnellement les engrais en agriculture (analyser la valeur agronomique des sols et privilégier les engrais naturels); et utiliser moins d'engrais rapidement solubles dans l'eau, ce qu'encourage en France le programme Fertimieux et en Europe certaines mesures agrienvironnementales ;
- aménager des bassins versants en y reconstituant des réseaux de bocage, talus, haies, et bandes enherbées, suffisants en taille et cohérents avec le relief et la pédologie ; le ruissellement des eaux pluviales peut favoriser l'entrainement de nutriments comme le phosphore qui seront mieux retenus si les capacités d'infiltration du sol et sa teneur en complexes argilohumiques sont restaurées;
- protéger et restaurer des zones-tampon (idéalement combinant une ripisylve et des bandes enherbées) entre les champs et les cours d'eau;
- remplacer partout les phosphates des lessives par des agents anti-calcaires sans impact sur l'environnement, telles les zéolites.
- mieux éliminer l'azote et le phosphore dans des stations d'épuration (qui peuvent être équipées de procédés de dénitrification et de déphosphatation[48]) et de lagunage tertiaire ou fonctionner sur le principe du lagunage naturel.
Des systèmes de réoxygénation de l'hypolimnion et de « déstratification »[49] de la masse d'eau retenue par les barrages artificiels (ou de sous-tirage) peuvent aussi être mis en place et modélisés[50]. - Limiter la pollution azotée non agricole (dont les NOx issus des chauffages et chaudières industrielles, et issus de la pollution automobile et routière.
- utiliser des indicateurs de déseutrophisation. On cherche à mettre au point un test efficace de « déphosphatation biologique », par exemple basé sur les Acides gras volatils ou « AGV »[51].
- Planifier à large échelle la lutte contre les blooms d'algues vertes et les marées vertes et contre le « transfert diffus du phosphore dans les bassins agricoles »[52]
Les traitements algicides ne sont pas une solution, et certains traitemens à base de carbonate de calcium sous forme de craie pulvérisée ou de sable corallien sont discutés ou controversés[53],[54],[55] car s'ils suppriment (très provisoirement) le « symptôme », ils relarguent dans le milieu une grande partie des nutriments contenus par les algues, ou facilitent l'évacuation de la vase vers l'aval, mais en déplaçant alors le problème vers l'aval, ce déplacement pouvant en outre être freinée par les plantes aquatiques).
De manière générale, il faut d'abord bien connaître le fonctionnement des cycles biogéochimiques dans les écosystèmes concernés, et donc le fonctionnement et l'état du réseau trophique ainsi que la rémanence (stock du sol[12] et stock sédimentaire dont le rôle ne doit pas être sous-estimé[56],[57][58]...) et l'importance des sources de nutriments (dont sources cachées ou discrètes telles que les apports d'azote via les eaux météoritiques, ou les apports d'azote et de phosphore via fuites d'égouts, le drainage de zone dystrophes, des épandages illégaux ou non déclarés, etc.), que l'on commence à savoir modéliser[59]
Prospective
L'azote met jusqu'à plusieurs décennies pour percoler du sol aux nappes phréatiques, et il peut remonter capillairement avec l'eau et/ou diffuser horizontalement dans les nappes, sur des centaines de kilomètres.
La dénitrification et le cycle de l'azote seront influencés par la productivité végétale, par les changements de température de l'air de l'eau et du sol et par de probables changements dans les précipitations (force et distribution)[60].
Les teneurs du sol en matière organique et les taux atmosphériques de dioxyde de carbone auront aussi une incidence sur la persistance ou le lessivage des nitrates agricoles, via les modes de travail du sol (agriculture sans labour ou avec labour…, avec ou sans bandes enherbées ou zones-tampon. Les modifications pédologiques (y compris via les populations de vers de terre par exemple affectées par les pesticides ou métaux lourds). Nombre de ces facteurs seront contrôlés en partie par un probable dérèglement climatique[60] qui aura indirectement un impact sur la dénitrification des sols. La production urbaine d'émissions azotées pourrait aussi augmenter (transport, chauffage). Certains scénarios tendanciels prévoient une augmentation du lessivage des nitrates avec des conséquences allant d'une augmentation limitée à un doublement possible des taux de nitrates dans les aquifère en 2100. Ces changements peuvent être en partie masqués par des réductions de nitrate permises par des améliorations des pratiques agricoles[60]. Les chercheurs invitent à envisager des mesures d'adaptation[60].
Voir aussi
Articles connexes
- Cycle de l'azote, Cycle du phosphore
- Pollution azotée
- Marée verte
- Directive Nitrates
- Pollution de l'eau
- Bloom planctonique
- Dystrophisation
- Anoxie
- Zone morte
- Événement anoxique océanique
- Turbidité
- Nitrates, phosphates
- Munitions immergées
- Observatoire de l'eau
- Bon état écologique
- Fertimieux
Liens externes
- Lac en danger
- (en) page d'accueil atlas paneuropéen sur les eutrophisants (en anglais)
Bibliographie
- Chassande I (1998) La politique française de maîtrise des pollutions azotées: La nitrification tertiaire par cultures fixées. TSM. Techniques sciences méthodes, génie urbain génie rural, (3), 9-12.
- Daloz, A., Gaertner-Mazouni, N., Barral, M., Malet, N., Moragues, L., Fiandrino, A., ... & Munaron, D. (2009, December). Le Réseau de Suivi Lagunaire: un outil de diagnostic et d’aide à l’action pour la lutte contre l’eutrophisation des lagunes. Une stratégie d’information et de transfert aux acteurs. In 4 th European Conference on coastal lagoon Research (résumé)
- Devidal S, C. Rivard-Sirois, M-F. Pouet, O. Thomas, (2007), Solutions curatives pour la restauration de lacs présentant des signes d’eutrophisation, rapport interne, Observatoire de l’environnement et du développement durable, Université de Sherbrooke – RAPPEL, Sherbrooke, Québec, Canada (PDF, 51 pages)
- Lacaze JC (1996) L’eutrophisation des eaux marines et continentales, Ellipses, 191p
- Renneson, M., Vandenberghe, C., Marcoen, J. M., Bock, L., & Colinet, G. (2009) Évaluation de la pertinence du taux de saturation en phosphore en tant qu'indicateur de bonnes pratiques en matière de fertilisation phosphorée dans les sols agricoles en Région wallonne (Belgique). Actes des 10èmes journées d'étude des sols.
- Saunier B & Le Saout M (1985) Bilan des substances nutritives dans les retenues d'eau. Contrôle de l'eutrophisation. Techniques et sciences municipales (1971), (6), 276-288.
- Timstit C., 1997, Le traitement du phosphore constitue-t-il une bonne réponse aux risques d’eutrophisation ? ENGREF, Montpellier, 9 p.
- TSM La nitrification tertiaire par cultures fixées, 1998 - 64 pages
- T'Seyen J (1986) Élimination du phosphore des eaux résiduaires par voie biologiques: activité de la polyphosphate-kinas: utilisation d'une phase acidogène en amont d'un système de type" Phoredox modifié" (Doctoral dissertation, Metz).
Références
- 1 2 Smith, V. H., Tilman, G. D., & Nekola, J. C. (1999). Eutrophication: impacts of excess nutrient inputs on freshwater, marine, and terrestrial ecosystems. Environmental pollution, 100(1), 179-196
- 1 2 Bouwman, A. F., Van Vuuren, D. P., Derwent, R. G., & Posch, M. (2002). A global analysis of acidification and eutrophication of terrestrial ecosystems. Water, Air, and Soil Pollution, 141(1-4), 349-382 (résumé)
- ↑ Dutartre, A. (2004). De la régulation des plantes aquatiques envahissantes à la gestion des hydrosystèmes. Ingénieries, Numéro spécial, 87-100.
- ↑
- ↑
- ↑ Bobbink, R., Boxman, D., Fremstad, E., Heil, G., Houdijk, A. L. F. M., & Roelofs, J. (1992). Critical loads for nitrogen eutrophication of terrestrial and wetland ecosystems based upon changes in vegetation and fauna [alpine heathlands, deposition]
- ↑ Carlet Y (1985) Lutte contre l'eutropoisation des lacs : exemple d'une réussite, le Lac d'Annecy (Thèse de doctorat).
- ↑ Gerdeaux D, Lods-Crozet B, Loizeau JL & Rapin F (2013) Le Léman, du diagnostic aux nouveaux enjeux de protection. Archives des Sciences, 66(2), 101 (résumé).
- ↑ S.O.Ryding et W.Rast (1994) Le contrôle de l’eutrophisation des lacs et des réservoirs, Masson, Unesco, 294p.
- ↑ UNEP International Environmental Technology Centre (2000) Planning and management of lakes and reservoirs : an integrated approach to eutrophication, Technical publication series, 67p.
- ↑ Merceron, M. (Ed.) (1999) Pollutions diffuses: du bassin versant au littoral Actes d'un colloque, Ploufragan (Saint-Brieuc),[23-24] Septembre 1999 (Vol. 24). Editions Quae.
- 1 2 Renneson, M., Vandenberghe, C., Marcoen, J. M., Bock, L., & Colinet, G. (2009) Évaluation de la pertinence du taux de saturation en phosphore en tant qu'indicateur de bonnes pratiques en matière de fertilisation phosphorée dans les sols agricoles en Région wallonne (Belgique). Actes des 10èmes journées d'étude des sols
- ↑ Vollenweider R.A., 1968, Les bases scientifiques de l’eutrophisation des lacs et des eaux courantes sous l’aspect particulier du phosphore et de l’azote comme facteurs d’eutrophisation. Paris, OCDE, Rapport technique DAS/CIS 68-27, 250 p.
- ↑ Carignan R, D’Arcy P & Lamontagne S (2000) Comparative impacts of fire and forest harvesting on water quality in Boreal Shield lakes, Canadian Journal of Fisheries and Aquatic science, v57, suppl 2, pp105-117 ([http://www.nrcresearchpress.com/doi/abs/10.1139/f00-125 résumé).
- ↑ Steedman RJ (2000) Effects of experimental clearcut logging on water quality in three small boreal forest lake trout (Salvelinus namaycush) lakes. Canadian Journal of Fisheries and Aquatic Sciences, 57(S2), 92-96. (résumé)
- ↑ Lamontagne, S., Carignan, R., D'Arcy, P., Prairie, Y. T., & Paré, D. (2000). Element export in runoff from eastern Canadian Boreal Shield drainage basins following forest harvesting and wildfires. Canadian Journal of Fisheries and Aquatic Sciences, 57(S2), 118-128.
- ↑ Institut français de l’environnement (IFEN), 1999 L’eutrophisation des rivières en France : où en est la pollution verte? , n° 48, octobre 1999, 4p
- ↑ Gruber, N., & Galloway, J. N. (2008). http://www7.inra.fr/acassya/content/download/2893/28861/version/1/file/nature-Gruber-Galloway-2008.pdf An Earth-system perspective of the global nitrogen cycle]. Nature, 451(7176), 293-296.
- ↑ Vitousek, P. M., Aber, J. D., Howarth, R. W., Likens, G. E., Matson, P. A., Schindler, D. W., ... & Tilman, D. G. (1997). Human alteration of the global nitrogen cycle: sources and consequences. Ecological applications, 7(3), 737-750.)
- ↑ G. E., & Bormann, F. H. (1974). Linkages between terrestrial and aquatic ecosystems. BioScience, 24(8), 447-456
- 1 2 Galvez-Cloutier, R., Ize, S., & Arsenault, S. (2002). Manifestations et moyens de lutte contre l’eutrophisation. Vecteur environnement, 35(6), 18 (PDF, 20 pages)
- ↑ Daloz, A., Gaertner-Mazouni, N., Barral, M., Malet, N., Moragues, L., Fiandrino, A., ... & Munaron, D. (2009, December). Le Réseau de Suivi Lagunaire: un outil de diagnostic et d’aide à l’action pour la lutte contre l’eutrophisation des lagunes. Une stratégie d’information et de transfert aux acteurs. In 4 th European Conference on coastal lagoon Research.
- ↑ page ONU de GEO 3 sur l'eutrophisation (d'après chiffres de NOAA, 1998 ; Howarth et al. 2000)
- 1 2 (avec par exemple la notion d' "eutrophisation des sols utilisables." citée ici dans un article intitulé "Nouvelles données sur le bilan écologique des biocarburants"...
- 1 2 http://www7.inra.fr/internet/Directions/DIC/ACTUALITES/NATURE/pdf/foretsols.pdf (voir page 1/3)
- ↑ Les réflexions d'un ancien Chercheur de l'INRA sur l'environnement, la démographie, le Darwinisme...
- ↑ exemple 1 avec Europa.eu/communiqué de presse intitulé "La Commission propose des plafonds d'émission nationaux de certains polluants atmosphériques et des objectifs de qualité de l'air ambiant pour l'ozone", daté de 1999
- ↑ EurLex "La pollution transfrontière contribue à l'acidification, à l'eutrophisation des sols et à la formation de l'ozone au sol dont la réduction exige une action ")
- ↑ N° 2348 - Trames forestières et biodiversité floristique : rôles ... / voir 1ère phrase du résumé
- ↑ Hautier, Y., Niklaus, P. A., & Hector, A. (2009). Competition for light causes plant biodiversity loss after eutrophication. Science, 324(5927), 636-638.
- ↑ Vitousek, P. M., Porder, S., Houlton, B. Z., & Chadwick, O. A. (2010). http://www.researchgate.net/publication/42637769_Terrestrial_phosphorus_limitation_mechanisms_implications_and_nitrogen-phosphorus_interactions/file/50463529cc6d5909ef.pdf Terrestrial phosphorus limitation: mechanisms, implications, and nitrogen-phosphorus interactions]. Ecological applications, 20(1), 5-15.)
- ↑ Asner, G. P., Townsend, A. R., Riley, W. J., Matson, P. A., Neff, J. C., & Cleveland, C. C. (2001). Physical and biogeochemical controls over terrestrial ecosystem responses to nitrogen deposition. Biogeochemistry, 54(1), 1-39.
- ↑ LeBauer, D. S., & Treseder, K. K. (2008). Nitrogen limitation of net primary productivity in terrestrial ecosystems is globally distributed. Ecology, 89(2), 371-379.(résumé
- ↑ http://www.eaubretagne.fr/Pollutions-et-menaces/Impacts-des-pollutions/L-eutrophisation/Effets-de-l-eutrophisation-des-eaux-sur-la-sante-l-economie-et-les-milieux-aquatiques
- ↑ http://webworld.unesco.org/water/ihp/db/glossary/glu/FRDIC/DICEUTRO.HTM
- ↑ Thimonier, A., Dupouey, J. L., Bost, F., & Becker, M. (1994). Simultaneous eutrophication and acidification of a forest ecosystem in North‐East France. New Phytologist, 126(3), 533-539.)
- ↑ Matson, P., Lohse, K. A., & Hall, S. J. (2002). The globalization of nitrogen deposition: consequences for terrestrial ecosystems. AMBIO: A Journal of the Human Environment, 31(2), 113-119.)
- ↑ Dobrowolski K.A, Halba R & Nowicki J (1976) The role of birds in eutrophication by import and export of trophic substances of various waters ; Limnologica, 10 (2) (1976), pp. 543–549
- ↑ Garnier, J., Billen, G., Hanset, P., Testard, P., & Coste, M. (1998) Développement algal et eutrophisation dans le réseau hydrographique de la Seine. La Seine en son bassin: Fonctionnement écologique d’un systeme fluvial anthropisé. Elsevier, Paris, 593-626.
- ↑ Chapelle A (1990) Modélisation d'un écosystème marin côtier soumis à l'eutrophisation: la baie de Vilaine(Sud Bretagne). Etude du phytoplancton et du bilan en oxygène (Doctoral dissertation).(Notice Inist-CNRS)
- ↑ Étude de l’université du Kansas ; Eutrophication of U.S. freshwaters: analysis of potential economic damages, Walter K. Dodds et al., Environmental science and technology (télécharger l'étude, 2011)
- ↑ The European Nitrogen Assessment et publication (ouvrage de 664 pages ; ISBN 9781107006126)
- ↑ La déseutrophisation est définie en 2011 par Le Gall & al. comme une « réduction de l’excès de substances nutritives, de matière organique notamment » in Le Gall, A. H., Jézéquel, I., Bernard, D., & Canard, A. (2011) http://hal.archives-ouvertes.fr/docs/00/61/18/04/PDF/Le_GAll.pdf Rapport d'activité 2008-2010 Culture Scientifique et Technique ; Université de Rennes, voir page 36/76
- ↑ Vinconneau, J. C. (1992). Lutte contre l'eutrophisation en France. Bull. Cons.
- ↑ ex : Lair, N., & Restituito, F. (1976) Projet alpin OCDE pour la lutte contre l’eutrophisation. Lacs du Massif Central français. II. Le lac de Tazénat, interrelations entre paramètres. Ann. Stn Biol. Besse-en-Chandesse, 10, 100-45.
- ↑ Organisation de coopération et de développement économiques, 1982, Eutro- phisation des eaux : méthodes de surveillance, d’évaluation et de lutte, Paris, 164p.
- ↑ Munier‐Jolain N & Carrouée B (2003) Quelle place pour le pois dans une agriculture respectueuse de l'environnement ; Argumentaire agri-environnemental. Cahiers Agricultures, 12(2), 111-120.
- ↑ Montastruc, L., Domenech, S., Pibouleau, L., & Azzaro‐Pantel, C. (2005). Méthodologie d'étude et de modélisation de la déphosphatation d'effluents aqueux. The Canadian Journal of Chemical Engineering, 83(4), 742-754.(résumé)
- ↑ Levet D & Martin X (1988) Lutte contre l'eutrophisation de la retenue du Cébron par déstratification. Premiers résultats. TSM. Techniques sciences méthodes, génie urbain génie rural, (6), 339-344.
- ↑ Gourchane, M. (2001) Contribution à la modélisation mathématique des moyens de lutte contre l'eutrophisation des barrages: Déstratification artificielle et soutirage.
- ↑ Bourdon, C. (2005). Vers une validation du test BAP comme outil de prédiction du rendement de déphosphatation biologique. Créteil (France, 94), Doctorat Sciences de l’environnement, Engref Paris, Ecole polytechnique de Montréal (CAN) ; résumé PDF - 2pages
- ↑ Dorioz, J. M., & Trevisan, D. (2008) Le transfert diffus du phosphore dans les bassins agricoles: ordres de grandeur, mécanismes, maîtrise. Ingénieries-eau, agriculture, territoires, numéro spécial Azote, phosphore et pesticides ; Stratégies et perspectives de réduction de flux, 27-47.
- ↑ Marty C & Sechet J (1982). Action du carbonate de calcium sur la vase d'un étang. I-Essais comparatifs dans l'étang et au laboratoire. Bulletin Français de Pisciculture, (285), 221-232 (résumé).
- ↑ Marty C & Sechet J (1982) Action du carbonate de calcium sur la vase d'un étang. II - Effets d'un épandage en mélange avec la vase Bull. Fr. Piscic. (1983) 288 : 57-67
- ↑ Rofes G (1975) Influence de la craie en poudre sur les fonds envasés en eau courante ONEMA, Bull. Fr. Piscic. (1975) 258 : 1-14
- ↑ Dorioz JM, Pilleboue E & Ferhi A (1989) Dynamique du phosphore dans les bassins versants : importance des phénomènes de rétention dans les sédiments. Water research, 23(2), 147-158 (résumé).
- ↑ Dorioz JM, Pelletier JP, Benoit P (1998) Proprietes physico-chimiques et biodisponibilite potentielle du phosphore particulaire selon l'origine des sediments dans un bassin versant du Lac Leman (France) Physico-chemical properties and bioavailability of particulate phosphorus of various origin in a watershed of Lake Geneva (France) ; Volume 32, Issue 2, February 1998, Pages 275–286(résumé)
- ↑ Abdallaoui, A. (1998) Contribution à l’étude du phosphore et des métaux lourds contenus dans les sédiments et de leur influence sur les phénomènes d’eutrophisation et de la pollution: Cas du bassin versant de l’Oued Beht et de la retenue de barrage El Kansera.
- ↑ Ménesguen A (1999) http://archimer.ifremer.fr/doc/1999/rapport-144.pdf L'utilisation de modèles écologiques dans la lutte contre l'eutrophisation des eaux côtières françaises]. Actes de colloques-IFREMER, 31-48.
- 1 2 3 4 M.E. Stuart, Science of The Total Environment Volume 409, Issue 15, 1 July 2011, Pages 2859-2873 ; doi:10.1016/j.scitotenv.2011.04.016 A review of the impact of climate change on future nitrate concentrations in groundwater of the UK (Résumé)
- Portail de l’eau
- Portail de l’environnement
- Portail de l’écologie
- Portail des lacs et cours d’eau