Phosphate
|
|
Cet article ne cite pas suffisamment ses sources (janvier 2009). Si vous disposez d'ouvrages ou d'articles de référence ou si vous connaissez des sites web de qualité traitant du thème abordé ici, merci de compléter l'article en donnant les références utiles à sa vérifiabilité et en les liant à la section « Notes et références » (modifier l'article, comment ajouter mes sources ?).
|
| Phosphate | |
|---|---|
 Structure tridimensionnelle d'un ion phosphate  Structure d'un groupe phosphate lié à un radical R | |
| Identification | |
| No CAS | |
| PubChem | |
| SMILES | |
| InChI | |
| Propriétés chimiques | |
| Formule brute | PO43− |
| Masse molaire[1] | 94,9714 ± 0,0012 g/mol O 67,39 %, P 32,61 %, |


En chimie inorganique, un phosphate est un sel résultant de l'attaque d'une base par de l'acide phosphorique H3PO4. En chimie organique, c'est un composé organophosphoré dérivé de l'acide phosphorique ; on parle parfois de phosphate organique.
Dosage
La mesure de la concentration en phosphate est basée sur l'apparition du complexe phosphomolybdate d'ammonium (en) qui est détecté par spectrophotométrie dans l'ultraviolet. Les ions chlorure peuvent gêner et doivent être éliminés en faisant bouillir avec deux gouttes d'acide nitrique ; l'addition au réactif molybdique de tartrate améliore la spécificité.
Une solution de molybdate d'ammonium (NH4)2MoO4 mélangée à chaud à de l'acide nitrique 6M et à un phosphate, donne un précipité jaune de phosphomolybdate d'ammonium (NH4)3PO4(MoO3)2.
Les ions argent pour le phosphate donnent un précipité jaunâtre Ag3PO4. L'hydrogénophosphate de sodium donne avec l'ion Ag+ un précipité jaune de phosphate d'argent soluble dans l'acide nitrique et dans l'ammoniaque.
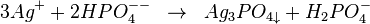
Un protocole de dosage a été validé en France par l'AFNOR[3].
Caractéristiques moléculaires et chimiques
L'ion phosphate (ou orthophosphate) est un anion polyatomique de formule chimique brute PO43- et de masse moléculaire de 94,97 daltons. Il se présente sous la forme d'un tétraèdre dont les sommets sont formés par les quatre atomes d'oxygène encadrant un atome de phosphore.
Cet ion, qui comporte trois charges négatives, est la base conjuguée de l'ion hydrogénophosphate HPO42- (ou phosphate inorganique[4], noté Pi) qui est lui-même la base conjuguée de l'ion dihydrogénophosphate H2PO4- qui est lui-même la base conjuguée de l'acide phosphorique H3PO4. C'est une molécule hypervalente sachant que l'atome de phosphore possède dix électrons libres sur sa couche de valence.
Un sel de phosphate se forme lorsqu'un cation se lie à l'un des atomes d'oxygène de l'ion phosphate, formant un composé ionique. La plupart des phosphates sont insolubles dans l'eau aux conditions standard de température et de pression, excepté pour les sels de métaux alcalins.
Solubilisé dans une solution aqueuse, le phosphate existe sous ses quatre formes selon le taux d'acidité. En allant du plus basique au plus acide :
- la première forme à prédominer est l'ion phosphate (proprement dit) PO43- (fortement basique) ;
- la seconde forme est l'ion hydrogénophosphate HPO42- (faiblement basique) ;
- la troisième forme est l'ion dihydrogénophosphate H2PO4- (faiblement basique) ;
- la quatrième est la forme trihydrogénophosphate (à l'état cristallin non ionisé) ou acide phosphorique H3PO4 (fortement acide en solution).
pKa des couples acide/base précédents[5] [6] :
- HPO42- / PO43- : 12,32 ;
- H2PO4- / HPO42- : 7,09 ;
- H3PO4 / H2PO4- : 2,15.
L'ion phosphate peut former des ions polymères, par exemple :
- diphosphate P2O74− (aussi appelé pyrophosphate) ;
- triphosphate P3O105−.
Les phosphates formant des complexes avec le calcium (contrôle micro-environnemental pendant la (bio-)minéralisation), ils entrent souvent dans la composition des lessives. Riche en phosphore, les rejets lessiviels augmentent donc le risque d'eutrophisation. Depuis les années 1980, les fabricants utilisent donc de plus en plus des substituts, telles les zéolites.
Formation et répartition
Le minerai de phosphate (roche concentrée en sels de phosphate) est une roche sédimentaire dite roche exogène : elle se forme par concentration lorsque des ions phosphate précipitent dans une roche en diagenèse. Les formes biogènes, telles les guanos d'oiseaux et de chauve-souris, sont exploitées depuis des siècles.
Les gisements les plus importants se trouvent au Maroc, plus particulièrement à Khouribga, en Amérique du Nord, sur l'île de la Navasse, en Tunisie, au Togo, en Israël, en Jordanie, en Chine et sur certaines îles d'Océanie : Nauru, Banaba et Makatea.
Utilisations
.jpg)
.jpeg)



Les phosphates sont utilisés dans l'agriculture comme engrais pour enrichir les fruits et légumes en source de phosphore[7]. Ils peuvent également apporter de l'azote (phosphate d'ammonium), la roche phosphatée du calcium (phosphates de calcium) et de l'aluminium (phosphate d'aluminium). Ces engrais peuvent être d'origine organique (poudre d'os, arêtes de poissons, etc.) ou inorganique (attaque d'acide sur du minerai), ce qui est de plus en plus le cas, hormis en agriculture biologique où les engrais de synthèse sont interdits.
Certains engrais phosphatés contiennent des quantités importantes d'uranium, donc de radium et conduisent à une émanation plus importante de gaz radon, précurseur du polonium 210[réf. nécessaire].
Le phosphate se trouve aussi impliqué dans la fermentation vinicole (type de fermentation éthylique).
Le minerai, en général du phosphate de calcium, peut être épandu directement sur les terres acides après avoir été finement broyé. Ayant tendance à se combiner au calcium, ce qui le rend moins assimilable, il doit être rendu plus hydrosoluble avant d'être employé sur les sols calcaires afin d'accroître son assimilation par les plantes.
Dans la structure des êtres vivants les groupes phosphates sont des éléments de la chaîne composant les hélices de l'ADN.
Impacts environnementaux
Les phosphates naturels minéraux (guano ou phosphates d'origine sédimentaire) ont été très utilisés, notamment dans les sols acides où le phosphore est un des nutriments limitant pour les plantes. On les utilise seuls ou plus souvent associés à de l'azote et du potassium (NPK) ; sous forme de super phosphate triple (TSP), le superphosphate simple (SSP), le phosphate diammonique (en) (DAP), phosphate monoammonique (MAP), sous forme sèche ou liquide, etc.
Si les phosphates sont normalement présents et utiles à faible dose dans l'eau et les sols, leur excès est (avec celui des teneurs en nitrates) une des causes majeures de l'eutrophisation voire de dystrophisation de l'environnement.
Ils contribuent notamment aux problèmes de turbidité liés au verdissement des eaux (dont lors de blooms planctoniques) et aux phénomènes de zones marines mortes en aval des estuaires.
Ils sont de plus aussi source de « métaux-lourds », qui sont pour certains éventuellement radioactifs, car le phosphore d'origine minérale est souvent, dans les engrais, associé à des métaux toxiques (cadmium (jusqu'à 87 mg·kg-1 dans un engrais produit au Sénégal[8], le chrome (Cr), le mercure (Hg) et le plomb (Pb), et à des éléments radioactifs, dont l'uranium (U) ; jusqu'à 390 mg·kg-1 dans les mines tanzaniennes de Minjingu contre 12 mg·kg-1 dans le gisement tunisien de Gafsa[8], or le phosphate de Minjingu est agronomiquement très efficace, et peu coûteux, et donc très utilisé sur des sols acides cultivés, ce qui pose des questions toxicologiques et sanitaires pour les ouvriers des mines[9],[10] et écotoxicologiques (pour les stériles minières, dont crassiers de phosphogypse radioactif). Le cadmium dont la première source dans un champ est souvent l'engrais phosphaté peut poser de graves problèmes, et il est particulièrement bioassimilable dans le cas d'engrais phosphatés hydrosolubles, alors que, parce que lié à l'apatite, il est moins soluble dans les engrais non hydrosolubles[11].). Il est encore plus bioassimilable dans les sols acides[11] et/ou en présence d'une carence en certains autres oligo-éléments (fer, ...). Le phosphate radioactif peut pénétrer certaines membranes (par exemple celles des œufs de certains organismes aquatiques, plus encore à certains moments de leur développement)[12],[13]
Les transferts horizontaux ou verticaux de phosphates vers les eaux de surface varient fortement (de 0,1 à 2,5 kg⋅ha-1⋅an-1), selon le type de sol, son pH, sa teneur en humus, et ses usages (labour, prairie permanente...). En moyenne, 9 % du phosphore (dont la moitié apporté par les engrais) est emporté par les eaux de ruissellement[14].
Les engrais phosphatés minéraux sont aussi très riches en fluor (provenant de l'apatite qu'ils contiennent). Le fluor dépasse souvent 3 % du poids total (environ 250 g de F/kg de phosphate). Ce fluor peut causer une fluorose aux animaux qui pâturent les sols traités, probablement pas parce qu'ils absorbent ce fluor via les plantes (qui le bioconcentrent peu), mais parce qu'ils ingèrent de la terre ainsi enrichie en fluor, avec leur nourriture ou en se léchant[15].
Dans les cultures, le phosphore est normalement absorbé par les plantes par l'intermédiaire des mycorhizes. Or, les apports excessifs d'engrais phosphatés détruisent les équilibres pédologiques, rendant inopérante cette étape clé du cycle du phosphore. Les plantes cultivées ne peuvent ainsi plus profiter de ce mécanisme, et ne peuvent plus assimiler le phosphore autrement que par de nouveaux apports massifs de phosphates[16]. Le phosphore des engrais excédentaire, lessivé par les pluies peut s'accumuler dans les sédiments des étangs où il reste plus longtemps disponible que les nitrates (plus ou moins selon le la concentration du sédiment en fer sous forme de Fe(OOH) et selon le pH de ce sédiment[17],[18].
En France, selon le bilan[14] publié en 2009 sur les phosphates dans les sols de la France métropolitaine, en 2001, ce sont 775 000 tonnes qui ont été apportées aux sols français sous forme d'engrais minéraux. 6 ans plus tard (en 2007) sur 2 372 points de mesure, près de la moitié des sols analysés en France posent encore problème : 2 % sont de qualité mauvaise, 4 % médiocre, 12 % moyenne, 55 % bonne et 27 % très bonne.
Les engrais minéraux restent la première source de phosphore perdu dans les eaux (50 %) en France, devant les déjections animales (directement ou plus souvent via les fumiers et épandages de lisier) (40 %). Viennent ensuite les effluents urbains domestiques (environ 5 %) et industriels (2 %) ainsi que les boues de stations d'épuration (2 %)[14].
En France et dans d'autres pays d'Europe, les agriculteurs ont globalement acheté moins d'engrais minéraux phosphatés (deux tiers en moins de 1972 à 2008), mais cette diminution concerne surtout les zones de déprise agricole ou d'agriculture biologique ; les analyses montrent que des teneurs en phosphore de certains sols agricoles ont fortement augmenté (+ 43 % des cantons étudiés, notamment en Bretagne, Pays de la Loire, Champagne-Ardenne et Aquitaine)[14]. Avec le développement des stations d'épuration et de l'élevage hors-sol, les quantités de boues et fumiers ou lisiers épandus ont fortement augmenté depuis les années 1970. Ces boues sont le plus souvent épandues, comme les fientes d'élevage avicoles sur les sols agricoles.
En France, les mesures agro-environnementales telles que le « couvert environnemental permanent » ou les « bandes enherbées » peuvent contribuer à piéger une partie des phosphates ruisselant à partir des champs afin qu'ils ne soient pas emportés par les cours d'eau. Le lagunage naturel peut aussi contribuer à mieux traiter les nitrates et le phosphore, éventuellement en traitement tertiaire en aval d'une station d'épuration « classique ».
Recyclage
La récupération des phosphates contenus dans les eaux usées permet de limiter l'eutrophisation des cours d'eau et constitue un complément de ressource phosphatée. Cette activité, encore peu développée, fait l'objet de nombreuses recherches. Le traitement le plus répandu consiste à faire précipiter le phosphore ; coûteux, il pourrait à terme être remplacé ou associé à des traitements biologiques[19].
Pour les excréments humains, les toilettes à litière bio-maîtrisée constituent une alternative : d'une mise en œuvre simple et peu coûteuse, elles contournent le problème de l'assainissement de l'eau et permettent de produire un compost bon marché.
Législation
Depuis le 1er juillet 2007, les phosphates sont interdits dans les lessives en France. Grâce à l'utilisation d'autres molécules actives, la qualité des eaux de nombreux lacs polluées par les eaux urbaines s'est améliorée. C'est maintenant l'agriculture qui est devenue la première source de pollution par les phosphates. En Belgique et en Suisse, les phosphates sont déjà interdits dans les lessives depuis plusieurs années.
Production et réserves

Les trois principaux pays producteurs de phosphate assurent 71,41 % de la production mondiale.
| Pays | Production (106 kg) | Part mondiale (%) | Réserve mondiale (106 kg) |
|---|---|---|---|
| | 27 100 | 12,32 | 1 100 000 |
| | 1 500 | 0,68 | 2 200 000 |
| | 2 600 | 1,18 | 1 030 000 |
| | 6 750 | 3,07 | 270 000 |
| | - | 0,00 | 76 000 |
| | 100 000 | 45,45 | 3 700 000 |
| | 6 000 | 2,73 | 715 000 |
| | 2 100 | 0,95 | 35 000 |
| | 250 | 0,11 | 430 000 |
| | 3 600 | 1,64 | 130 000 |
| | 6 000 | 2,73 | 1 300 000 |
| | 1 600 | 0,73 | 260 000 |
| | 1 700 | 0,77 | 30 000 |
| | 30 000 | 13,64 | 50 000 000 |
| | 2 600 | 1,18 | 820 000 |
| | 10 000 | 4,55 | 1 300 000 |
| | 3 000 | 1,36 | 211 000 |
| | 700 | 0,32 | 50 000 |
| | 2 200 | 1,00 | 1 500 000 |
| | 1 000 | 0,45 | 1 800 000 |
| | 1 200 | 0,55 | 30 000 |
| | 5 000 | 2,27 | 100 000 |
| | 2 400 | 1,09 | 30 000 |
| Autres pays | 2 600 | 1,18 | 300 000 |
| Total | 220 000 | 100 | 67 000 000 |
Commerce
La France, en 2014, est nette importatrice de Phosphate, d'après les douanes françaises. Le prix moyen à la tonne à l'import était de 500 €[21].
Notes et références
- ↑ Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- ↑ Le cycle biogéochimique et écologique du phosphore a été modifié par l'Homme qui l'a récemment massivement introduit sous forme d'engrais (eutrophisant) dans les agrosystèmes, et indirectement dans les écosystèmes (Atlas mondial des océans).
- ↑ AFNOR, 1990. Dosage des orthophosphates, des phosphates et du phosphore total. In: AFNOR (Éd.), Eaux Méthodes d'essais. Paris, p. 87–97.
- ↑ Biologie moléculaire de la cellule Par Harvey Lodish, Arnold Berk, Paul Matsudaira, James Darnell, Chris A. Kaiser, Pierre L. Masson - p. 301
- ↑ Kumler, W.D.; Eiler, J.J. J. Am. Chem. Soc. 1943, 65, 2355.
- ↑ https://www.sigmaaldrich.com/content/dam/sigma-aldrich/docs/Sigma/Product_Information_Sheet/1/p6560pis.pdf
- ↑ État de l'environnement ; Références juin 2010 L'environnement en France ; Commissariat général au développement durable • Service de l'observation et des statistiques (voir p. 41-42 / 152)
- 1 2 selon Van Kauwenbergh, 1997 cité par la FAO (voir Tableau 27 ; Analyse chimique des éléments potentiellement dangereux dans des phosphates naturels sédimentaires)
- ↑ Ama, B., Swinkels, A. et Buresh, R.J. 1997. Agronomic and economic evaluations of organic and inorganic phosphorus in western Kenya. Agron. J., 89: 597-604.
- ↑ Weil, R.R. 2000. Soil and plant influence on crop response to two African phosphate rocks. Agron. J., 92: 1167-1175.
- 1 2 Iretskaya et al. (1998), cités par la FAO dans Les éléments nutritifs secondaires, les oligo-éléments, l'effet chaulant, et les éléments dangereux associés à l'utilisation de phosphates naturels (chap. 8 du document « Utilisation des phosphates naturels pour une agriculture durable. »)
- ↑ Brooks, S. C., & Chambers, E. L. (1954) The penetration of radioactive phosphate into marine eggs. The Biological Bulletin, 106(3), 279-296 ; PDF, 18 pp.
- ↑ Brooks, S. C., & CHAMBERS, E. (1948). Penetration of radioactive phosphate into the eggs of Strongylocentrotus purpuratus, S. franciscanus, and Urechis caupo. The Biological bulletin, 95(2), 262.
- 1 2 3 4 Publication «Le phosphore dans les sols nécessité agronomique, préoccupation environnementale», juin 2009, Service de l'observation et des statistiques (SOeS) du Commissariat général au développement durable, coll. « Le point sur... »
- ↑ McLaughlin, M.J., Simpson, P., Fleming, F., Stevens, D.P., Cozens, G. et Smart, M.K., 1997. Effect of fertilizer type on cadmium and fluorine concentrations in clover herbage. Aus. J. Exp. Ag., 37: 1019-1026.
- ↑ Le sol, la terre et les champs, Claude et Lydia Bourguignon, p. 81-82
- ↑ Golterman H.L. et De Groot C.J., 1994, « Nouvelles connaissances des formes de phosphates : conséquences sur le cycle du phosphate dans les sédiments des eaux douces peu profondes », Annls Limno., 30(3) : 221-232 (Résumé en Français)
- ↑ Thèse de doctorat de Marie-Soleil Beauregard, Impacts de la fertilisation phosphatée sur la biodiversité microbienne de sols agricoles, université de Montréal, 2010-05-05
- ↑ Jack Testard, Recycler les phosphates, Pour la Science no 387, janvier 2010, p. 38
- ↑ (en) USGS Minerals Year Book - Phosphate Rock
- ↑ « Indicateur des échanges import/export », sur Direction générale des douanes. Indiquer NC8=31053000 (consulté le 7 août 2015)
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Phosphate » (voir la liste des auteurs).
Voir aussi
Articles connexes
- Pollution de l'eau
- Phosphatier
- Guano
- Prayon
Bibliographie
- Utilisation des phosphates naturels pour une agriculture durable ; Bulletin Fao, engrais et nutrition végétale / Édition technique, publication conjointe de la Division de la mise en valeur des terres et des eaux de la FAO et de l'Agence internationale de l'énergie atomique ; Rome, 2004
- (en) Karl-Erich Schmittner et Pierre Giresse, « Micro-environmental controls on biomineralization: superficial processes of apatite and calcite precipitation in Quaternary soils, Roussillon, France », Sedimentology, vol. 46, no 3, , p. 463-476.
- Heald, P. J. (1956). Effects of electrical pulses on the distribution of radioactive phosphate in cerebral tissues. Biochemical Journal, 63(2), 242.
- Bibliographie FAO
- Portail de la chimie
- Portail de l’environnement