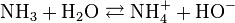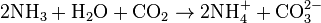Ammoniaque
|
|
Cet article est une ébauche concernant un composé chimique. Vous pouvez partager vos connaissances en l’améliorant (comment ?) selon les recommandations des projets correspondants.
Consultez la liste des tâches à accomplir en page de discussion. |
| Ammoniaque | |||
|---|---|---|---|
| Identification | |||
| Nom UICPA | ammoniaque | ||
| No CAS | |||
| No EINECS | |||
| No E | E527 | ||
| Apparence | solution très volatile, incolore, d'ammoniac dans l'eau, d'odeur âcre[1]. [2] | ||
| Propriétés chimiques | |||
| Formule brute | NH4OH | ||
| Masse molaire[3] | 35,0458 ± 0,0009 g/mol H 14,38 %, N 39,97 %, O 45,65 %, | ||
| pKa | 9,25 à 25 °C [4] | ||
| Propriétés physiques | |||
| T° fusion | (25 %) −58 °C[1] | ||
| T° ébullition | (25 %) 38 °C[1] | ||
| Solubilité | miscible avec l'éthanol (95 %) et l'eau[5] | ||
| Masse volumique | 0,892–0,910 g·cm-3 [5] | ||
| Pression de vapeur saturante | à 20 °C : (25 %) 48 kPa[1] | ||
| Vitesse du son | 415 m·s-1 (gaz,0 °C,1 atm) [6] | ||
| Précautions | |||
 C  N Phrases R : 34, 50, Phrases S : (1/2), 26, 36/37/39, 45, 61,
| |||
 E, | |||
  Danger | |||
L'ammoniaque désigne la solution aqueuse basique de l'ammoniac. Elle peut être notée NH3. H2O, parfois NH4OH ou mieux NH3 aqueux. Elle est donc le produit de la dissolution de l'ammoniac NH3 à l'état gazeux dans l'eau.
Il s'agit d'un banal produit industriel, parfois aussi très souvent d'une solution commerciale à 35 % en masse. NH3 aqueux est un alcali commun en teinturerie, entrant dans la fabrication de fibres textiles et leurs apprêts, des papiers et de leurs couchages, et aussi employé à l'industrie chimique et pharmaceutique[9].
La réaction entre l'eau et l'ammoniac, base faible, produisant environ 1 % d'ions ammonium NH4+ et autant d'anions hydroxyde HO-, cette solution a aussi été appelée solution d'hydroxyde d'ammonium et la formule statistique (NH4+aq + HO-aq) lui a été attribuée. Pour autant, le composé NH4OH n'a jamais été isolé.
L'ammoniaque laisse émaner une odeur d'ammoniac, gaz qui la compose principalement et s'en échappe assez spontanément ; la solution aqueuse libère à chaud encore plus facilement le gaz ammoniac, irritant, à forte odeur piquante et souvent désagréable. L'odeur caractéristique ammoniaquée se retrouve à proximité des urinoirs ou sur les habits sales ou imprégnés par une forte sudation, lentement séchés puis mouillés subitement.
Description
Le gaz ammoniac est facilement soluble dans l'eau. Un litre d'eau peut piéger 1 148 litre de gaz à 0 °C. Mais la pression de vapeur est élevée et il est facile d'extirper le gaz en chauffant la solution ammoniaque concentrée.
La pression de vapeur partielle d'ammoniac dans une solution concentrée à 60 % en masse est de l'ordre de 380 mmHg à 0 °C, 600 mmHg à 10 °C, 945 mmHg à 20 °C.... 2 130 mmHg à 40 °C.
L'ammoniac en solution réagit très partiellement avec l'eau selon l'équilibre suivant :
Le pKa (constante de dissociation) du couple NH4+/NH3 étant de 9,23, cette réaction est limitée à environ 1 %. La libération d'ions hydroxyde (HO-) confère cependant à l'ammoniaque son caractère basique avec un pH approximatif de 11,6 pour une solution molaire.
Dangerosité
Les solutions commerciales d'ammoniaque sont concentrées et très dangereuses ; d'après l'Institut national de recherche et de sécurité (INRS), la solution commerciale provoque des brûlures et doit être manipulée avec des vêtements appropriés (gants, protection du visage et des yeux)[10]. L'aération du local va de soi y compris bien évidemment pour les travaux ménagers. L'origine de l'irritation provoquée par un contact de l'ammoniaque avec la peau est le caractère réactif de la molécule d'ammoniac NH3 vis-à-vis des membranes cellulaires. Cette réactivité vis-à-vis des milieux biologiques en fait un produit ménager efficace pour nettoyer, dégraisser, assainir.
En solutions diluées, l'ammoniaque était employé par les médecins de la Belle Époque en inhalation, supposée roborative.
Le Hákarl est un plat islandais contenant de l'ammoniaque, il est préparé à partir de la chair du Requin du Groenland après avoir longuement extrait une partie de l'urée.
Réactivité
Les exemples de réactivité de l'ammoniaque sont nombreux. Cette solution possède les propriétés de l'ammoniac qui est à la fois une base, un ligand et un réducteur.
L'ammoniaque base faible
L'ammoniaque réagit avec le dioxyde de carbone (CO2) ; il s'agit d'une réaction acidobasique qui conduit au carbonate d'ammonium (NH4)2CO3. Dans cette réaction, l'ammoniaque apporte la base NH3
D'une manière générale, selon les anciens chimistes[Quoi ?], l'ammoniaque réagit avec les acides pour engendrer des sels. Un grand nombre de sels d'ammonium sont des explosifs et des engrais.
L'ammoniaque ligand
L'ammoniaque ajoutée à une solution de sulfate de cuivre de couleur bleu clair donne un complexe de couleur bleu céleste très intense de formule [Cu(NH3)4(H2O)2]2+. Dans cette réaction, l'ammoniaque apporte le ligand NH3.
Une réaction antique, mystérieuse, était l'union de l'ammoniaque avec le vif argent ou mercure métallique liquide. C'est pourquoi l'ammoniaque ou encore le salmiac et autres sels d'ammonium, était recherché par les forgerons et métallurgistes pour favoriser le nettoyage des métaux et les soudures métalliques.
L'ammoniaque réducteur
Le mélange d'ammoniaque concentrée avec le diiode conduit au triiodure d'azote NI3 qui est explosif à sec. Dans cette réaction, l'ammoniaque apporte le réducteur NH3 et le diiode est l'oxydant.
Notes et références
- 1 2 3 4 HYDROXYDE D'AMMONIUM (solution 10% - 35%), fiche de sécurité du Programme International sur la Sécurité des Substances Chimiques, consultée le 9 mai 2009
- ↑ Ces propriétés chimiques sont celle de la solution et non celle du composés qui n'existe pas, ou tout du moins qui n'a jamais été isolé.
- ↑ Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- ↑ (en) David R. Lide, CRC Handbook of Chemistry and Physics, CRC Press Inc, , 90e éd., Relié, 2804 p. (ISBN 978-1-420-09084-0)
- 1 2 (en) Raymond C Rowe, Paul J Sheskey, Marian E Quinn, Handbook of Pharmaceutical Excipients, Pharmaceutical Press and American Pharmacists Association, , 6e éd., 888 p. (ISBN 978 0 85369 792 3), p. 40
- ↑ (en) W. M Haynes, Handbook of chemistry and physics, CRC, 2010-2011, 91e éd., 2610 p. (ISBN 9781439820773), p. 14-40
- ↑ « Hydroxyde d'ammonium » dans la base de données de produits chimiques Reptox de la CSST (organisme québécois responsable de la sécurité et de la santé au travail), consulté le 25 avril 2009
- ↑ Numéro index dans le tableau 3.1 de l'annexe VI du règlement CE N° 1272/2008 (16 décembre 2008)
- ↑ Il sert ou servait notamment à la préparation de l'acide nitrique HNO3par oxydation catalytique de l'ammoniac, de l'urée (NH2)2CO, de nombreuses résines artificielles, de colorants de synthèse, d'engrais et d'explosifs.
- ↑ http://www.inrs.fr/accueil/produits/bdd/doc/fichetox.html?refINRS=FT%2016
Voir aussi
Articles connexes
Liens externes
- L'ammoniac et ses solutions aqueuses, fiche toxicologique INRS.
- Portail de la chimie