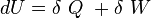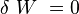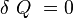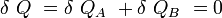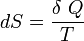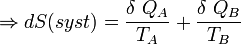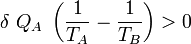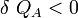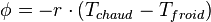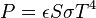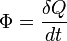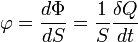Transfert thermique
Un transfert thermique, appelé plus communément chaleur[1], est un transfert d'énergie microscopique désordonnée. Cela correspond en réalité à un transfert d'énergie thermique entre particules, au gré des chocs aléatoires qui se produisent à l'échelle microscopique.
Description
L'exemple le plus courant de situation mettant en jeu un transfert thermique est le système constitué de deux corps en contact et ayant des températures différentes. Le corps le plus chaud cède de l'énergie sous forme de chaleur au corps le plus froid. Il y a transfert thermique entre les deux corps. Il peut se produire des transferts thermiques vers un système dont la température reste constante, par exemple dans le cas d'un changement d'état physique (exemple : la fusion de la glace à 0 °C sous la pression atmosphérique).
L'étude de ces transferts s'effectue dans le cadre de la discipline thermodynamique en s'appuyant sur les deux premiers principes.
À la différence de la thermodynamique, la thermocinétique fournit des informations sur le mode de transfert en situation de non équilibre ainsi que sur les valeurs de flux de chaleur.
Historique et évolution de la terminologie
La chaleur, dans le langage commun, est souvent confondue avec la notion de température. Bien que strictement différentes d'un point de vue scientifique, les deux notions sont en effet reliées entre elles et l'histoire même de la genèse de la thermodynamique a parfois induit cette confusion.
Jusqu'au XVIIIe siècle, les scientifiques pensaient que la chaleur était constituée d'un fluide que l'on avait nommé le phlogistique (théorie du phlogistique).
Au XIXe siècle, la chaleur est assimilée à un fluide : le calorique. Les progrès et les succès de la calorimétrie imposent cette théorie jusqu'au milieu du XIXe siècle. Cette conception est par exemple reprise par Sadi Carnot : un moteur thermique ne peut fonctionner que si la chaleur circule d'un corps dont la température est plus élevée vers un corps dont la température est plus faible ; raisonnement correspondant à une analogie avec une machine hydraulique qui tire son énergie du passage de l'eau d'un réservoir d'altitude élevée vers un réservoir d'altitude inférieure.
Ce n'est qu'avec l'avènement de la thermodynamique statistique que la chaleur sera définie comme un transfert de l'agitation thermique des particules au niveau microscopique. Un système dont les particules sont statistiquement plus agitées présentera une température d'équilibre, définie à l'échelle macroscopique, plus élevée. La température est donc une grandeur macroscopique qui est le reflet statistique des énergies cinétiques des particules à l'échelle microscopique. Au cours de chocs aléatoires, les particules les plus agitées transmettent leurs énergies cinétiques aux particules les moins agitées. Le bilan de ces transferts d'énergies cinétiques microscopiques correspond à la chaleur échangée entre des systèmes constitués de particules dont l'agitation thermique moyenne est différente.
La température est donc une fonction d'état intensive servant à décrire l'état d'équilibre d'un système alors que la chaleur est un transfert d'agitation thermique assimilable à une quantité d'énergie, associé à l'évolution d'un système entre deux états distincts ou identiques si la transformation est cyclique.
Chaleur et thermodynamique
Évolution de deux corps en contact

Soient deux objets A et B indéformables dans un système parfaitement isolé thermiquement et mécaniquement, ayant les caractéristiques suivantes :
| Objet A | Objet B | ||
|---|---|---|---|
| Volume | 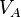 |
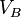 |
|
| Température | 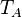 |
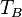 |
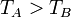 |
| Masse | 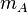 |
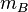 |
|
| Capacité thermique massique | 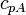 |
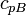 |
Dans ce cas, le sens du transfert thermique est gouverné par la différence de température entre les deux corps. L’expérience montre que c’est le corps chaud qui cède de l’énergie au corps froid de façon que, à l’équilibre, les températures des deux corps soient identiques.
Conformément au premier principe de la thermodynamique, nous pouvons écrire que l’énergie interne est égale à la somme de la chaleur et du travail :
- Les objets sont indéformables donc :
- Le système est isolé donc :
Si δQA et δQB sont respectivement les énergies thermiques élémentaires échangées entre l’objet A et l’objet B, faisant partie du système isolé.
D’où : 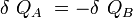
Le deuxième principe de la thermodynamique permet d’écrire la relation suivante liant les entropies des objets A et B :
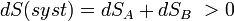 , puisque le système est isolé.
, puisque le système est isolé.
par définition.
Nous pouvons écrire :
Si : 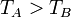
Cela signifie que :
et donc que : 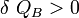
D’après la règle des signes, on conclut que l’objet A cède de la chaleur à l’objet B. L’objet le plus chaud cède donc de la chaleur à l’objet le plus froid.
Le premier principe et la chaleur
Le premier principe de la thermodynamique est un principe de conservation de l'énergie. Il introduit la fonction d'état énergie interne U .
Au cours d'une transformation d'un système thermodynamique fermé, entre deux états I et F la variation de l'énergie interne U(F) - U(I) est due à la somme :
- des travaux macroscopiques réalisés
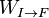 , en général le travail des forces de pression.
, en général le travail des forces de pression. - des transferts d'énergies microscopiques ou chaleurs,
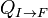 .
.
Ce qui se traduit par :
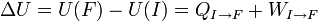
On en déduit donc une définition formelle de la chaleur le long d'un chemin bien défini allant de I à F :

L'intégrale curviligne permettant le calcul du travail des forces de pression: 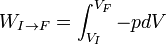 , n'est pas indépendante du chemin suivi pour aller de I vers F car le travail n'est pas une fonction d'état.
, n'est pas indépendante du chemin suivi pour aller de I vers F car le travail n'est pas une fonction d'état.
Il s'ensuit également que la chaleur n'est pas une fonction d'état et donc qu'elle dépend du chemin suivi. Notamment si la transformation permettant d'amener un corps d'un état I à un état F est réalisée de deux façons différentes, les chaleurs mises en jeu sont également a priori différentes.
Néanmoins dans certaines conditions expérimentales, la chaleur mise en jeu est égale à la variation d'une fonction d'état. C'est le cas pour une transformation d'un système fermé, effectuée à volume constant : la chaleur est égale à la variation d'énergie interne : ΔU = QV. Dans le cas d'une transformation à pression constante la chaleur est égale à la variation d'enthalpie : ΔH = QP . Ces deux propriétés sont mises à profit dans le domaine de la calorimétrie effectuée dans un calorimètre fonctionnant soit à pression constante soit à volume constant dans le cas d'une bombe calorimétrique.
Le second principe et la chaleur
Le deuxième principe de la thermodynamique est un principe d'évolution. Il introduit la fonction d'état entropie qui est une mesure du désordre de la matière. La fonction entropie est définie à l'échelle macroscopique de telle sorte que sa variation au cours de la transformation réversible d'un système correspond au rapport de la quantité de chaleur échangée avec le milieu extérieur sur la température du système :
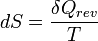
d'où :
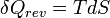
Et pour une transformation finie à température T constante, allant d'un état I à un état F d'équilibre :
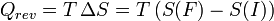
La chaleur est donc associée à une variation d'entropie. Or, plus il y a création d'entropie, plus la transformation est irréversible et plus le travail utile récupéré sera faible : ceci justifie le qualificatif donné à la chaleur d'être une dégradation qualitative de l'énergie (voir le deuxième principe de la thermodynamique).
Exemples de calcul de chaleur mise en jeu, au cours d'une transformation affectant un corps pur
Les grandeurs thermodynamiques associées à une quantité déterminée de corps pur (n constant) ne dépendent que de deux variables indépendantes.
Deux fonctions d'état introduites par le premier principe sont reliées à la chaleur sous certaines contraintes : V=cte ou P=cte.
- À volume constant, on choisit la fonction d'état énergie interne.
Car, à volume constant, la variation de la fonction énergie interne d'un corps pur est égale à la chaleur échangée avec le milieu extérieur.
Fonction d'état énergie interne: U(T,V)
Sa différentielle est égale à :
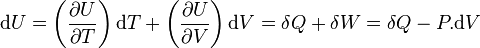 .
.
Si V = cte :
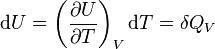 .
.
La grandeur 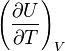 est la capacité thermique à volume constant, notée
est la capacité thermique à volume constant, notée 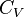 et qui s'exprime en
et qui s'exprime en 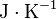 .
.
On lui associe une capacité thermique molaire à volume constant, notée 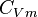 et qui s'exprime en
et qui s'exprime en 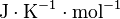 , telle que pour
, telle que pour 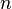 moles,
moles, 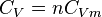 .
.
La chaleur mise en jeu pour une mole est donc égale à :
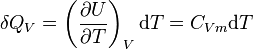 .
.
Pour 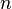 moles :
moles :
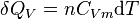 .
.
Enfin, pour une transformation isochore allant de l'état A défini par TA à un état B défini par TB :
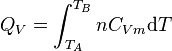 .
.
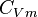 est fonction de T. Mais si l'intervalle de T n'est pas trop grand (quelques dizaines voire centaines de degrés), on peut la considérer en première approximation comme constante.
est fonction de T. Mais si l'intervalle de T n'est pas trop grand (quelques dizaines voire centaines de degrés), on peut la considérer en première approximation comme constante.
D'où :
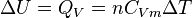 . . |
- À pression constante, on choisit la fonction d'état enthalpie.
Car, à pression constante, la variation de la fonction enthalpie d'un corps pur est égale à la chaleur échangée avec le milieu extérieur.
Fonction d'état enthalpie: H(T,P)
Sa différentielle est égale :
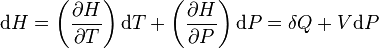 .
.
Si P = cte :
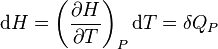 .
.
La grandeur 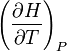 est la capacité thermique à pression constante, notée
est la capacité thermique à pression constante, notée 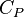 et qui s'exprime en
et qui s'exprime en 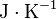 .
.
On lui associe une capacité thermique molaire à pression constante, notée 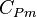 et qui s'exprime en
et qui s'exprime en 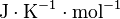 , telle que pour
, telle que pour 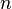 moles,
moles, 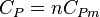 .
.
La chaleur mise en jeu pour une mole est donc égale à :
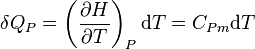 .
.
Pour n moles :
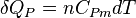 .
.
Enfin pour une transformation isobare allant de l'état A défini par TA à un état B défini par TB :
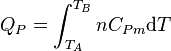 .
.
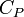 est fonction de T. Mais si l'intervalle de T n'est pas trop grand (quelques dizaines voire centaines de degrés), on peut la considérer en première approximation comme constante.
est fonction de T. Mais si l'intervalle de T n'est pas trop grand (quelques dizaines voire centaines de degrés), on peut la considérer en première approximation comme constante.
D'où :
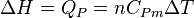 . . |
- Cas du changement d'état physique.
Généralement, on considère le changement d'état physique effectué à l'air libre, c'est-à-dire à pression constante (pression atmosphérique). La glace fond à 0 °C sous la pression atmosphérique et tant qu'il y a coexistence de glace et d'eau liquide, la température reste constante. Le changement d'état d'un corps pur s'effectue donc à P = Cte et T = Cte. La chaleur mise en jeu correspond donc à une variation d'enthalpie : ΔH puisque la pression est constante. On l'appelle encore chaleur latente molaire de changement d'état : L.
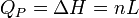 |
Les modes de transferts thermiques
Il existe trois modes de transfert :
- Conduction thermique : l'énergie se propage au sein d'un même corps ou passe d'un corps à un autre sous l'influence d'un gradient de température. Bien qu'il n'y ait pas de transfert de matière, il s'agit d'un phénomène de diffusion.
- Convection : les différences de températures au sein d'un fluide engendrent des différences de masse volumique. Ainsi les particules se mettent naturellement en mouvement, les particules plus légères remontant etc. Ce déplacement de matière induit un déplacement de la chaleur.
- Rayonnement : tous les corps émettent un rayonnement électromagnétique, on parle de rayonnement thermique.
Le transfert thermique global peut être formulé par la loi de refroidissement de Newton qui indique que le transfert est proportionnel à la différence de température :
Cette équation permet de considérer tous les modes de transfert.
| Mode de transfert | Échelle | Support |
|---|---|---|
| Conduction | Microscopique | Matière solide, gradient de température |
| Convection | Macroscopique | Matière libre (possibilité de mouvement, souvent un fluide), gradient de température |
| Rayonnement (radiation) | Microscopique | Aucun : peut se faire dans le vide ou la matière, quelle que soit la température (à partir de 0 K). |
Ces phénomènes doivent être réduits au maximum dans les enceintes isothermes telles que le vase Dewar.
Conduction
Le transfert par conduction est un échange d'énergie se réalisant au sein d'un système sans déplacement de matière. Ce transfert peut se réaliser au sein d'un seul corps ou par contact entre deux corps.
Dans un gaz ou un liquide, l'énergie se propage par contact direct entre molécules au gré des chocs aléatoires à l'échelle microscopique. Dans un solide ou fluide immobilisé, la vibration des atomes autour de leur position d'équilibre dans le solide, se transmet de proche en proche. Les cristaux disposent d'un mode de transfert thermique supplémentaire particulier associé aux vibrations du réseau (voir phonon).
Exemples de transfert par conduction : transfert à travers une paroi diathermique (par exemple les ailettes de refroidissement d'un moteur ou les radiateurs d'un chauffage central…) contrairement à une paroi adiabatique qui s'oppose au transfert de chaleur (par exemple, la paroi d'une bouteille isotherme).

D'une manière simple, le flux de chaleur qui passe dans un solide de manière monodirectionnel s'exprime de la manière suivante :
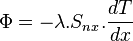
Où
-
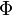 : flux de chaleur en watt (W);
: flux de chaleur en watt (W); -
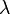 : conductivité thermique du matériau (en
: conductivité thermique du matériau (en 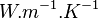 ) ;
) ; -
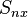 = Surface perpendiculaire au flux de chaleur (normal à l'axe x considéré) ;
= Surface perpendiculaire au flux de chaleur (normal à l'axe x considéré) ; - dT : différence de température (en kelvins) ;
- x : axe considéré.
C'est une loi de diffusion similaire à la loi de Fick.
Convection
Le transfert de chaleur par convection est dû au déplacement de molécules de différentes températures, il se déroule dans un fluide (un liquide ou un gaz). Ces molécules se déplaçant, elles transfèrent leur chaleur à un autre endroit du système. On peut distinguer deux types de convection :
- convection naturelle (ou libre) : l'échange de chaleur est dû à la différence de masse volumique entre les particules composant le fluide ; la masse volumique variant avec la température. Les échanges thermiques entre les radiateurs alimentés par de l'eau chaude et l'air d'une pièce se font, en partie, par convection (rayonnement pour le reste). Dans le cas d'un mur plan vertical et d'air à environ 20 °C, le coefficient d'échange est de l'ordre de 10 watt/m2/K, cela signifie que la puissance thermique du transfert de chaleur est de l'ordre de 10 watt pour un mètre de carré de surface et pour une différence de température de 1 °C.
- convection forcée : le déplacement du fluide est forcé : ventilateur devant un radiateur (cas des radiateurs pour automobiles). Le mouvement accélère le transfert thermique.
Pour une même surface d'échange et un même écart de température, la valeur de l'échange thermique est notablement améliorée dans le deuxième cas.
| Convection naturelle | Convection forcée |
|---|---|
 Représentation schématique de la convection naturelle. |
 Représentation schématique de la convection forcée. |
Rayonnement

Par définition, le transfert se fait par rayonnement électromagnétique. Quelle que soit sa température, un corps émet un rayonnement thermique, celui-ci est plus ou moins intense selon cette température. La longueur d'onde à laquelle est émise ce rayonnement dépend aussi de cette température. Ainsi, le rayonnement thermique émis par le Soleil est situé principalement dans le visible. Des corps plus froids comme les mammifères émettent quant à eux dans l'infrarouge. La loi dite loi du déplacement de Wien permet de donner la longueur d'onde du maximum d'émission en fonction de cette température.
Ce transfert de chaleur est le seul à se réaliser dans le vide, cas du rayonnement solaire arrivant sur Terre. Néanmoins, celui-ci se réalise aussi dans les fluides (l'air par exemple) et dans certains solides (verre).
Exemples de transfert par rayonnement : système de chauffage dit par radiant ; le soleil.
La loi de Stefan-Boltzmann (ou loi de Stefan) permet de quantifier ces échanges. La puissance rayonnée par un corps est donnée par la relation :
avec
-
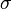 : constante de Stefan-Boltzmann (5,6703 . 10-8 W.m-2.K-4) ;
: constante de Stefan-Boltzmann (5,6703 . 10-8 W.m-2.K-4) ; -
 : émissivité, indice valant 1 pour un corps noir et qui est compris entre 0 et 1 selon l’état de surface du matériau ;
: émissivité, indice valant 1 pour un corps noir et qui est compris entre 0 et 1 selon l’état de surface du matériau ; -
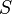 : superficie du corps ;
: superficie du corps ; -
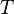 : température du corps (en kelvin).
: température du corps (en kelvin).
Si le corps récepteur réfléchit certaines longueurs d'ondes ou est transparent à d'autres, seules les longueurs d'onde absorbées contribuent à son équilibre thermique. Si par contre le corps récepteur est un corps noir, c'est-à-dire qu'il absorbe tous les rayonnements électromagnétiques, alors tous les rayonnements contribuent à son équilibre thermique.
Combinaison des modes de transfert
Le transfert d'énergie par chaleur se réalise généralement par une combinaison de plusieurs modes.
Par exemple, le système chauffage central, combine la convection (en général forcée) pour chauffer le fluide dans la chaudière, la conduction pour chauffer les parois du radiateur et la convection (en général naturelle) pour chauffer l'air autour du radiateur. Dans le cas du chauffage d'un solide par radiation, la transmission de chaleur sera une combinaison de radiation et de conduction. C'est le cas du verre d'une vitre chauffée par le rayonnement solaire; le transfert étant combiné avec une convection naturelle de l'air, derrière la vitre d'une pièce.
Parfois le transfert thermique s'accompagne d'un transfert de matière. Par exemple, dans le cas de l'ébullition d'un liquide, une partie du liquide subit un changement d'état physique et le gaz ainsi créé se sépare du liquide.
Grandeurs physiques
Flux thermique
Le flux thermique est la quantité d'énergie thermique qui traverse une surface isotherme par unité de temps. Il est appelé « puissance thermique » pour les équipements thermiques tels que les radiateurs.
Le flux est parfois représenté par la notation "Q point" : 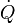 (voir ci-dessus le paragraphe conduction).
(voir ci-dessus le paragraphe conduction).
Le flux s'exprime en :
- watt : W (SI)
Densité de flux thermique
La densité de flux thermique (ou flux thermique surfacique), c'est le flux thermique par unité de surface. La densité de flux thermique s'exprime en watt par mètre carré (W/m2).
Si la densité de flux est uniforme sur la surface considérée :
Notes et références
- ↑ S. Olivier et H. Gié, Thermodynamique, Lavoisier Tec&Doc, Paris, 1998, page 133 : « Un tel transfert d'énergie est appelé chaleur ou mieux transfert thermique et noté Q » ; avec un appel de note de bas de page qui explique : « Le mot chaleur est de loin le plus utilisé : c'est un héritage légué par les fondateurs de la thermodynamique, et qui s'impose par sa simplicité. L'usage courant de formules telles que l'eau est chaude confère au mot chaleur une ambiguïté regrettable : on sous-entend ainsi que la chaleur est une forme d'énergie stockée par l'eau, alors que la chaleur n'est qu'une forme d'échange d'énergie. »
Bibliographie
- Transferts Thermiques, Bruno Chéron, Édition Ellipses
- Les bases de la mécanique des fluides et des transferts de chaleur et de masse pour l'ingénieur, Esteban Saatdjian, Sapientia Éditions 2009, (ISBN 978-2-911761-85-0).
- René Leleu, Transferts de chaleur, Paris, Éditions techniques de l'ingénieur, (notice BnF no FRBNF14017046, lire en ligne).
Voir également
Articles connexes
- Physique statistique
- Conduction thermique
- Convection
- Corps noir
- Gradient
- Température
- Isolant
- Premier principe de la thermodynamique
- Deuxième principe de la thermodynamique
- Entropie (thermodynamique)
- Enthalpie de changement d'état
- Chaleur sensible
- Thermique du bâtiment
Liens externes
- Lavoisier, Laplace et le début de la calorimétrie.
- Portail de la physique
- Portail de l’énergie