Énergie thermique
|
|
Cet article ne cite pas suffisamment ses sources (mars 2012). Si vous disposez d'ouvrages ou d'articles de référence ou si vous connaissez des sites web de qualité traitant du thème abordé ici, merci de compléter l'article en donnant les références utiles à sa vérifiabilité et en les liant à la section « Notes et références » (modifier l'article, comment ajouter mes sources ?).
|
L'énergie thermique est l'énergie cinétique d'agitation microscopique d'un objet, qui est due à une agitation désordonnée de ses molécules et de ses atomes. L'énergie thermique est une partie de l'énergie interne d'un corps. Les transferts d'énergie thermique entre corps sont appelés transferts thermiques et jouent un rôle essentiel en thermodynamique. Ils atteignent un équilibre lorsque la température des corps en contact est égale. L'énergie thermique est l'énergie que possède une substance en raison de l'agitation de ses particules (atomes ou molécules).
Énergie et équilibre thermiques
L'énergie thermique a tendance à se diffuser uniformément dans l'espace. Ce mécanisme naturel d'équilibre est un des mécanismes énoncés dans le principe zéro de la thermodynamique, qui comprend aussi l'équilibre mécanique (des pressions s'équilibrent), et l'équilibre chimique (les fluides se mélangent).
Les mécanismes de répartition de l'énergie thermique se font :
- par contact direct :
- la conduction thermique (transfert de l'énergie cinétique des molécules sans échange de matière) ;
- la convection (échange de matière entre fluides : gaz et liquides).
La dissipation d'énergie thermique par contact se produit de façon dissymétrique par rapport au temps, et se fait toujours du corps le plus chaud (celui dont la température est la plus élevée) vers le corps le plus froid. Ce phénomène est formalisé dans le second principe de la thermodynamique et limite les possibilités de transformer de l'énergie en travail. Il a été découvert lors de la réalisation des premiers moteurs.
- par rayonnement : au travers du vide ou de milieux transparents aux spectres lumineux et Infrarouge : émission de photons, par le phénomène appelé rayonnement du corps noir[1].
Origine quantique
De par sa nature, étant le reflet d'une activité au niveau moléculaire, l'énergie thermique est profondément quantique. En particulier, sa capacité à se transformer en énergie lumineuse par le rayonnement du corps noir est un témoignage direct des changements d'état des molécules et atomes composant l'objet. C'est un phénomène qu'on peut observer quotidiennement, en observant des braises dans un feu de bois, ou tout simplement la lumière d'une ampoule électrique à filament.
L'étude précise du rayonnement du corps noir, et des lois déterminant la nature de la lumière émise a conduit à des paradoxes lorsqu'elle était faite avec les équations de la mécanique newtonienne. C'est en cherchant à résoudre ce paradoxe que Max Planck introduit l'idée que la lumière n'était pas émise de manière continue, mais par paquets. Cette hypothèse se révéla fructueuse et est un des fondements de la mécanique quantique.
Cette propriété de la matière de rayonner son énergie thermique a une influence considérable sur notre environnement. C'est par ce phénomène que le Soleil rayonne une partie de son énergie jusqu'à la Terre, y apportant une source d'énergie essentielle aux conditions d'existence de la vie. De plus, les organismes vivants ont évolué pour tirer parti des informations rendues disponibles par ces rayons lumineux, en élaborant l'œil. Les longueurs d'onde lumineuse visibles pour l'homme, par exemple, sont autour de la longueur d'onde d'énergie maximale émise par le rayonnement du corps noir du Soleil, qui se situe à 500 nm.
Énergie thermique et température
Lors de la mise en contact de deux corps, un échange d'énergie thermique se produit. Le point d'équilibre est atteint lorsque les deux corps ont atteint la même température. La notion d'équilibre est une notion transitive. Si un corps A est en équilibre avec B, et que ce corps B est en équilibre avec un corps C, alors A et C sont aussi en équilibre : A, B et C ont la même température. Au début du XXe siècle, il a été jugé que cette loi, qui semble tenir du simple bon sens, méritait d'être formulée comme le principe zéro de la thermodynamique.
Bien que difficile à définir formellement, la température est une notion utilisée dans la vie courante, car facile à observer. Pour mesurer la température d'un corps, il suffit de le mettre en contact avec un thermomètre (par exemple un thermomètre à alcool), et d'en lire la graduation à l'équilibre thermique.
La capacité thermique massique d'un corps est une valeur définie pour exprimer la quantité d'énergie thermique nécessaire pour augmenter la température de ce corps d'un degré Celsius. La capacité thermique massique dépend en général de la composition du corps et de sa température.
Énergie thermique et état de la matière
En fournissant de l'énergie thermique à un corps, on peut en changer l'état, le faisant passer par exemple de l'état solide à l'état liquide.
À condition de pression donnée, ces changements d'état se font toujours à la même température, pour un corps d'une composition donnée. C'est cette propriété qui a été utilisée, ainsi que des considérations d'origine thermodynamique, pour définir l'échelle de température Celsius, en se basant sur les changements d'état de l'eau.
Transferts thermiques
Pour calculer la quantité d'énergie thermique transférée (Q) dans le cas d'un corps en phase condensée (liquide ou solide), il faut multiplier la masse du corps (m) par sa capacité thermique massique (c) et par la variation de température entre la température initiale et finale du corps (ΔT). Soit :
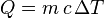 .
.
Q représente alors le transfert d'énergie thermique du corps considéré. Dans le système international d'unité, la capacité thermique massique s'exprime en joules par kilogramme et par kelvin (J/kg/K), la masse du corps s'exprime en kilogrammes, la variation de température s'exprime en kelvins (K) (une variation de 1 K est équivalent à une variation de 1 °C).
Différence entre la chaleur et la température
Les termes chaleur et température sont souvent confondus. À tort, on s'exclame qu'il fait chaud lorsque la température est élevée, mais il s'agit de deux concepts bien distincts. Toutefois, ils sont tous deux reliés à l'énergie thermique. En effet, l'énergie thermique dépend, entre autres, de la température qu'il fait, alors que la chaleur représente un transfert d'énergie thermique entre deux milieux.
Pour une quantité de matière donnée, sans changement d'état et isolée thermiquement avec son milieu extérieur:
- si on apporte de la chaleur à cette matière, sa température augmente;
- si on enlève de la chaleur à cette matière, sa température diminue.
Notes et références
- ↑ Définitions et lois du rayonnement thermique sciences.univ-nantes.fr, consulté en mai 2014
Articles connexes
- Énergie
- Énergie interne
- Capacité thermique
- Capacité thermique massique
- Température
- Portail de la physique
- Portail de l’énergie