Premier principe de la thermodynamique
Selon le premier principe de la thermodynamique, lors de toute transformation, il y a conservation de l'énergie.
Dans le cas des systèmes thermodynamiques fermés, il s'énonce de la manière suivante :
« Au cours d'une transformation quelconque d'un système fermé, la variation de son énergie est égale à la quantité d'énergie échangée avec le milieu extérieur, par transfert thermique (chaleur) et transfert mécanique (travail). »
Expression dans le cas d'un système quelconque
La variation de l'énergie d'un système qui subit une transformation peut s'exprimer selon la relation suivante :
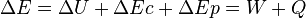
-
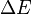 est la somme des différentes variations d'énergie du système.
est la somme des différentes variations d'énergie du système. -
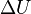 est la variation de l'énergie interne du système ; c'est-à-dire son énergie propre correspondant aux énergies cinétiques et potentielles microscopiques des particules qui le constituent.
est la variation de l'énergie interne du système ; c'est-à-dire son énergie propre correspondant aux énergies cinétiques et potentielles microscopiques des particules qui le constituent. -
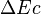 est la variation de l'énergie cinétique macroscopique du système (mouvement d'ensemble du système dans un référentiel donné).
est la variation de l'énergie cinétique macroscopique du système (mouvement d'ensemble du système dans un référentiel donné). -
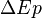 est la variation de l'énergie potentielle du système due aux interactions conservatives avec l'extérieur (champs gravitationnels ou électro-magnétiques par exemples).
est la variation de l'énergie potentielle du système due aux interactions conservatives avec l'extérieur (champs gravitationnels ou électro-magnétiques par exemples).
-
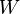 est le travail subi (ou reçu) par le système, à l'exception du travail des forces conservatives (déjà compté dans le terme ΔEp). Le travail est un mode de transfert ordonné d'énergie entre le milieu extérieur et le système.
est le travail subi (ou reçu) par le système, à l'exception du travail des forces conservatives (déjà compté dans le terme ΔEp). Le travail est un mode de transfert ordonné d'énergie entre le milieu extérieur et le système. 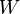 est donc l'énergie reçue par le système du fait du travail d'une force. Notons que W est compté de manière algébrique : si c'est le système qui exerce une force motrice sur l'extérieur (autrement dit : s'il donne de l'énergie à l'extérieur), alors
est donc l'énergie reçue par le système du fait du travail d'une force. Notons que W est compté de manière algébrique : si c'est le système qui exerce une force motrice sur l'extérieur (autrement dit : s'il donne de l'énergie à l'extérieur), alors 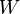 est compté négativement.
est compté négativement.
-
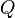 est la chaleur reçue, c'est-à-dire la quantité d'énergie que le milieu extérieur cède au système par trois processus d'échange thermique : conduction thermique, convection, rayonnement. L'échange de chaleur est un mode de transfert d'énergie microscopique désordonnée. C'est en quelque sorte un transfert d'agitation thermique (donc, par nature, désordonné), entre le système et le milieu extérieur. Cette grandeur est aussi comptée de manière algébrique : si le système cède de la chaleur à l'extérieur,
est la chaleur reçue, c'est-à-dire la quantité d'énergie que le milieu extérieur cède au système par trois processus d'échange thermique : conduction thermique, convection, rayonnement. L'échange de chaleur est un mode de transfert d'énergie microscopique désordonnée. C'est en quelque sorte un transfert d'agitation thermique (donc, par nature, désordonné), entre le système et le milieu extérieur. Cette grandeur est aussi comptée de manière algébrique : si le système cède de la chaleur à l'extérieur, 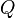 est compté négativement.
est compté négativement.
Toutes ces grandeurs sont exprimées en Joule.
Pour que l'énergie d'un système varie, il faut qu'il y ait un échange d'énergie entre celui-ci et le milieu extérieur, que ce soit sous forme de travail ou de chaleur.
Cas des systèmes thermodynamiques
- Lorsque les systèmes sont au repos à l'échelle macroscopique, ce qui est en général le cas pour les transformations thermodynamiques affectant des systèmes physico-chimiques, les énergies cinétique
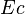 et potentielle
et potentielle 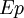 restent constantes et seule l'énergie interne
restent constantes et seule l'énergie interne 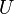 du système varie (par exemple : un réacteur chimique, un calorimètre…).
du système varie (par exemple : un réacteur chimique, un calorimètre…).
Le premier principe s'écrit alors :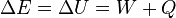
- Il existe plusieurs sortes de transfert ordonné d'énergie : travail des forces de pression,
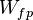 ; travail électrique fourni lors d'une réaction électrochimique de pile ou par rayonnement,
; travail électrique fourni lors d'une réaction électrochimique de pile ou par rayonnement, 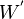 .
.
Le travail induit par les forces de pression correspond à la forme de travail la plus courante rencontrée en thermodynamique classique, il s'exprime sous la forme différentielle suivante :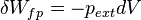
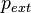 étant la pression du milieu extérieur,
étant la pression du milieu extérieur,
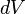 étant une variation infinitésimale de volume du système qui correspond sur un plan mathématique à la différentielle du volume.
étant une variation infinitésimale de volume du système qui correspond sur un plan mathématique à la différentielle du volume. - Expression différentielle du premier principe
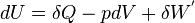
Remarque : les expressions 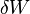 et
et 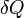 , employées pour exprimer les formes différentielles du travail et de l'énergie thermique, signifient que ces grandeurs ne sont pas des variations de fonctions d'état et donc que leur différentielle n'est pas exacte et que leur part respective dépend du chemin suivi, c'est-à-dire de la manière dont la transformation s'opère.
, employées pour exprimer les formes différentielles du travail et de l'énergie thermique, signifient que ces grandeurs ne sont pas des variations de fonctions d'état et donc que leur différentielle n'est pas exacte et que leur part respective dépend du chemin suivi, c'est-à-dire de la manière dont la transformation s'opère.
Différence entre travail et chaleur
Travail
Le travail est un transfert ordonné d'énergie entre un système et le milieu extérieur.
- Considérons un ensemble cylindre, piston, lequel est à la base de l’obtention de travail mécanique par action de la chaleur. À l’échelle microscopique les chocs des particules de gaz sur le piston définissent la pression exercée sur celui-ci à l’échelle macroscopique. Chaque choc contribue au déplacement, concerté avec les autres chocs, du piston dans la même direction. Il y a addition des forces induites par chaque choc et c’est pourquoi le transfert d’énergie est considéré comme ordonné.
- Si l’on considère maintenant le travail électrique. Il est dû au déplacement des électrons dans un conducteur sous l’influence d’un champ électrique. Ici encore l’ensemble des électrons se déplace dans la même direction et les effets s’additionnent au niveau macroscopique.
Chaleur
La chaleur est un transfert désordonné d’énergie entre le système et le milieu extérieur.
La chaleur est un transfert d’agitation thermique. L’agitation des particules se propage au gré des chocs dans toutes les directions, de façon désordonnée. C’est pour cette raison que l’on ne peut jamais transformer intégralement de l’énergie thermique en travail alors que l’inverse est possible (ex: travail électrique transformé en chaleur par effet Joule dans un radiateur électrique). On dit encore que la montée en température se traduit par une dégradation de l’énergie.
Ce transfert thermique, appelé chaleur, s'effectue du système le plus chaud vers le plus froid. Celui dont les particules sont statistiquement les plus agitées, va transmettre son agitation thermique au gré des chocs plus ou moins énergétiques, au milieu extérieur ou au système statistiquement le moins agité, c’est-à-dire le plus froid. Cette constatation intuitive est formalisée par le second principe de la thermodynamique.
Propriétés
Le travail et la chaleur ne sont pas des variations de fonctions d’état. Leurs valeurs au cours d’une transformation, dépendent de la façon dont on procède pour réaliser la transformation et non pas uniquement des états initial et final.
Voir aussi
Articles connexes
- Thermodynamique
- Deuxième principe de la thermodynamique
- Troisième principe de la thermodynamique
- Histoire de la thermodynamique et de la physique statistique
- Portail de la physique
- Portail de la chimie