Pluie acide
L'expression « pluie acide » désigne toute forme de précipitations anormalement acides. On distingue les retombées humides (pluie, neige, brouillard, smog...) des retombées sèches (particules fines, gaz).
Cette expression a été utilisée pour la première fois par Robert Angus Smith en 1872[1]. L'expression « pluie acide » est parfois employée dans le langage courant pour désigner un ensemble plus vaste de phénomènes, les dépôts acides : ceux-ci incluent les précipitations acides (pluies et condensation), mais aussi des poussières ou fumées ayant une action acidifiante sur leur environnement[2],[3],[4].
L'acidification des eaux météoritiques contribue à l'acidification des eaux de certaines sources, des eaux de ruissellement et des eaux de surface, ainsi qu'à l'acidification des océans. Les eaux plus acides dissolvent mieux certains produits toxiques et les font circuler, pouvant augmenter les risques de saturnisme quand elles circulent dans des tuyaux de plomb, ou des réseaux de distribution contenant des soudures au plomb (dans les Vosges par exemple, zone considérée comme particulièrement écologiquement vulnérable[5] à l'acidification en France).
Composition
Cette acidification est due à la présence dans l'atmosphère de gaz susceptibles de se dissoudre dans l'eau en formant des espèces acides. Il s'agit essentiellement des oxydes de soufre (SO2 et SO3) et d'azote (NO et NO2). Ces polluants réagissent dans l'atmosphère avec le dioxygène et l'eau pour former respectivement de l'acide sulfureux H2SO3 et de l'acide nitrique HNO3. D'autres acides peuvent intervenir dans une moindre mesure : acide chlorhydrique, acide fluorhydrique, ammonium, acide formique, acide acétique...
Acidité de l'eau de pluie
L'acidité d'une solution aqueuse est mesurée par son pH :
- une solution de pH < 7 est dite acide ; plus son pH s'éloigne de 7 (diminue) et plus elle est acide ;
- une solution de pH = 7 est dite neutre ;
- une solution de pH > 7 est dite basique ; plus son pH s'éloigne de 7 (augmente) et plus elle est basique.
L'échelle de pH est une échelle logarithmique, ce qui signifie que lorsque le pH diminue d'une unité (dans le domaine acide), l'acidité de la solution est multipliée par 10. Ainsi, une solution de pH = 3 est 10 fois plus acide qu'une solution de pH=4, 100 fois plus acide qu'une solution de pH=5.
Dans des conditions normales, le pH de l'eau de pluie se situe autour de 5,6 (mais peut osciller entre 3,8 et 8)[6]: elle est donc naturellement légèrement acide, en raison essentiellement de la solvatation de dioxyde de carbone atmosphérique, qui forme de l'acide carbonique H2CO3 selon la réaction :
- CO2(aq) + H2O(l)
 H2CO3(aq)
H2CO3(aq)
On parle donc généralement de pluie acide lorsque le pH de l'eau est inférieur à 5.
Origine des polluants
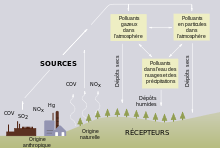

L'acidification peut être due à des émissions locales de polluants, mais aussi à des polluants transportés sur des centaines, voire des milliers de kilomètres. L'acidité de ces retombées a deux origines principales :
- des sources naturelles ou semi-naturelles : émissions volcaniques soufrées, oxydes d'azote produits par la foudre, gaz issus de certaines formes de décomposition biologique terrestres, ou émis par les océans, feux de forêts…
- des sources anthropiques, dont l'industrie, les centrales thermiques, le chauffage et les transports…
Les pluies acides résultent essentiellement de la pollution de l’air par le dioxyde de soufre (SO2) produit par l’usage de combustibles fossiles riches en soufre, ainsi que des oxydes d’azote (NOx) qui se forment lors de toute combustion de l’atmosphère, produisant de l'acide nitrique.
En ce qui concerne l’action humaine sur l'environnement, les usines, le chauffage et la circulation automobile sont les principales sources. L'acide chlorhydrique issu de l'incinération de certains déchets plastiques, et l'ammoniac généré par les activités agricoles contribuent également aux pluies acides[7].
Le composé azoté responsable de l'acidification des pluies est l'oxyde d'azote[8] issu des combustions d'énergie fossile[9] (charbon, pétrole et gaz) ou plus rarement de biomasse. Dans les sols, l'ammoniac est métabolisé par les bactéries du cycle de l'azote, ce qui le convertit en nitrite puis nitrate, qui forme le couple H+NO3- et contribue donc à acidifier le sol[10],[11], mais n'est pas émis dans l'atmosphère.
D'autres produits, tels que par exemple le dioxyde de carbone (CO2) qui produit de l'acide carbonique lorsqu'il se dissout dans l'eau, et les acides fluorhydriques sont en cause, mais moindrement[réf. nécessaire].
Répartition géographique et tendances récentes
Les pays industriels ont été les premiers touchés ; les principales zones de production de polluants ont d'abord été les bassins miniers et industriels de l'hémisphère nord, dont la Ruhr, la Lombardie, les anciens pays miniers français et anglais et ceux de Chine et des États-Unis.
Portés par les vents dominants, les acides circulent dans l'atmosphère avec les masses d'air. Ainsi une bonne partie des pluies acides de Scandinavie résultent des polluants accumulés par les masses d'air venant de la mer et ayant survolé l'Angleterre, la France et l'Allemagne. En Europe, en 1995, les charges critiques pour l'acidification étaient dépassées sur 75 millions d'hectares de sols forestiers d'Europe, et l'acidification des sols a localement contribué à exacerber l'érosion des sols touchant à cette époque environ 115 millions d'hectares, et entraînant une chute de la fertilité agricole et naturelle [12]
En Europe, grâce à l'usage de fuels et gaz mieux désoufrés et aux délocalisations industrielles, les retombées de soufre ont localement fortement diminué des années 1980 à 2000[13]. En 2000, « les dépôts acides restaient encore supérieurs aux seuils jugés critiques dans certaines parties d’Europe occidentale, mais le pourcentage de forêts affectées dans l’UE des 25 devrait décroître, passant de 23 % en 2000 à 13 % en 2020. L’ammoniaque devrait représenter la principale source d'acidification à l’avenir »[14].
Avec les délocalisations industrielles et l'accroissement de l'utilisation de pétrole et charbon en Asie, les pics sont apparus en Asie du Sud-Est et surtout en Chine où les régions du sud-est sont très touchées par les pluies acides ; les émissions d’oxydes d’azote et de dioxyde de soufre étaient vers 2005/2007 devenues 8 à 9 fois plus élevées en Chine que dans les pays développés[15]. Les pluies acides touchent également le Japon[16]. La Chine est devenue le premier émetteur d'oxyde d'azote et de dioxyde de soufre du monde, ainsi que de CO2, mais en grande partie pour produire des biens consommés dans d'autres pays.
Conséquences des pluies acides
L'acidification des précipitations a des conséquences sur les champignons, les lichens et les végétaux (dont certains sont considérés comme bioindicateurs).
Elle entraîne également l'acidification des sols, de certaines eaux douces de surface[17] (lacs d'Europe du Nord par exemple) et l'acidification des océans.
L'acidité des lacs ou d'autres grandes masses d'eau empêche le développement normal des espèces et des végétaux qu'ils abritent et peut en modifier les équilibres écologiques et par suites les services écosystémiques fournis par les zones humides et les milieux aquatiques. La flore aquatique et riveraine est affaiblie, résiste moins bien aux maladies et aux hivers rigoureux. Les eaux et sols acidifiés libèrent plus facilement les métaux lourds ou métalloïdes contenus dans les sédiments et les sols des berges, qui peuvent alors contaminer l'écosystème et/ou affaiblir les arbres, voire les tuer dans les cas graves. La chaîne alimentaire est alors également touchée, et tous les animaux qui y participent ou en dépendent. Les oiseaux et mammifères aquatiques sont en particulier touchés. Des traitements par épandage de produits calcaires sont faits pour éviter la stérilisation de grands lacs d'Europe du Nord. La part des acides naturels (acides organiques essentiellement) et des acides d'origine anthropique pourrait jouer un rôle [18] ; par exemple en Nouvelle-Zélande on trouve des eaux brunes très acides (souvent pH de 4) en raison de teneurs élevées en acides organiques, avec alors plus de 90% de l'aluminium dissous lié à de la matière organique, alors que dans des milieux acidifiés par l'Homme dans l'Hémisphère nord (où l'aluminium est présent sous une forme plus bioassimilable et toxique[19]), les poissons ont déjà disparu à un pH inférieur à 5[18]. Dans le Westland de Nouvelle-Zélande 9 des 14 espèces natives de poissons sont trouvés dans les eaux brunes et acides a un pH inférieur à 5, et 7 espèces sont encore trouvées à un pH inférieur à 4.5 [18]. De même chez les invertébrés : 34 des 37 taxons d'insectes aquatiques les plus communs sont trouvés dans les cours d'eau du Westland à un pH < 5, pour 24 encore trouvés à un pH de moins de 4.5[18]. Les espèces du Westland sont clairement adaptées aux milieux acides et il est possible que de telles souches acidorésitantes se substituent discrètement à d'autres espèces dans les milieux récemment acidifiés par l'Homme[18].
Conséquences sur la flore

Les conséquences sur la flore sont nombreuses, et comprennent à la fois les conséquences directes de l'acidité du sol, mais aussi un appauvrissement du sol en raison d'un lessivage accru en milieu acide.
Certains champignons phytopathogènes comme Rhytisma acerinum peuvent être favorisés[20].
Effets sur la faune
Les effets sur la faune sont plausibles et probables, mais mal cernés faute d’études. Certains lacs scandinaves étaient dans les années 1980-1990 devenus si acides, que les poissons et crustacés y disparaissaient complètement. Certains ont fait l’objet de déversement de chaux pour tamponner leur pH. De manière synergique avec d'autres pollutions (eutrohisation notamment) l'acidification des lacs et des cours d'eau peut fortement modifier la composition des populations de poissons et invertébrés[21].
Les effets peuvent être directs par attaque de la peau, des cuticules, muqueuses et organes respiratoires par les polluants acides de l’air, ou par contact externe ou interne avec l’eau polluée (comme on le voit dans le film Microcosmos : Le Peuple de l'herbe, de nombreux insectes boivent les gouttes de rosée). Des effets indirects, différés et en cascade sur les écosystèmes et le réseau trophique existent, évidents par exemple quand des populations entières d’arbres meurent.
Les chlorures, fluorures et métaux lourds peuvent mieux circuler et s’accumuler dans le sol ou le sédiment acidifié, à des niveaux toxiques pour les invertébrés. Les espèces sensibles ou plus vulnérables (filtreurs) aux métaux sont substituées par ceux qui sont plus tolérants. Ainsi, les espèces aux corps mous tels que les vers de terre et les nématodes semblent être affectés plus facilement par les concentrations élevées en métaux (sauf les enchytraéidés qui y résistent mieux).
Par ailleurs, les invertébrés jouent un rôle important dans la décomposition des détritus sur le sol des forêts. Or, pendant que les détritus s'y accumulent, la libération des éléments minéraux est retardée et la biodisponibilité des éléments nutritifs aux plantes est réduite. Les herbivores sont finalement affectés quand la quantité ou la qualité de leur approvisionnement alimentaire diminue.
En outre, bien que les oiseaux et les mammifères ne soient pas directement affectés par l'acidification de l'eau, ils y sont indirectement par des changements dans la qualité et la quantité de leurs ressources en nourriture. En Écosse, par exemple, les loutres sont plutôt rares autour des ruisseaux et des rivières acides parce que leurs approvisionnements principaux, les poissons, sont réduits.
De plus, le calcium est un élément essentiel pour les mammifères et les oiseaux et un approvisionnement diététique adéquat leur est crucial pendant la reproduction (les oiseaux ont besoin de calcium pour la bonne formation des coquilles d’œufs et pour la croissance squelettique de leurs progénitures. Les mammifères femelles en ont besoin pour le développement squelettique de leurs fœtus. Enfin, beaucoup d'espèces invertébrées, dont par exemple mollusques et les crustacés ont des besoins en calcium qui ne peuvent plus être satisfaits au-delà d'un certain seuil de pH. Elles sont parmi les premières à disparaître en cas d'acidification des terres marécageuses ou d'eaux douces ou marines.
Effets sur le patrimoine bâti et historique
L’acidité des pluies peut accélérer l'érosion naturelle de nombreux matériaux, notamment calcaires, ainsi que la corrosion de certains métaux (le plomb qui tient les vitraux). Les pierres calcaires tendres, certains marbres et tuffeaux y sont les plus sensibles. Cela a d’abord été remarqué en Europe sur de nombreuses cathédrales dont la pierre s’est rapidement dégradée de la fin du XIXe siècle aux années 1990, par exemple en Angleterre pour les cathédrales telles que la cathédrale d'York et l'abbaye de Westminster. De nombreux autres bâtiments et éléments construits du patrimoine mondial ont été attaqués ces dernières années par l’acidité de l’air, dont par exemple le Taj Mahal en Inde et le Colisée à Rome, surtout dans les régions industrielles.
Réactions, évolutions législatives
Les pluies acides sont une « pollution planétaire » et constituent pour cette raison un problème international.
La conférence internationale sur l'arbre et la forêt SILVA se tient à la Sorbonne, à Paris, en février 1986 : autour du président français François Mitterrand et du chancelier ouest-allemand Helmut Kohl, dont les deux pays sont lourdement touchés par les pluies acides, une soixantaine de chefs d'État et de gouvernement débattent des actions à mener.
En 1988, un traité (Convention sur la pollution atmosphérique transfrontalière à longue portée ; Convention on Long-Range Transboundary Pollution) a engagé les signataires à limiter les émissions d'oxydes d'azote à leur niveau de 1987.
En Europe, la Commission économique se préoccupe de la question, avec des normes européennes et nationales qui ont permis une forte diminution de la pollution acide de l’air des années 1980 aux années 2000. Mais alors que les émissions terrestres diminuaient fortement, les émissions du transport maritime augmentaient tant, qu'à ce rythme en 2015, les seules émissions des navires croisant au large de l'UE 25 émettront plus de SO2 que toutes les sources terrestres de l'UE-25[22].
Diverses législations cherchent à limiter le niveau de polluants libérés pour l'adapter à la charge critique (niveau maximal de polluants pouvant être tolérés) du milieu, voire moins. Pour cela, la composition de certains carburants a été modifiée, et certains moteurs ont été adaptés. Des filtres ou des purificateurs d'air sont installés sur les cheminées d'usines polluantes. Le pot catalytique est obligatoire dans un nombre croissant de pays, avec des résultats encore discutés pour certains paramètres.
Notes et références
- ↑ Air et pluies : les débuts de la climatologie chimique, R. A. Smith, employée à propos de ses impacts sur la ville industrielle de Manchester et alentours.
- ↑ Les pluies acides, Environnement Canada
- ↑ La mosaïque nord-américaine : Aperçu des principaux enjeux environnementaux, Dépôts acides, Commission de coopération environnementale d'Amérique du Nord
- ↑ Pluie acide, Fondation de l'Eau Potable Sûre
- ↑ Felten, V. (2003). Effets de l'acidification des ruisseaux vosgiens sur la biologie, l'écologie et l'écophysiologie de Gammarus fossarum Koch, 1835 (Crustacea Amphipoda): Approche intégrée à différents niveaux d'organisation (Doctoral dissertation, Metz).
- ↑ La qualité de l'eau et l'assainissement en France (rapport du Sénat)
- ↑ Source : Ademe : pluies acides et acidification
- ↑ http://www2.ademe.fr/servlet/list?catid=16029
- ↑ http://www.citepa.org/fr/pollution-et-climat/polluants/aep-item/oxydes-d-azote
- ↑ http://naei.defra.gov.uk/overview/issues?issue_id=7
- ↑ http://ammoniabmp.colostate.edu/link%20pages/impacts%20of%20ammonia.html
- ↑ évaluation DOBRIS Agence européenne pour l'environnement 1994
- ↑ CHMI (2003). Air pollution in the Czech Republic in 2003. Czech Hydrometeorological Insitute, Air Quality Protection Division http://www.chmi.cz/uoco/isko/groce/gr03e/ akap3.html (Consulté 2007/04/21)
- ↑ Rapport GEO-4 (Version française), PNUE, 2007, PDF, 574 pages
- ↑ Liaowang Xinwen Zhoukan, « Ces milliards perdus à cause de la pollution », dans Courrier international no 853, du 8 au 14 mars 2007, p. 36 : extrait du « Rapport 2004 sur l’évaluation de l’économie nationale verte en Chine » écrit par l’Administration nationale pour la protection de l’environnement (SEPA)
- ↑ Michel Temman, « Victime de ses rejets, Tokyo aide Pékin à se mettre au vert », dans Libération du 16/04/2007, [lire en ligne]
- ↑ Schindler DW (1988) Effects of acid rain on freshwater ecosystems. Science(Washington), 239(4836), 149-157.
- 1 2 3 4 5 Collier, K. J., Ball, O. J., Graesser, A. K., Main, M. R., & Winterbourn, M. J. (1990). Do organic and anthropogenic acidity have similar effects on aquatic fauna?. Oikos, 33-38 (résumé)
- ↑ Baker JP & Schofield CL (1982) Aluminum toxicity to fish in acidic waters. In Long-Range Transport of Airborne Pollutants (pp. 289-309). Springer Netherlands.
- 1 2 Bevan, R. J., & Greenhalgh, G. N. (1976) Rhytisma acerinum as a biological indicator of pollution. Environmental Pollution (1970), 10(4), 271-285 (résumé)
- ↑ Tammi J, Appelberg M, Beier U, Hesthagen T, Lappalainen A, Rask M. (2003), Fish status survey of Nordic lakes : effects of acidification, eutrophication and stocking activity on present fish species composition Ambio. Mar; 32(2):98-105
- ↑ Source l : ONG AcidRain, 2005
Voir aussi
Articles connexes
- Pollution de l'air
- Aérosol
- Acidification des sols
- Acidification des eaux douces
- Acidification des océans
Liens externes
- Portail internet d'Airclim (ONG spécialisée dans le domaine des pollutions acides de l'air) (en)
Bibliographie
- Dangles, O., Malmqvist, B., & Laudon, H. (2004). Naturally acid freshwater ecosystems are diverse and functional: evidence from boreal streams. Oikos, 104(1), 149-155.
- Freda J & Dunson WA (1986) Effects of low pH and other chemical variables on the local distribution of amphibians. Copeia, 454-466 (résumé).
- Harriman, R., & Morrison, B. R. S. (1982). Ecology of streams draining forested and non-forested catchments in an area of central Scotland subject to acid precipitation. Hydrobiologia, 88(3), 251-263 (résumé).
- Hendrey, G. R., Baalsrud, K., Traaen, T. S., Laake, M., & Raddum, G. (1976) Acid precipitation: some hydrobiological changes. Ambio, 224-227 (résumé).
- McDonald, D. G., Freda, J., Cavdek, V., Gonzalez, R., & Zia, S. (1991) Interspecific differences in gill morphology of freshwater fish in relation to tolerance of low-pH environments. Physiological zoology, 124-144 (résumé).
- Magnuson, J. J., Baker, J. P., Rahel, E. J., & Kramer, J. R. (1984) A Critical Assessment of Effects of Acidification on Fisheries in North America [and Discussion]. Philosophical Transactions of the Royal Society of London. B, Biological Sciences, 305(1124), 501-516.
- Roqueplo P (2001) Pluies Acides ; Menaces pour l'Europe ; éditeur : Economica,
- McNeill JR : Something New Under the Sun - An Environmental History of the Twentieth-Century World (New York: Norton, 2000), chap. 4. Trad. fr. Du nouveau sous le soleil: Une histoire de l'environnement mondial au XXe siècle (Seyssel: Champ Vallon, 2010).
- Schindler DW (1988) Effects of acid rain on freshwater ecosystems. Science (Washington), 239(4836), 149-157.
Filmographie
- Film pédagogique de l'INRA sur l'histoire de la prise de conscience du phénomènes des pluies acides et de leurs conséquences
- Portail de la chimie
- Portail de l’écologie
- Portail de l’environnement
