Physiologie des dinosaures
- Note : Dans cet article, le mot « dinosaure » signifie « dinosaure non-avien », à savoir les dinosaures sans les oiseaux (Avialae), puisque, à l'heure actuelle, les experts considèrent majoritairement les oiseaux comme un groupe évolué de dinosaures.
La physiologie des dinosaures a toujours été un sujet de controverse, en particulier en ce qui concerne leur thermorégulation. Récemment, de nombreuses informations nouvelles ont été apportées sur la physiologie des dinosaures en général, non seulement sur les systèmes métaboliques et de thermorégulation, mais aussi sur les appareils respiratoires et cardiovasculaires.

Pendant les premières années d'étude de la paléontologie des dinosaures, on a souvent pensé que les dinosaures étaient de gigantesques lézards lents et lourds. Cependant, avec la découverte, commencée dans les années 1870, de beaucoup plus de squelettes complets dans l'ouest des États-Unis, les scientifiques purent faire des reconstitutions plus précises de la biologie et de la physiologie des dinosaures. Edward Drinker Cope, adversaire de Othniel Charles Marsh dans la guerre des os, pensait qu'au moins quelques dinosaures étaient actifs et agiles, comme on peut le voir dans la peinture ci-contre montrant le combat de deux Laelaps, réalisée sous sa direction par Charles R. Knight[1]. En parallèle, le développement de la théorie de l'évolution de Charles Darwin et les découvertes de fossiles d’Archaeopteryx et de Compsognathus, conduisirent Thomas Henry Huxley à envisager que les dinosaures soient étroitement liés aux oiseaux[2]. Malgré ces découvertes, l'image des dinosaures comme étant de grands reptiles était solidement ancrée[1], et pendant la première moitié du XXe siècle, on a admis que la plupart des aspects de leur paléobiologie étaient typiquement reptiliens[3]. À partir des années 1960 et de la renaissance des dinosaures, les points de vue sur les dinosaures et leur physiologie ont considérablement changé, notamment à la suite de la découverte des dinosaures à plumes dans les dépôts du Crétacé inférieur en Chine, montrant que les oiseaux ont évolué à partir de dinosaures maniraptoriens très agiles.
Historique
Les premières représentations de la vie des dinosaures (de 1820 à 1960)
L'étude des dinosaures a commencé dans les années 1820 en Angleterre. Les pionniers dans ce domaine, tels que William Buckland, Gideon Mantell et Richard Owen ont eu à interpréter pour la première fois le mode de vie grands animaux quadrupèdes à partir d'ossements et de restes fossilisés très fragmentaires[4]. On peut voir leur travail aujourd'hui dans les dinosaures de Crystal Palace, une série de sculptures réalisée dans les années 1850 qui présente les dinosaures connus à l'époque comme de gigantesques lézards[5]. En dépit de cette apparence reptilienne, Owen pensait que le cœur et l'appareil respiratoire des dinosaures étaient plus proches de ceux des mammifères que de ceux des reptiles[4].
Nouveaux points de vue à la "renaissance des dinosaures"
Toutefois, vers la fin des années 1960, les opinions vont commencer à changer, avec d'abord les travaux de John Ostrom sur Deinonychus et l'évolution des oiseaux[6]. Un de ses élèves, Robert Bakker, a vulgarisé ce changement de conception dans une série d'articles qui commença par The superiority of dinosaurs (la supériorité des dinosaures) en 1968[7]. Dans ces publications, il soutenait avec acharnement que les dinosaures étaient des animaux à sang chaud et actifs, capables même de longues périodes de forte activité. Dans la plupart de ses écrits, Bakker formulait ses arguments comme de nouvelles preuves conduisant à une renaissance des idées populaires à la fin du XIXe siècle et tombées dans l'oubli, parlant fréquemment d'une renaissance des dinosaures en cours. Il utilisa une série d'arguments anatomiques et statistiques pour défendre son point de vue[8],[9], dont la méthodologie a été âprement discutée parmi les scientifiques[10].
Ces débats ont suscité beaucoup d'intérêt, et de nouvelles méthodes pour mieux connaitre la paléobiologie des animaux disparus, comme l'histologie osseuse, ont été appliquées avec succès à la détermination de la vitesse de croissance de nombreux dinosaures.
Aujourd'hui, on admet de façon générale que de nombreux dinosaures, et peut-être même tous, avaient un métabolisme plus important que les reptiles actuels, mais aussi que le problème est plus complexe et varié que ce que Bakker a initialement affirmé. Par exemple, on sait qu'alors que les petits dinosaures étaient de vrais endothermes, les plus grands auraient pu être des gigantothermes[11],[12], et de nombreux dinosaures auraient pu avoir des métabolismes intermédiaires[13].
Alimentation et système digestif
Les premiers dinosaures étaient presque certainement des prédateurs et partageaient plusieurs caractéristiques avec leurs plus proches parents prédateurs non-dinosauriens comme le Lagosuchus : ils avaient des dents relativement grandes, courbes, en forme de lame, dans une grande gueule à large ouverture qui se refermait comme des ciseaux ; ils avaient aussi un abdomen relativement petit, car les carnivores n'ont pas besoin d'un important système digestif. Les dinosaures qui ont suivi et qui sont considérés comme des prédateurs, ont parfois augmenté de beaucoup leur taille mais ont gardé le même ensemble de fonctionnalités. Ils ne mâchaient pas leur nourriture, mais l'avalaient entière[14].
Les habitudes alimentaires des ornithomimosaures et oviraptorosaures sont encore un mystère ; même si on sait qu'ils ont évolué à partir d'une lignée de théropodes prédateurs, ils avaient de petites mâchoires et n'avaient pas les dents alignées comme des lames de couteau (comme celles retrouvées chez les prédateurs typiques), et on n'a aucune trace de leur régime alimentaire ou de la façon dont ils mangeaient et digéraient[14].
D'autres groupes de dinosaures avaient des caractéristiques montrant qu'ils étaient végétariens : des mâchoires qui s'ouvraient faiblement et se refermaient un peu comme des volets, de telle sorte que toutes les dents ne se réunissaient pas en même temps ; un abdomen de grande taille pour accueillir les grandes quantités de végétation qu'ils devaient manger et stocker pendant un certain temps, car les végétaux sont plus difficiles à digérer que la viande ; ces grands appareils digestifs pouvaient certainement aussi contenir des microorganismes symbiotiques capables de digérer la cellulose, car aucun gros animal connu ne peut digérer ce matériau directement[14].
Les sauropodes, qui étaient végétariens, ne mâchaient pas leurs aliments, leurs dents et leurs mâchoires ne semblant convenir que pour arracher des feuilles. Les ornithischiens végétariens montrent une grande variété d'approches. Les ankylosaures et les stégosaures avaient une petite tête, des mâchoires et des dents fragiles et on pense qu'ils se nourrissaient de la même façon que les sauropodes. Les pachycéphalosaures avaient aussi une petite tête, des mâchoires et des dents faibles, mais l'absence d'un grand appareil digestif suggère un régime alimentaire différent, peut-être fait de fruits, de graines ou de jeunes pousses, ce qui aurait été plus nutritif que les feuilles[14].
D'autre part, les ornithopodes comme Hypsilophodon, Iguanodon et divers hadrosaures avaient un bec corné qui leur servait à arracher les végétaux et des mâchoires et des dents bien adaptées à la mastication. Les cératopsiens avaient des mécanismes similaires[14].
On a souvent pensé que certains dinosaures au moins avaient l'habitude d'avaler des pierres, connues sous le nom de gastrolithes, pour faciliter la digestion en broyant les aliments dans leur gésier musculeux, partageant cette caractéristique avec les oiseaux. En 2007, Oliver Wings a examiné les articles sur les gastrolithes dans la littérature scientifique et y a trouvé beaucoup de confusion, à commencer par l'absence d'une définition objective et commune. Il a trouvé que les pierres et les grains de sable avalés pouvaient aider à digérer les oiseaux qui se nourrissaient principalement de céréales, mais que ce rôle n'était peut-être pas essentiel, et que les oiseaux qui se nourrissent d'insectes en été et de céréales en hiver s'en débarrassent généralement en été. On a souvent écrit que les gastrolithes avaient joué un rôle important dans la digestion très poussée nécessaire pour les végétaux chez les sauropodes mais Wings en est arrivé à ce que cette idée était erronée : on retrouve des gastrolithes chez seulement un petit nombre de fossiles de sauropodes et, lorsqu'on en retrouve, ils sont trop petits et dans de nombreux cas trop mous pour avoir pu réussir à broyer la nourriture ; de plus, la plupart d'entre eux sont très polis, alors que les gastrolithes utilisés par les animaux modernes sont rugueux par suite de l'usure et de la corrosion par les acides de l'estomac, et par conséquent les gastrolithes des sauropodes ne seraient probablement dus qu'à une ingestion accidentelle. D'autre part il a conclu que les gastrolithes trouvés chez des fossiles de dinosaures théropodes évolués tels que Sinornithomimus et Caudipteryx ressemblent à ceux des oiseaux, et que l'utilisation de gastrolithes pour le broyage des aliments aurait pu apparaître seulement au début de l'apparition de ce groupe de dinosaures[15],[16].
Biologie de la reproduction
Lorsqu'elles sont en période de ponte, les femelles de certaines espèces d'oiseaux développent un type spécial d'os dans leur membres entre l'os dur externe et la moelle. Cet os médullaire, qui est riche en calcium, est utilisé pour fabriquer les coquilles d'œufs et disparait lorsqu'elles ont fini de pondre[17]. Cet os a été retrouvé dans les fossiles des théropodes Tyrannosaurus et Allosaurus et chez l'ornithopode Tenontosaurus[17],[18].
Comme, au cours de l'évolution, la lignée de dinosaures qui comprend Allosaurus et Tyrannosaurus s'est écartée très tôt de la lignée qui a conduit à Tenontosaurus, la présence d'os médullaire dans les deux groupes suggère que les dinosaures en général produisaient ce tissu médullaire. Les crocodiliens, d'autre part, qui sont les plus proches parents vivants des dinosaures après les oiseaux, ne fabriquent pas d'os médullaire. Ce tissu est peut-être apparu chez les ornithodires, un clade d'Archosaure du Trias à partir duquel sont censés provenir les dinosaures[17].
De l'os médullaire a été retrouvé chez des individus pas encore adultes, ce qui suggère que les dinosaures atteignaient leur maturité sexuelle avant d'être adultes. On retrouve la même chose chez les reptiles et les moyens et grands mammifères mais les oiseaux et les petits mammifères n'atteignent leur maturité sexuelle qu'après avoir fini leur développement - ce qui se passe toujours dans leur première année d'existence. La maturité sexuelle précoce est aussi associée à des caractéristiques spécifiques du cycle de vie des animaux : les jeunes naissent relativement bien développés et la mortalité chez les adultes qui mettent bas est élevée[17].
Appareil respiratoire
Sacs aériens
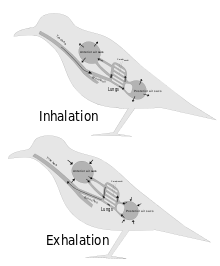
À partir des années 1870, les scientifiques admirent généralement que les squelettes de nombreux dinosaures contenaient des cavités remplies d'air (appelées pleurocèles), en particulier au niveau des vertèbres. Pendant longtemps, on a considéré ces cavités comme de simples dispositifs de gain de poids, mais Bakker a proposé qu'elles puissent avoir contenu des sacs aériens analogues à ceux des oiseaux qui ont le système respiratoire le plus efficace de tous les animaux[9].
John Ruben et collaborateurs ont contesté cette hypothèse et ont suggéré que les dinosaures avaient un système respiratoire (inspiration et expiration) utilisant un mécanisme à piston hépatique ressemblant à celui des crocodiles : les muscles attachés principalement au pubis tirent le foie vers l'arrière, ce qui, en dilatant les poumons, provoque l'inspiration, et au relâchement des muscles, le retour des poumons à leur taille et forme précédente et donc l'expiration. Ils ont également présenté cela comme une raison de douter que les oiseaux descendent des dinosaures[19],[20],[21],[22],[23].
Les critiques ont fait valoir que, sans les sacs aériens aviaires, les quelques modestes améliorations trouvées dans les systèmes circulatoires et respiratoires des reptiles modernes leur permettent d'atteindre 50 % à 70 % de la consommation d'oxygène d'un mammifère de même taille[24] et que l'absence de sacs aériens chez les dinosaures n'aurait pas empêché le développement d'un système endothermique[25]. On a apporté très peu de réfutations formelles dans les revues scientifiques aux affirmations de Ruben sur ce sujet, mais il faut remarquer que le Sinosauropteryx, sur lequel se fonde une grande partie de son argumentation, était un animal très aplati et qu'il est donc impossible de dire si le foie avait la forme idéale pour agir dans le cadre d'un mécanisme respiratoire à piston hépatique[26]. Quelques publications récentes notent simplement, sans autre commentaire, que Ruben s'est prononcé contre la présence de sacs aériens chez les dinosaures[27].
Les chercheurs ont présenté des preuves et des arguments pour la présence de sacs aériens chez les sauropodes, les « prosauropodes », les cœlurosaures, les cératosaures et les théropodes Aerosteon et Coelophysis.
Chez les sauropodes évolués (néosauropodes) les vertèbres du bas du dos et les hanches montrent des signes de présence de sacs aériens. Chez les premiers sauropodes, seules les vertèbres cervicales montraient de telles caractéristiques. Si la séquence de développement des embryons d'oiseaux peut servir de modèle, les sacs aériens apparaissent effectivement avant l'ébauche du squelette qui les incorpore plus tard[28],[29].
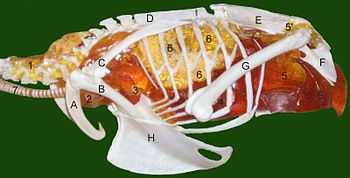

Des traces de l'existence de sacs aériens ont également été trouvés chez les théropodes. Des études indiquent que les fossiles de cœlurosaures[30], Cératosaures[27], et les Théropodes Coelophysis et Aerosteon avaient des sacs aériens. Coelophysis, à partir de la fin du Trias, est l'un des premiers dinosaures dont les fossiles présentent des ébauches de sacs aériens[29]. Aerosteon, un Allosaure du Crétacé supérieur, avait les sacs aériens le plus proches de ceux qu'on trouve chez les oiseaux à ce jour[31].
Les premiers sauropodomorphes, y compris le groupe appelé traditionnellement « prosauropodes », avaient peut-être aussi des sacs aériens. Il est possible que l'on ait trouvé des indentations pneumatiques chez Plateosaurus et Thecodontosaurus, mais si c'était le cas, elles seraient très petites. Une étude réalisée en 2007 a conclu que les prosauropodes avaient probablement des sacs aériens abdominaux et cervicaux, sur la base des éléments de preuve fournis par leurs taxons étroitement apparentés (théropodes et sauropodes). L'étude a conclu qu'il était impossible de déterminer si les prosauropodes avaient un système respiratoire analogue aux oiseaux, mais les sacs aériens étaient presque certainement présents[32].
Jusqu'à présent, aucune preuve de l'existence de sacs aériens n'a été trouvée chez les dinosaures ornithischiens. Mais cela ne signifie pas que les ornithischiens ne pouvaient pas avoir un métabolisme comparable à celui des mammifères, puisque les mammifères n'ont pas non plus de sacs aériens[33].
Trois explications ont été proposées pour le développement de ces sacs chez les dinosaures[31] :
- Augmentation de la capacité respiratoire. C'est sans doute l'hypothèse la plus commune, et qui s'accorde bien avec l'idée que de nombreux dinosaures avaient des métabolismes assez élevés.
- Amélioration de l'équilibre et de la maniabilité en abaissant le centre de gravité et en réduisant le moment d'inertie en rotation. Cependant, cela n'explique pas l'existence des sacs aériens chez les sauropodes quadrupèdes.
- Système de refroidissement. Il semble que les sacs aériens et les plumes soient apparues à peu près en même temps chez les cœlurosaures. Si les plumes conservaient la chaleur de leur propriétaire, il fallait un moyen de dissiper la chaleur excessive. Cette idée est plausible, mais a besoin d'un soutien empirique
Les calculs des volumes des différentes parties de l'appareil respiratoire du sauropode Apatosaurus confirment la présence de sacs aériens semblables à ceux des oiseaux chez les sauropodes :
- En supposant que les Apatosaurus, qui font partie des plus proches dinosaures des actuels crocodiliens et oiseaux, n'aient pas eu de diaphragme, le volume mort d'un individu de 30 tonnes aurait été d'environ 184 litres. Le volume mort représente le volume total de la bouche, de la trachée et des autres voies aériennes. Si l'animal exhale moins que cela, il ne chasse pas l'air vicié qui est donc réaspiré dans les poumons lors de l'inhalation suivante.
- Les estimations de son volume courant - la quantité d'air inspirée ou expirée lors d'un mouvement respiratoire standard - dépendent du type d'appareil respiratoire de l'animal : il est estimé à 904 litres avec un système aviaire ; 225 litres avec un système de mammifères ; 19 litres avec un système reptilien.
Sur ces bases, on constate qu'un Apatosaurus ne pouvait pas avoir un système respiratoire de reptile ou même de mammifère, qui n'aurait fourni aux poumons qu'environ 225 - 184 = 41 litres d'air frais et oxygéné à chaque respiration. Apatosaurus avait donc un système respiratoire inconnu du monde moderne ou un analogue à celui des oiseaux, avec des sacs aériens multiples et en communication continue avec les poumons. En outre, un système respiratoire aviaire aurait eu besoin seulement d'un volume pulmonaire d'environ 600 litres tandis qu'il aurait eu besoin de 2 950 litres avec un système mammalien ce qui aurait dépassé les 1 700 litres d'espace disponible dans le thorax d'un Apatosaurus de 30 tonnes[34].
Les dinosaures avec des sacs aériens devaient être capables de maintenir un niveau d'activité plus élevé que celui que des mammifères de taille et de carrure semblable pourraient soutenir. En plus de fournir une alimentation très efficace en oxygène, ce système était aussi un mécanisme efficace de refroidissement, ce qui est essentiel pour des animaux actifs, mais trop grands pour se débarrasser de l'excès de chaleur par la peau[33].
Apophyses uncinées
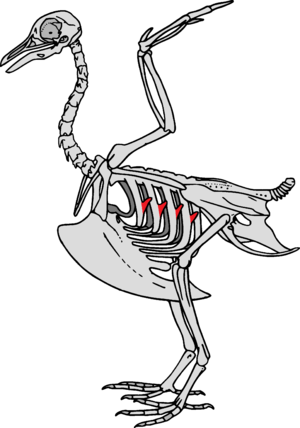
Les oiseaux ont des excroissances osseuses appelées apophyses uncinées sur les bords arrière de leurs côtes qui permettent aux muscles pectoraux d'avoir plus de force lors des mouvements respiratoires, ce afin d'améliorer leur apport en oxygène. La taille de ces apophyses est liée au mode de vie de l'oiseau et à ses besoins en oxygène: elles sont plus courtes chez les oiseaux qui ne font que courir et plus longues chez les oiseaux plongeurs, qui ont besoin de reconstituer leur réserve d'oxygène plus rapidement quand ils remontent en surface. Les dinosaures non-aviaires maniraptoriens avaient également ces excroissances et elles étaient proportionnellement plus grandes que chez les actuels oiseaux plongeurs, ce qui indique que les Maniraptoriens avaient besoin de grandes quantités d'oxygène[35],[36].
Des plaques qui pourraient avoir eu le même rôle que les apophyses ont été signalées chez les fossiles de dinosaures ornithischiens Thescelosaurus et ont été interprétées comme la preuve d'une consommation d'oxygène élevée et donc d'un métabolisme important[37].
Cornets nasaux
Les cornets nasaux sont des os minces situés dans la cavité nasale. On les trouve chez la plupart des mammifères et les oiseaux, doublés avec des muqueuses qui remplissent deux rôles:
- elles améliorent le sens de l'odorat en augmentant la surface disponible pour absorber les substances chimiques en suspension, et
- elles réchauffent et humidifient l'air inhalé, et extraient la chaleur et l'humidité de l'air expiré, pour éviter la dessiccation des poumons.
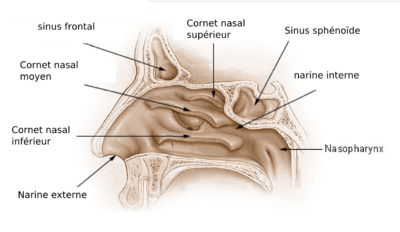
Ruben et ses collaborateurs ont fait valoir dans plusieurs articles[19],[20],[21],[38],[39] que :
- Aucune preuve de fosses nasales n'a été trouvé chez les dinosaures (les études ont porté sur des cœlurosauriens)
- Tous les dinosaures qu'ils ont examinés avaient les narines trop étroites et courtes pour accueillir des cornets.
- C'est pourquoi les dinosaures ne pouvaient pas avoir la respiration nécessaire pour maintenir un métabolisme comparable à celui des mammifères ou des oiseaux, parce que leurs poumons se seraient asséchés.
Cependant, des objections ont été soulevées contre ces arguments:
- Les cornets nasaux sont absents ou très petits chez certains oiseaux (par exemple les ratites, les procellariiformes et les falconiformes) et mammifères (par exemple, les baleines, les fourmiliers, les chauves-souris, les éléphants et la plupart des primates)[40],[41],[42],[43], bien que ces animaux soient endothermiques et dans certains cas très actifs.
- D'autres études concluent que les voies nasales des dinosaures étaient assez longues et assez larges pour accueillir des cornets ou des systèmes analogues chargés d'éviter la dessiccation des poumons[44].
- Les cornets nasaux sont fragiles et rarement retrouvés sur les fossiles. On n'en a retrouvé aucun chez des oiseaux fossiles.
Appareil cardiovasculaire

En principe, les dinosaures devaient avoir un système vasculaire à double circulation où le sang était propulsé par un coeur à quatre cavités, puisqu'il fallait une pression artérielle élevée pour fournir du sang à la tête, qui était située très au-dessus du sol, alors que les poumons des vertébrés ne peuvent supporter qu'une pression artérielle assez faible[33]. En 2000, un squelette de Thescelosaurus, aujourd'hui exposé au Muséum d'histoire naturelle de Caroline du Nord, a été décrit comme comprenant les vestiges d'un cœur à quatre cavités et une aorte. Les auteurs ont interprété la structure du cœur comme traduisant un métabolisme élevé chez Thescelosaurus[45], mais leurs conclusions ont été contestées. D'autres chercheurs ont publié un article où ils affirment que ce « cœur » est vraisemblablement en fait une concrétion minérale. Ils notent que l'anatomie de l'objet est incorrecte, par exemple la prétendue « aorte » est plus étroite à son abouchement avec le « cœur » et il manque les artères en partant ; le « cœur » envahit partiellement l'une des côtes et présente une structure en couches concentriques en certains endroits, et on retrouve une autre concrétion derrière la jambe droite[46]. Les premiers auteurs ont défendu leur position ; ils sont convenus que la poitrine contenait une concrétion, mais qu'elle s'était formée autour du cœur et de l'aorte, et en avait partiellement conservé les parties les plus musclées[47].
Indépendamment de l'origine exacte de l'objet, il y a peu d'intérêt à connaitre l'anatomie interne des dinosaures. Les crocodiles et les oiseaux modernes, les plus proches parents des dinosaures, ont un cœur à quatre cavités, bien que modifiées chez les crocodiliens, et il devait en être de même pour les dinosaures. Cependant ce type de cœur n'est pas nécessairement lié à un métabolisme élevé[48].
Croissance et cycle de vie
On n'a trouvé aucun œuf de dinosaure qui soit plus gros qu'un ballon de basket et des embryons de grands dinosaures, par exemple des Maiasaura, ont été retrouvés dans des œufs relativement petits[49]. Comme les mammifères, les dinosaures cessaient de croître quand ils avaient atteint la taille adulte typique de leur espèce, tandis que les reptiles adultes continuent à croître lentement s'ils ont suffisamment de nourriture. Les dinosaures grandissaient plus vite que les reptiles modernes de taille comparable, mais les comparaisons avec les animaux modernes « à sang chaud » dépendent de leur taille[50],[51] :
| Poids (kg) | Vitesse de croissance comparée à celle des animaux modernes | Animaux modernes de taille comparable |
|---|---|---|
| 0.22 | Plus faible que celle des marsupiaux | Rat |
| 1 - 20 | Semblable à celle des marsupiaux, plus faible que celle des oiseaux nidifuges (capables de courir à la naissance) | Du cochon d'Inde au Condor des Andes |
| 100 - 1000 | Plus rapide que celle des marsupiaux, semblable à celle des oiseaux nidifuges, plus faible que celle des animaux placentaires | Du Kangourou roux à l'Ours blanc |
| 1500 – 3500 | Semblable à celle de la plupart des animaux placentaires | Du Bison d'Amérique du Nord au rhinocéros |
| 25000 et plus | Très rapide, semblable à celle des baleines actuelles ; mais environ la moitié d'un oiseau nidicole (supposé amené à la même échelle, ce qui est peu réaliste) | Baleines |

Tyrannosaurus rex montrait une poussée de croissance adolescente"[52],[53] :
- ½ tonne à 10 ans
- une croissance très rapide jusqu'à 2 tonnes vers quinze à vingt ans (environ ½ tonne par an).
- une croissance négligeable après la vingtième année.
Une étude de 2008 d'un squelette du hadrosaure Hypacrosaurus aboutit à la conclusion que la croissance de ce dinosaure était encore plus rapide : il atteignait sa taille adulte vers 15 ans (cette conclusion provenant principalement de l'examen du nombre et de l'espacement des anneaux de croissance autour des os). Les auteurs considèrent que cela est consistant avec une théorie sur les cycles de vie affirmant que les proies devraient croître plus vite que leurs prédateurs si elles perdent beaucoup de jeunes et si l'environnement fournit assez de ressources pour une croissance rapide[54].
Il semble que les dinosaures aient eu une espérance de vie assez faible : le plus vieux Tyrannosaurus (à sa mort) découvert actuellement avait 28 ans, et le plus vieux sauropode en avait 38[52]. La prédation était probablement responsable du très haut taux de mortalité des jeunes dinosaures, et la compétition sexuelle de celui des dinosaures parvenu à l'âge de la reproduction[55].
Métabolisme
Le discours scientifique concernant le mode de vie, le métabolisme et la thermorégulation des dinosaures a évolué depuis leur découverte au milieu du XIXe siècle. D'important désaccords ont eu lieu sur la question de l'existence même de thermorégulation. Plus récemment[Quand ?], l'hypothèse de dinosaures à sang chaud (plus précisément, dotés d'un style de vie actif et d'une température corporelle à peu près constante) est devenue consensuelle [réf. nécessaire] et le débat s'est focalisé sur les mécanismes de la thermorégulation, et sur leur similitude avec ceux des oiseaux et des mammifères.
Les enjeux du débat
Le terme animal à sang chaud est en fait complexe et ambigu, recouvrant les différents aspects suivants :
- L’homéothermie, c'est-à-dire la capacité à maintenir une température corporelle à peu près constante. Les endothermes modernes ont des températures allant de 23 °C à 30 °C chez les monotrèmes et les paresseux, de 33 °C à 36 °C chez les marsupiaux, de 36 °C à 38 °C chez la majorité des placentaires (en dehors des cas d'hibernation), et de 41 °C chez les oiseaux[33].
- Le tachymétabolisme, c'est-à-dire le fait de maintenir un régime métabolique élevé, même au repos. Cela demande une température corporelle assez stable et élevée, les processus biochimiques étant environ deux fois moins rapide si la température diminue de 10 °C ; la plupart des enzymes ont de plus une température opérationnelle optimale, et leur efficacité diminue rapidement quand on s'en éloigne[56].
- L’endothermie, c'est-à-dire la capacité à engendrer de la chaleur par des processus internes, tels que la combustion des graisses, plutôt que, par exemple, en exerçant une activité musculaire ou en se baignant au soleil. Bien que l'endothermie soit, en principe, le moyen le plus fiable de maintenir une température interne à peu près constante, c'est une méthode coûteuse : les mammifères modernes ont besoin de 10 à 13 fois plus de nourriture que les reptiles modernes de même poids[33].
Les grands dinosaures peuvent aussi avoir conservé leur température interne par homéothermie inertielle (aussi appelée homéothermie de masse). En d'autres termes, la capacité thermique d'animaux aussi massifs était si grande qu'il aurait fallu plusieurs jours pour que leur température varie significativement, ce qui aurait lissé les variations dues aux variations quotidiennes entre le jour et la nuit. Cet effet a été observé chez les tortues géantes et les crocodiliens, mais Plateosaurus, qui pesait environ 700 kg, aurait sans doute été le plus petit dinosaure chez lequel ce mécanisme aurait pu être efficace ; pour des espèces plus petites, et pour les jeunes des espèces plus grandes, l'homéothermie inertielle n'aurait pas été possible[33]. La fermentation des végétaux au cours de la digestion peut également produire de grandes quantités de chaleur, mais cette forme d'homéothermie n'aurait pas été possible pour les carnivores, ni pour les petits herbivores ou pour les jeunes des grands herbivores[57].
Comme les mécanismes internes des espèces disparues nous restent inaccessibles, la plupart des discussions se focalisent sur l'homéothermie et le tachymétabolisme.
La détermination de l'intensité du métabolisme est compliquée par la distinction à faire entre métabolisme de base (le métabolisme au repos) et métabolisme en activité. Chez tous les reptiles modernes, ainsi que la plupart des mammifères et des oiseaux, la vitesse du métabolisme en pleine activité est de 10 à 20 fois plus grande qu'au repos ; chez quelques mammifères, ces vitesses peuvent différer d'un facteur de 70. Théoriquement, il serait même possible pour un vertébré terrestre d'avoir un métabolisme reptilien au repos et un métabolisme d'oiseau en pleine activité, mais il lui serait alors impossible de grandir rapidement. Les grands herbivores sauropodes peuvent avoir été si constamment en quête de nourriture que leurs dépenses énergétiques auraient été les mêmes indépendamment de leur métabolisme de base[58].
Options métaboliques
Les principales possibilités sont les suivantes[33] :
- Les dinosaures étaient poïkilothermes ("à sang froid"), comme les reptiles modernes, mais la grande taille de certains d'entre eux stabilisait leurs températures corporelles.
- Ils étaient homéothermes, ressemblant davantage aux mammifères ou aux oiseaux modernes qu'aux reptiles.
- Ils n'étaient ni l'un ni l'autre, mais avaient des métabolismes différents de ceux des animaux modernes, et peut-être intermédiaires entre ces deux types.
- Leur métabolisme variait suivant les espèces.
Au cours des 150 millions d'années de l'existence des dinosaures, il est très vraisemblable que différents groupes évoluèrent différents métabolismes et régimes thermorégulatoires, et que leur physiologie finit par différer de celle des premiers dinosaures.
Si certains dinosaures avaient des métabolismes intermédiaires, ils auraient pu présenter les caractéristiques suivantes[33] :
- Un faible métabolisme de base, diminuant la quantité de nourriture nécessaire et permettant à une fraction plus importante de celle-ci d'être utilisée pour leur croissance.
- Une utilisation de l'homéothermie inertielle.
- La capacité à contrôler les pertes de chaleur en dilatant ou contractant les vaisseaux sanguins superficiels, comme le font beaucoup de reptiles modernes.
- Une circulation sanguine double, et un cœur à quatre chambres.
- Une grande capacité aérobique, permettant une activité soutenue.
Robert Reid a suggéré que de tels animaux pouvaient être considérés comme des "endothermes ratés". Il pensait que les dinosaures, et aussi les ancêtres triasiques des mammifères, avaient connu une étape présentant ces caractéristiques. Les archosaures venant à dominer les niches écologiques occupées par les grands animaux, les mammifères furent contraints de rapetisser ; leur taille décroissante les rendit vulnérable aux pertes de chaleur (parce qu'elle augmentait leur rapport de leur surface à leur masse), ce qui les obligea à accroitre leur production interne de chaleur, et à devenir des endothermes complets. Au contraire, les dinosaures purent conserver leur métabolisme intermédiaire[33].
Structure osseuse
Armand de Ricqlès découvrit des canaux d'Havers dans les os des dinosaures, et les considéra comme une preuve de leur endothermie. Ces canaux sont fréquents chez les endothermes, et sont associés à une croissance rapide et à un mode de vie actif, car ils permettent de recycler la matière osseuse, ce qui facilite la croissance et la réparation des dommages causés par les efforts ou les blessures[59]. Bakker, quant à lui, considérait que la présence d'os fibrolamellaire (ayant l'aspect d'un tissu fibreux) dans les squelettes de dinosaures était également une preuve d'endothermie[9]. Cependant, des recherches (pour la plupart ultérieures) ont amené la structure osseuse à ne plus être considérée comme un indicateur fiable du métabolisme des dinosaures, des mammifères ou des reptiles :
- Les os des dinosaures contiennent souvent des anneaux de croissance, formés par l'alternance de périodes de croissance rapide ou plus lente ; en fait, de nombreuses études comptent ces anneaux pour estimer l'âge des dinosaures[51],[52]. La formation d'anneaux de croissance est généralement gouvernée par des changements saisonniers de température, et cette influence des saisons a parfois été interprétée comme un signe de métabolisme lent et d'ectothermie. Mais ces anneaux se rencontrent aussi chez les ours polaires et chez les mammifères qui hibernent[60],[61].
- Du tissu osseux fibrolamellaire se rencontre couramment chez de jeunes crocodiliens, et parfois même chez des adultes[62],[63].
- Des canaux d'Havers ont été découverts chez des tortues et des crocodiliens[64], mais sont en revanche souvent absents chez les petits oiseaux, les chauves-souris, les soricidés et les rongeurs[63].
Cependant, de Ricqlès continua à étudier la structure osseuse des dinosaures et des archosaures. En 2008, il fut coauteur d'une publication[65] examinant des spécimens osseux venant d'un vaste ensemble d'archosaures (y compris de dinosaures primitifs), et dont la conclusion était que :
- Même les plus anciens archosauriformes auraient pu être capable d'une croissance très rapide, ce qui suggère un métabolisme élevé. Bien qu'il soit délicat d'obtenir des conclusions concernant les espèces primitives à partir de formes plus évoluées (des variations spécifiques à chaque espèce concernant la structure osseuse et le taux de croissance étant très probables), certaines stratégies de recherche permettent de minimiser ces risques.
- Les archosaures se séparèrent en trois groupes principaux durant le Trias : les ornithodiriens, ancêtres des dinosaures, conservèrent une croissance rapide ; les ancêtres des crocodiliens adoptèrent des rythmes de croissance lents plus typiques des reptiles modernes (et les autres archosaures triasiques avaient des taux de croissance intermédiaires).
Taux de croissance
Les dinosaures, nés de petits œufs, atteignaient des poids de plusieurs tonnes relativement rapidement. Il semble naturel d'en déduire que les dinosaures convertissaient leur nourriture en masse corporelle rapidement, ce qui demande un métabolisme très actif, à la fois pour trouver la nourriture pour l'assimiler[66].
Mais une étude préliminaire[67] de la relation entre taille adulte, taux de croissance et température corporelle aboutit à la conclusion que les grands dinosaures avaient une température plus élevée que les petits : Apatosaurus, le plus grand dinosaure de l'échantillon étudié, fut estimé avoir une température de 41 °C, alors que celle des dinosaures plus petits n'était que de 25 °C (chiffres à comparer avec la température corporelle humaine de 37 °C). D'après ces estimations, l'étude concluait à l'homéothermie inertielle des grands dinosaures (leurs températures étant stabilisées simplement par leurs masses) et qu'en général les dinosaures étaient ectothermiques (autrement dit, "à sang froid")[67]. Ces résultats sont compatibles avec la relation entre la taille des dinosaures et leur vitesse de croissance, décrite plus haut[50],[51].
Proportions isotopiques
La proportion relative des isotopes 16O et 18O dans un os dépend de la température à laquelle l'os s'est formé - plus elle est élevée, plus on trouve de 16O. Barrick et Showers, en 1999, ont analysé ces proportions dans les os de deux théropodes qui vivaient dans des régions tempérées présentant des variations saisonnières de température, Tyrannosaurus (USA) et Giganotosaurus (Argentine)[68] :
- les vertèbres dorsales des deux dinosaures ne montraient aucun signe de variation saisonnière, ce qui montre qu'ils maintenaient tous deux une température centrale constante en dépit de ces variations.
- les côtes et les os des jambes montraient une plus grande variabilité, et une température moyenne plus basse à mesure qu'on s'éloigne des vertèbres.
Barrick et Showers conclurent que ces deux dinosaures étaient endothermiques, mais avec un métabolisme plus bas que celui des mammifères modernes, et que l'homéothermie inertielle jouait un rôle important dans la régulation de leur température à l'âge adulte. Leur analyse analogue, en 1996, de quelques ornithischiens de la fin du Crétacé, montra que ces animaux suivaient la même règle[69].
Cependant, cette analyse a été contestée. Les mesures tendent à montrer l'homéothermie, mais ne sauraient prouver à elles seules l'endothermie. De plus, la production de tissu osseux peut n'avoir pas été continue près des extrémités des membres[70] ; les proportions isotopiques pourraient ne pas constituer une méthode fiable d'estimation des températures s'il n'est pas possible de montrer que la croissance osseuse étaient continue dans toutes les parties de l'animal[33].
Relations prédateur/proie
Bakker, en 1974, développa les arguments suivants[71] :
- les prédateurs à sang froid ont besoin de beaucoup moins de nourriture que les homéothermes, aussi une masse donnée de proies peut nourrir bien plus de prédateurs à sang froid
- le rapport entre la masse totale de prédateurs et celle des proies dans les communautés de dinosaures était beaucoup plus proche de celui des communautés modernes (ou récentes) d'animaux homéothermes que de celui de communautés modernes d'animaux à sang froid.
- ainsi, les dinosaures prédateurs devaient être homéothermes, et comme les dinosaures les plus primitifs (tels que Staurikosaurus ou Herrerasaurus) étaient des prédateurs, il s'ensuit que tous les dinosaures devaient avoir été homéothermes.
Ce raisonnement fut critiqué de plusieurs points de vue, et n'est plus pris au sérieux ; la liste de critiques suivante[72],[73] est loin d'être exhaustive :
- Les estimations des masses des dinosaures sont fluctuantes, et même une petite variation peut amener à une grande erreur dans le calcul du rapport prédateur/proie.
- L'échantillon utilisé par Bakker pourrait ne pas avoir été représentatif. Il obtenait ses chiffres en comptant des spécimens de musée, mais cela crée un biais envers des fossiles rares ou particulièrement bien conservés, ne représentant pas nécessairement l'état des gisements fossiles, lesquels peuvent eux-mêmes ne pas représenter correctement les populations réelles : les animaux plus petits et plus jeunes, ayant des os moins robustes, risquent ainsi d'être moins bien conservés.
- On ne dispose pas de statistiques publiées sur les rapports prédateurs/proies dans le cas de grands prédateurs ectothermiques, car ces prédateurs sont très rares et présents surtout dans de petites îles ; de même, les grands herbivores ectothermiques sont rares. Bakker dut donc comparer les rapports des communautés de mammifères avec ceux de poissons et d'invertébrés, dont l'espérance de vie est bien plus faible, et où d'autres facteurs rendent également la comparaison difficile.
- Cette analyse suppose que les populations de prédateurs ne sont limitées que par la quantité de proies disponibles. Il existe cependant d'autres facteurs, tels que le manque de sites de nidation, le cannibalisme ou la prédation entre prédateurs, qui pourrait maintenir la population en dessous de la limite imposée par la biomasse des proies.
- Des facteurs écologiques peuvent diminuer le rapport prédateur/proie ; par exemple, un prédateur peut ne pas s'intéresser à toutes les espèces de proies présentes, ou encore des maladies, des parasites ou la famine peuvent tuer certaines proies avant qu'un prédateur ait pu les chasser.
- Il est très difficile de déterminer précisément quelles sont les proies et les prédateurs. Par exemple, les jeunes herbivores peuvent être la proie de lézards et de serpents, alors que les adultes ne sont attaqués que par des mammifères. Inversement, les jeunes de nombreux prédateurs se nourrissent d'invertébrés, et passent aux vertébrés en grandissant.
Postures et démarches

Les membres des dinosaures étaient tendus sous leurs corps, plutôt qu'étalés sur le côté comme ceux des lézards et des tritons. Cela résulte de l'étude des surfaces articulaires et de la position des tendons sur les os ; une représentation étalée d'un squelette de dinosaure aboutit à le disloquer[74].
La contrainte de Carrier (en) rend très difficile, pour un vertébré respirant de l'air (avec deux poumons) et se courbant latéralement durant la locomotion, de se déplacer et de respirer simultanément. Cela limite considérablement leur énergie, et les oblige à passer plus de temps immobile qu'en mouvement[75].
Des membres étalés de part et d'autre du corps impliquent une flexion latérale durant la marche (sauf pour les tortues, qui sont très lentes et dont la carapace rend le corps rigide). Mais en dépit de la contrainte de Carrier, cette position des membres est efficace pour des créatures qui passent l'essentiel de leur temps à plat ventre, et ne se déplacent que pendant quelques secondes de suite, car alors cette posture minimise l'énergie nécessaire pour se redresser.
Des membres tendus augmentent le coût énergétique pour passer du repos à la locomotion. Cela indique que les dinosaures étaient des animaux actifs, car la sélection naturelle aurait favorisé le maintien de membres étalés s'ils étaient resté des animaux paresseux, passant la plus grande partie de leur temps à se reposer. Une vie active implique un métabolisme capable de reconstituer rapidement l'énergie et d'éliminer les toxines (qui causent la fatigue), en d'autres termes un métabolisme assez rapide et un degré élevé d'homéothermie.
Bakker et Ostrom firent remarquer que tous les dinosaures avaient des pattes arrières tendues, et que tous les dinosaures quadrupèdes, à l'exception des cératopsiens et des ankylosaures, avaient également les pattes avant tendues ; parmi les animaux actuels, seuls les mammifères et les oiseaux endothermes possèdent cette caractéristique (Ostrom admit que la marche tendue occasionnelle des crocodiliens était une exception partielle à cette règle). Bakker considérait cela comme une preuve concluante de l'endothermie des dinosaures, tandis qu'Ostrom trouvait seulement que c'était un argument convaincant, mais non décisif[9],[76].
Une étude de 2009, basée sur la biomécanique de la course, aboutissait à la conclusion que l'endothermie était largement présente chez les plus grands dinosaures non aviens, et qu'elle était probablement ancestrale pour tous les dinosauriformes[77].
Plumes

Il est désormais indubitable que de nombreux dinosaures théropodes tels que Shuvuuia,Sinosauropteryx et Dilong, un Tyrannosauridae primitif, avaient un revêtement tégumentaire de type "poil", le stade primaire des proto-plumes[78],>[26],[79]. Elles ont été interprétées comme ayant une fonction d'isolation thermique, et donc comme une preuve d'homéothermie.
Mais on n'a trouvé d'empreintes de plumes que chez les Coelurosauria (groupe comprenant certains clades de théropodes dont les oiseaux et les Tyrannosauridae) ; les plumes ne nous donnent donc pour le moment aucune information sur le métabolisme des autres grands groupes de dinosaures, les Coelophysoidea, les Ceratosauria, les Tetanurae, les Sauropoda ou les Ornithischia.
En fait, on a découvert la peau fossilisée d'un Carnotaurus, un Abelisauridae qui n'appartient pas aux groupes des Tetanurae (et donc des Coelurosauria), qui montrait un aspect reptilien, sans plumes et recouverte d'écailles[80]. Mais un Carnotaurus adulte pesait environ une tonne, et les mammifères de cette taille ont des poils très courts ou une peau nue, et il est donc possible que cette peau ne nous apprenne rien sur la présence ou non de plumes chez les théropodes de petite taille n'appartenant pas au clade des Coelurosauria.
Les empreintes de peau de Pelorosaurus et d'autres sauropodes (des dinosaures au corps éléphantesque et ayant un long cou) montrent de grandes écailles hexagonales, et certains sauropodes, tels que Saltasaurus, avaient des plaques osseuses sur la peau[81]. La peau des Ceratopsia était formée de grandes écailles polygonales, parfois parsemée de plaques circulaires[82]. Des restes "momifiés" et des empreintes de peau d'hadrosaures montrent la présence d'écailles rocailleuses. Il semble peu vraisemblable que les Ankylosauridae, tels qu'Euoplocephalus, aient bénéficié d'une isolation thermique, la plus grande partie de leur surface étant recouverte de plaques et de protubérances osseuses[83]. Enfin, on n'a aucune trace d'isolation chez les Stegosauridae.
Dinosaures polaires
Des fossiles de dinosaures ont été trouvés dans des régions qui étaient proches des pôles à leur époque, particulièrement dans le sud-est de l'Australie, en Antarctique, et dans l'Alaska North Slope. L'inclinaison de l'axe terrestre n'a pas beaucoup varié depuis cette époque, et les dinosaures polaires (et les autres écosystèmes) devaient supporter les mêmes variations extrêmes de durée du jour (allant de la nuit complète en hiver au jour permanent en été) que les régions polaires connaissent actuellement[84].
L'étude de la végétation fossile laisse penser que l'Alaska North Slope avait une température maximum de 13 °C et une température minimale allant de 2 °C à 8 °C au cours des derniers 35 millions d'années du Crétacé. Bien que ce climat ne soit pas excessif, l'Alaska North Slope n'a pas de fossiles de grands animaux à sang froid tels que des lézards et des crocodiles (lesquels étaient commun à la même époque un peu plus au sud dans l'Alberta, le Montana et le Wyoming). Cela suggère qu'au moins certains de ces dinosaures non-aviaires étaient homéothermes[84]. Il a été proposé que les dinosaures polaires nord-américains auraient pu migrer à l'approche de l'hiver, ce qui leur aurait permis un habitat polaire, même s'ils étaient à sang froid[85]. Mais une telle migration (de l'Alaska au Montana) aurait probablement consommé plus d'énergie qu'un vertébré à sang froid ne peut en produire en une année ; en d'autres termes, ces dinosaures devaient être homéothermes, qu'ils migrent ou non[86]. Une publication de 2008 sur les migrations de dinosaures, estimait que la majorité des dinosaures polaires, incluant les théropodes, les sauropodes, les ankylosaures, et les hypsilophodontidés, devait hiverner, quoique des hadrosaures tels que Edmontosaurus étaient probablement capables de migrations annuelles de 2600 km aller-retour[87],[88].
Il est plus difficile de déterminer quel était le climat australien quand les dépôts fossiles se sont formés (entre -115 et -105 ma), à la fin du Crétacé inférieur : ces dépôts contiennent des signes de pergélisol, des coins de glace et des sols bosselés dus à des mouvements de la glace souterraine, ce qui suggérerait des températures moyennes annuelles comprises entre -6 °C et 5 °C ; l'analyse des isotopes d'oxygène de ces dépôts donne quant à elle une moyenne annuelle comprise entre 1,5 °C et 2,5 °C. Cependant, la diversité de la végétation fossile et la grande taille de certains des arbres fossilisés dépasse de loin ce que l'on trouve aujourd'hui dans des environnements aussi froids, et nul n'a été capable d'expliquer cette contradiction[84]. Une migration annuelle aurait été très difficile pour des petits dinosaures tels que Leaellynasaura, un végétarien de 60 à 90 cm de long, parce que des bras de mer bloquaient le passage au nord vers des latitudes plus clémentes[84]. Des échantillons osseux de Leaellynasaura et de Timimus, un ornithomimidé de 3,5 m de long et de 1,5 m de haut à la hanche, suggèrent que ces deux espèces avaient différentes façons de survivre aux hivers froids et sombres : les os de Timimus possédaient des lignes d'arrêt de croissance, indiquant une possible hibernation ; ceux de Leaellynasaura n'en présentaient pas, montrant une activité persistante durant l'hiver[89].
Thermorégulation comportementale
Certains dinosaures, par exemple Spinosaurus et Ouranosaurus, avaient sur le dos des « voiles » soutenues par des épines issues des vertèbres (tout comme le synapside Dimetrodon, au demeurant). Ils auraient pu utiliser ces voiles pour :
- capter la chaleur du soleil en les orientant perpendiculairement à lui,
- perdre de la chaleur corporelle en excès en les utilisant comme radiateurs (à l'ombre, ou parallèlement au soleil).
Mais cela ne concerne qu'une très faible minorité des dinosaures connus.
Les plaques dorsales des stégosaures sont souvent vues comme des échangeurs de chaleur servant à la thermorégulation, car elles étaient remplies de vaisseaux sanguins capables en théorie d'émettre et d'absorber de la chaleur[90]. Cela aurait pu fonctionner pour un stégosaure à larges plaques, tel que Stegosaurus, mais pour des espèces à plaques plus petites, telles que Wuerhosaurus, Tuojiangosaurus et Kentrosaurus, ce mécanisme paraît inefficace ; de plus, l'idée même a été récemment remise en question ; ces plaques n'auraient eu qu'une fonction décorative[91].
Le métabolisme des archosaures primitifs et l'énigme des crocodiliens
Il semble que les premiers dinosaures possédaient déjà les caractéristiques qui ont amené à les croire homéothermes, tout particulièrement des membres tendus. D'où la question "comment les dinosaures sont-ils devenus homéothermes ?" Les deux possibilités les plus évidentes sont :
- "Leurs ancêtres immédiats (les archosaures) étaient à sang froid, et les dinosaures devinrent homéothermes dès le début de leur évolution." Cela impliquerait un développement très rapide de l'homéothermie, en moins de 20 millions d'années. Mais chez les ancêtres des mammifères, le développement de l'homéothermie semble avoir été beaucoup plus lent, commençant avec l'apparition d'un palais secondaire au début du Permien moyen[92] et se prolongeant jusqu'à l'apparition des poils au milieu du Jurassique[93]).
- "Les archosaures étaient déjà (partiellement) homéothermes, et les dinosaures continuèrent leur évolution dans cette direction." Cette réponse soulève deux problèmes : A) l'évolution initiale des archosaures est encore très mal comprise - on a retrouvé un grand nombre d'individus et d'espèces du début du Trias, mais on ne connait que deux espèces au Permien supérieur (Archosaurus (en) rossicus et Protorosaurus speneri) ; B) les crocodiliens évoluèrent un peu avant les dinosaures et leur sont étroitement apparentés, mais les crocodiliens modernes sont à sang froid.
Cette seconde difficulté (si l'on pense que les dinosaures étaient homéothermes) constitue l’énigme des crocodiliens ; de plus, les crocodiliens modernes, bien que poïkilothermes, présentent plusieurs caractéristiques associées aux homéothermes. Comment les ont-ils acquises ?
Outre leur posture (ils peuvent parfois marcher avec les pattes tendues), les crocodiliens modernes possèdent les caractéristiques suivantes, souvent associées à l'homéothermie parce qu'elles améliorent les réserves d'oygène de l'animal[94] :
- des cœurs à quatre chambres. Les mammifères et les oiseaux ont des cœurs à quatre chambres ; les reptiles non crocodiliens ont des cœurs à trois chambres qui sont moins efficaces, car ils laissent le sang non-oxygéné se mélanger au sang oxygéné et être renvoyé en partie vers le corps et non vers les poumons. Les cœurs des crocodiliens modernes ont quatre chambres, mais ils sont plus petits et fonctionnent à une pression plus faible que ceux des mammifères et des oiseaux (ils possèdent aussi une dérivation qui les transforme en cœurs à trois chambres lorsqu'ils sont sous l'eau, pour conserver l'oxygène)[95].
- un diaphragme, qui aide à la respiration.
- un palais secondaire, qui permet à l'animal de manger et de respirer en même temps.
- un mécanisme de piston hépatique (en), servant à pomper les poumons. Ce dispositif est différent de celui des mammifères et des oiseaux, mais serait semblable à celui que certains chercheurs affirment avoir trouvé chez des dinosaures[19],[21].
Pourquoi la sélection naturelle a-t-elle favorisé le développement de ces traits, très importants pour des créatures actives à sang chaud, mais de peu d'utilité apparente pour ces prédateurs en embuscade passant la plus grande partie de leur temps allongés dans l'eau ?
Vers la fin des années 1980, il fut suggéré que les crocodiliens étaient initialement des prédateurs actifs à sang chaud, comme leurs ancêtres archosaures[75],[94]. Plus récemment, des études ont montré que les embryons des crocodiliens développent d'abord des cœurs complets à quatre chambres, puis les modifications leur permettant de fonctionner comme des cœurs à trois chambres sous l'eau. Utilisant la théorie de la récapitulation, les chercheurs conclurent que les crocodiliens primitifs devaient avoir eu des cœurs à quatre chambres et être homéothermes, n'ayant développé leurs caractéristiques actuelles qu'en devenant des prédateurs passifs[96],[97].
Des recherches plus récentes sur la structure des os des archosaures et ce qu'elle implique pour leur rythme de croissance suggèrent également que le métabolisme des premiers archosaures était assez élevé, et que les ancêtres triasiques des crocodiliens revinrent à un métabolisme plus typiquement reptilien[65].
Si ce point de vue est correct, le développement de l'homéothermie chez les archosaures (atteignant son pic avec les dinosaures) et chez les mammifères aurait pris un temps comparable ; ce point de vue est également cohérent avec les données fossiles suivantes :
- Les plus anciens crocodiliens, tels que Terrestrisuchus (en), étaient des prédateurs terrestres minces et à longues pattes.
- Les membres tendus apparaissent très tôt dans l'évolution des archosaures, et ceux des rauisuchiens sont très mal adaptés à toute autre posture[98].
Annexes
Articles connexes
- Dinosauria (classification phylogénétique)
- Renaissance des dinosaures
- Histoire évolutive des dinosaures
- Histoire évolutive des oiseaux
- Liste de dinosaures
Liens externes
Notes et références
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Physiology of dinosaurs » (voir la liste des auteurs).
- 1 2 Lucas, Spencer G. (2000). Dinosaurs: The Textbook, 3rd, McGraw-Hill Companies, Inc., 3-9.
- ↑ (en) Fastovsky DE, Weishampel DB, The Evolution and Extinction of the Dinosaurs (2nd Edition), Cambridge University Press, , 265–299 p. (ISBN 0-521-81172-4), « Theropoda I:Nature red in tooth and claw »
- ↑ (en) Edwin H. Colbert, Raymond B. Cowles et Charles M. Bogert, « Temperature Tolerances in the American Alligator and Their Bearing on the Habits, Evolution, and Extinction of the Dinosaurs », The Quarterly Review of Biology, vol. 22, no 2, , p. 145–146 (DOI 10.1086/395712)
- 1 2 (en) Spencer G. Lucas, Dinosaurs: The Textbook, Boston, McGraw-Hill Companies, Inc., , 3e éd. (ISBN 978-0-07-303642-7, LCCN 99018617), p. 1–3
- ↑ (en) Hugh Torrens, The Complete Dinosaur, Bloomington, Indiana University Press, , 175–190 p. (ISBN 0-253-33349-0), « Politics and Paleontology »
- ↑ (en) Michael J. Benton, The Scientific American Book of Dinosaurs, New York, St. Martin's Press, , 10–44 p. (ISBN 0-312-26226-4), « A brief history of dinosaur paleontology »
- ↑ Bakker, R.T. (1968). "The superiority of dinosaurs" Discovery, v. 3(2), p. 11-22
- ↑ Bakker, R.T. (1986). "The Return of the Dancing Dinosaurs" dans Dinosaurs Past and Present, vol. I édité par S. J. Czerkas et E. C. Olson, Natural History Museum de Los Angeles
- 1 2 3 4 Bakker, R.T. (1972). "Anatomical and ecological evidence of endothermy in dinosaurs". Nature 238:81-85.
- ↑ R.D.K. Thomas and E.C. Olson (Ed.s) (1980). A Cold Look at the Warm-Blooded Dinosaurs
- ↑ Benton, M.J. (2005). Vertebrate Palaeontology. Oxford, 221-223.
- ↑ Paladino, F.V., O'Connor, M.P., et Spotila, J.R. (1990). "Metabolism of leatherback turtles, gigantothermy, and thermoregulation of dinosaurs". Nature 344, 858-860 doi:10.1038/344858a0
- ↑ Barrick, R.E., Showers, W.J., Fischer, A.G. (1996). "Comparison of Thermoregulation of Four Ornithischian Dinosaurs and a Varanid Lizard from the Cretaceous Two Medicine Formation: Evidence from Oxygen Isotopes" Palaios, 11:4 295-305 doi:10.2307/3515240
- 1 2 3 4 5 Norman, D.B., Encyclopedia of Life Sciences, John Wiley & Sons, (DOI 10.1038/npg.els.0003321, lire en ligne), « Dinosaur Feeding »
- ↑ (en) O. Wings, « A review of gastrolith function with implications for fossil vertebrates and a revised classification », Acta Palaeontologica Polonica, vol. 52, no 1, , p. 1–16 (lire en ligne [PDF])
- ↑ (en) O. Wings et P.M. Sander, « No gastric mill in sauropod dinosaurs: new evidence from analysis of gastrolith mass and function in ostriches », Proceedings of the Royal Society: Biologocal Sciences, vol. 274, no 1610, , p. 635–640 (PMID PMC2197205, DOI 10.1098/rspb.2006.3763, lire en ligne)
- 1 2 3 4 (en) Andrew H. Lee, « Sexual maturity in growing dinosaurs does not fit reptilian growth models », Proceedings of the National Academy of Sciences, vol. 105, no 2, , p. 582–587 (PMID 18195356, PMCID 2206579, DOI 10.1073/pnas.0708903105, lire en ligne [abstract page])
- ↑ (en) M.H. Schweitzer, « Gender-specific reproductive tissue in ratites and Tyrannosaurus rex », Science, vol. 308, no 5727, , p. 1456–1460 (PMID 15933198, DOI 10.1126/science.1112158, lire en ligne [abstract page])
- 1 2 3 (en) J.A. Ruben, Jones, N.R. Geist et W. J. Hillenius, « Lung structure and ventilation in theropod dinosaurs and early birds », Science, vol. 278, no 5341, , p. 1267–1270 (DOI 10.1126/science.278.5341.1267, lire en ligne [abstract page])
- 1 2 (en) J.A. Ruben, T.D. Jones, N.R. Geist, A. Leitch et W.J. Hillenius, « Lung ventilation and gas exchange in theropod dinosaurs », Science, vol. 278, no 5341, , p. 1267–1270 (DOI 10.1126/science.278.5341.1267, lire en ligne)
- 1 2 3 (en) J.A. Ruben, C. Dal Sasso, N.R. Geist, W. J. Hillenius, T.D. Jones et M. Signore, « Pulmonary function and metabolic physiology of theropod dinosaurs », Science, vol. 283, no 5401, , p. 514–516 (PMID 9915693, DOI 10.1126/science.283.5401.514, lire en ligne [abstract page])
- ↑ (en) J. A. Ruben, T. D. Jones et N. R. Geist, « Respiration and reproductive paleophysiology of dinosaurs and early birds », Physiol. Biochem. Zool., vol. 72, no 2, , p. 141−164 (PMID 12794669, DOI 10.1086/375425)
- ↑ (en) W. J. Hillenius et J.A. Ruben, « The Evolution of Endothermy in Terrestrial Vertebrates: Who? When? Why? », Physiological and Biochemical Zoology, vol. 77, no 6, november/december 2004, p. 1019–1042 (PMID 15674773, DOI 10.1086/425185, lire en ligne [abstract page])
- ↑ (en) J.W. Hicks et C.G. Farmer, « Lung Ventilation and Gas Exchange in Theropod Dinosaurs », Science, vol. 278, no 5341, , p. 1267–1270 (DOI 10.1126/science.278.5341.1267, lire en ligne)
- ↑ (en) J.W. Hicks et C.G. Farmer, « Gas exchange potential in reptilian lungs: implications for the dinosaur–avian connection », Respiration Physiology, vol. 117, no 2-3, , p. 73–83 (PMID 10563436, DOI 10.1016/S0034-5687(99)00060-2, lire en ligne)
- 1 2 (en) P.J. Currie et Chen, « Anatomy of Sinosauropteryx prima from Liaoning, northeastern China », Canadian Journal of Earth Sciences, vol. 38, no 12, , p. 1705–1727 (DOI 10.1139/cjes-38-12-1705, lire en ligne)
- 1 2 (en) P. O'Connor et L. Claessens, « Basic avian pulmonary design and flow-through ventilation in non-avian theropod dinosaurs », Nature, vol. 436, no 7048, , p. 253–256 (PMID 16015329, DOI 10.1038/nature03716, lire en ligne)
- ↑ (en) M.J. Wedel, « Vertebral pneumaticity, air sacs, and the physiology of sauropod dinosaurs », Paleobiology, vol. 29, no 2, , p. 243–255 (DOI <0243:VPASAT>2.0.CO;2 10.1666/0094-8373(2003)029<0243:VPASAT>2.0.CO;2, lire en ligne [abstract page]) Le texte complet est en ligne à (en) « Findarticles.com: Vertebral pneumaticity, air sacs, and the physiology of sauropod dinosaurs », Paleobiology, (lire en ligne) et (en) « Vertebral pneumaticity, air sacs, and the physiology of sauropod dinosaurs » [PDF] Des analyses anatomiques détaillées peuvent se trouver à (en) M.J. Wedel, « The Evolution of Vertebral Pneumaticity in Sauropod Dinosaurs », Journal of Vertebrate Paleontology, vol. 23, no 2, , p. 344–357 (DOI [0344:TEOVPI2.0.CO;2 10.1671/0272-4634(2003)023[0344:TEOVPI]2.0.CO;2])
- 1 2 (en) M.J. Wedel, « Origin of postcranial skeletal pneumaticity in dinosaurs », Integrative Zoology, vol. 1, no 2, , p. 80–85 (DOI 10.1111/j.1749-4877.2006.00019.x, lire en ligne [abstract page])
- ↑ (en) D. Naish, D. M. Martill et E. Frey, « Ecology, systematics and biogeographical relationships of dinosaurs, including a new theropod, from the Santana Formation (?Albian, Early Cretaceous) of Brazil », Historical Biology, vol. 16, no 2-4, , p. 57–70 (DOI 10.1080/08912960410001674200, lire en ligne) Ceci est également l'un des sujets discutés sur le blog de Naish, (en) « Basal tyrant dinosaurs and my pet Mirischia » - il faut noter que Mirischia était un cœlurosaure que Naish pensait être un proche cousin de Compsognathus.
- 1 2 (en) PC Sereno, RN Martinez, JA Wilson, DJ Varricchio, OA Alcober et al., « Evidence for Avian Intrathoracic Air Sacs in a New Predatory Dinosaur from Argentina », PLoS ONE, vol. 3, no 9, , e3303doi=10.1371/journal.pone.0003303 (PMID 18825273, PMCID 2553519, DOI 10.1371/journal.pone.0003303, lire en ligne)
- ↑ (en) Mathew Wedel, « What pneumaticity tells us about 'prosauropods', and vice versa », Special Papers in Palaeontology, vol. 77, , p. 207–222 (lire en ligne [PDF])
- 1 2 3 4 5 6 7 8 9 10 Reid, R.E.H., The Complete Dinosaur, Bloomington, Indiana University Press, , 449–473 p. (ISBN 0-253-33349-0, lire en ligne)
- ↑ Paladino, F.V., Spotila, J.R., and Dodson, P., The Complete Dinosaur, Bloomington, Ind., Indiana University Press, , 491–504 p. (ISBN 0253213134)
- ↑ (en) J.R. Codd, P.L. Manning, M.A. Norell et S.F. Perry, « Avian-like breathing mechanics in maniraptoran dinosaurs », Proceedings of the Royal Society B, vol. 275, no 1631, , p. 157–161 (PMID 17986432, PMCID 2596187, DOI 10.1098/rspb.2007.1233, lire en ligne) News summary at (en) « Why Dinosaurs Had 'Fowl' Breath »,
- ↑ (en) P.G. Tickle, A.R. Ennos, L.E. Lennox, S.F. Perry et J.R. Codd, « Functional significance of the uncinate processes in birds », Journal of Experimental Biology, vol. 210, no 210, , p. 3955–3961 (PMID 17981863, DOI 10.1242/jeb.008953, lire en ligne)
- ↑ (en) P.E. Fisher, D.A. Russell, M.K. Stoskopf, R.E. Barrick, M. Hammer et A.A. Kuzmitz, « Cardiovascular Evidence for an Intermediate or Higher Metabolic Rate in an Ornithischian Dinosaur », Science, vol. 288, no 5465, , p. 503–505 (PMID Mais il faut remarquer que cet article prétend principalement que ce fossile montre clairement un cœur à 4 chambres, un résultat qui est loin de faire l'unanimité. 10775107 Mais il faut remarquer que cet article prétend principalement que ce fossile montre clairement un cœur à 4 chambres, un résultat qui est loin de faire l'unanimité., DOI 10.1126/science.288.5465.503, lire en ligne)
- ↑ (en) J.A. Ruben, W.J. Hillenius, N.R. Geist, A. Leitch, T.D. Jones, P.J. Currie, J.R. Horner et G. Espe, « The metabolic status of some Late Cretaceous dinosaurs », Science, vol. 273, no 5279, , p. 1204–1207 (DOI 10.1126/science.273.5279.1204, lire en ligne [abstract page])
- ↑ (en) J.A. Ruben et T.D. Jones, « Selective Factors Associated with the Origin of Fur and Feathers », Am. Zool., vol. 40, no 4, , p. 585–596 (DOI 10.1093/icb/40.4.585, lire en ligne)
- ↑ (en) B.G. Bang, « The olfactory apparatus of Procellariiformes », Acta Anatomica, vol. 65, no 1, , p. 391–415 (PMID 5965973, DOI 10.1159/000142884)
- ↑ (en) B.G. Bang, « Functional anatomy of the olfactory system in 23 orders of birds », Acta Anatomica, vol. 79 (supplement 58), , p. 1–76
- ↑ (en) J.H. Scott, « Heat regulating function of the nasal mucous membrane », Journal of Larynology and Otology, vol. 68, , p. 308–317
- ↑ (en) « Respiratory water exchange in two species of porpoise », Science, vol. 149, no 3679, , p. 86–88 (PMID 17737801, DOI 10.1126/science.149.3679.86)
- ↑ (en) L.M. Witmer, « Nostril Position in Dinosaurs and Other Vertebrates and Its Significance for Nasal Function », Science, vol. 293, no 5531, , p. 850–853 (PMID 11486085, DOI 10.1126/science.1062681, lire en ligne [abstract page])
- ↑ (en) Paul E. Fisher, « Cardiovascular evidence for an intermediate or higher metabolic rate in an ornithischian dinosaur », Science, vol. 288, no 5465, , p. 503–505 (PMID 10775107, DOI 10.1126/science.288.5465.503, lire en ligne)
- ↑ (en) Timothy Rowe, « Technical comment: dinosaur with a heart of stone », Science, vol. 291, no 5505, , p. 783a (PMID 11157158, DOI 10.1126/science.291.5505.783a, lire en ligne)
- ↑ (en) Dale A. Russell, « Reply: dinosaur with a heart of stone », Science, vol. 291, no 5505, , p. 783a (PMID 11157158, DOI 10.1126/science.291.5505.783a, lire en ligne)
- ↑ Chinsamy, Anusuya; and Hillenius, Willem J. (2004). "Physiology of nonavian dinosaurs". The Dinosauria, 2nd. 643–659.
- ↑ K. Carpenter, K.F. Hirsch et J.R. Horner, Dinosaur Eggs and Babies, Cambridge University Press, (ISBN 0521567238, lire en ligne)
- 1 2 (en) G.M. Erickson, K. Curry Rogers et S.A. Yerby, « Dinosaurian growth patterns and rapid avian growth rates », Nature, vol. 412, no 6845, , p. 429–433 (PMID 11473315, DOI 10.1038/35086558, lire en ligne) Note Kristina Rogers also published papers under her maiden name, Kristina Curry.
- 1 2 3 (en) K.A. Curry, « Ontogenetic Histology of Apatosaurus (Dinosauria: Sauropoda): New Insights on Growth Rates and Longevity », Journal of Vertebrate Paleontology, vol. 19, no 4, , p. 654–665 (DOI 10.1080/02724634.1999.10011179, lire en ligne)
- 1 2 3 (en) G.M. Erickson, P.J. Makovicky, P.J. Currie, M.A. Norell, S.A. Yerby et C.A. Brochu, « Gigantism and comparative life-history parameters of tyrannosaurid dinosaurs », Nature, vol. 430, no 7001, , p. 772–775 (PMID 15306807, DOI 10.1038/nature02699, lire en ligne [abstract page])
- ↑ (en) J. R. Horner et K. Padian, « Age and growth dynamics of Tyrannosaurus rex », Proceedings of the Royal Society of London B, vol. 271, no 1551, , p. 1875–1880 (PMID 15347508, PMCID 1691809, DOI 10.1098/rspb.2004.2829, lire en ligne)
- ↑ (en) L.N. Cooper, A.H. Lee, M.L. Taper et J.R. Horner, « Relative growth rates of predator and prey dinosaurs reflect effects of predation », Proceedings of the Royal Society: Biology, vol. 1, no 1651, , -1 (PMID 18682367, PMCID 2605812, DOI 10.1098/rspb.2008.0912, lire en ligne)
- ↑ (en) G.M. Erickson, P.J. Currie, B.D. Inouye et A.A. Winn, « Tyrannosaur Life Tables: An Example of Nonavian Dinosaur Population Biology », Science, vol. 313, no 5784, , p. 213–217 (PMID 16840697, DOI 10.1126/science.1125721, lire en ligne)
- ↑ (en) McGowan, C., Dinosaurs, Spitfires and Sea Dragons, Cambridge, Harvard University Press, (ISBN 978-0-674-20769-1), p. 133–135
- ↑ (en) R.I. Mackie, « Mutualistic Fermentative Digestion in the Gastrointestinal Tract: Diversity and Evolution », Integr. Comp. Biol., vol. 42, no 2, , p. 319–326 (DOI 10.1093/icb/42.2.319, lire en ligne)
- ↑ Paul, G.S., Morrison Symposium Proceedings: A Special Issue Of The Journal Modern Geology, Taylor & Francis, (ISBN 9056991833, lire en ligne), « Cope's rule », p. 211
- ↑ Ricqles, A. J. de. (1974). Evolution of endothermy: histological evidence. Evolutionary Theory 1: 51-80
- ↑ (en) A. Chinsamy, T. Rich et P. Vickers-Rich, « Polar dinosaur bone histology », Journal of Vertebrate Paleontology, vol. 18, no 2, , p. 385–390 (DOI 10.1080/02724634.1998.10011066, lire en ligne)
- ↑ (en) Klevezal, G.A., Mina, M.V., and Oreshkin, A.V., Recording structures of mammals. Determination of age and reconstruction of life history, Rotterdam, CRC Press, (ISBN 978-90-5410-621-0)
- ↑ (en) Enlow, D.H., Principles of Bone Remodeling. An account of post-natal growth and remodeling processes in long bones and the mandible, Springfield, IL, C.C. Thomas,
- 1 2 (en) R.E.H. Reid, « Primary bone and dinosaurian physiology », Geological Magazine, vol. 121, , p. 589–598 (DOI 10.1017/S0016756800030739)
- ↑ (en) R.E.H Reid, The Complete Dinosaur, Bloomington, Indiana University Press, , 403–413 p. (ISBN 0-253-33349-0), « How dinosaurs grew »
- 1 2 (en) A. de Ricqlès, K. Padian, F. Knoll et J.R. Horner, « On the origin of high growth rates in archosaurs and their ancient relatives: Complementary histological studies on Triassic archosauriforms and the problem of a "phylogenetic signal" in bone histology », Annales de Paléontologie, vol. 94, no 2, april-june 2008, p. 57 (DOI 10.1016/j.annpal.2008.03.002, lire en ligne) Un résumé figure en ligne à (en) « The Origin of High Growth Rates in Archosaurs » (consulté le 3 juin 2008)
- ↑ (en) G.S. Paul, Predatory Dinosaurs of the World, New York, Simon and Schuster, (ISBN 978-0-671-61946-6, LCCN 88023052), p. 155
- 1 2 (en) J.F. Gillooly, A.P. Allen et E.L. Charnov, « Dinosaur Fossils Predict Body Temperatures », PLoS Biolology, vol. 4, no 8, , e248 (PMID 16817695, PMCID 1489189, DOI 10.1371/journal.pbio.0040248, lire en ligne). On trouvera un résumé moins technique de cette étude à (en) L. Gross, « Math and Fossils Resolve a Debate on Dinosaur Metabolism », PLoS Biolology, vol. 4, no 8, , e255 (PMID 20076616, PMCID 1489188, DOI 10.1371/journal.pbio.0040255, lire en ligne)
- ↑ (en) R.E. Barrick et W.J. Showers, « Thermophysiology and biology of Giganotosaurus: comparison with Tyrannosaurus », Palaeontologia Electronica, vol. 2, no 2, 1999 (lire en ligne)
- ↑ (en) R.E Barrick, W.J. Showers et A.G. Fischer, « Comparison of Thermoregulation of Four Ornithischian Dinosaurs and a Varanid Lizard from the Cretaceous Two Medicine Formation: Evidence from Oxygen Isotopes », PALAIOS, SEPM Society for Sedimentary Geology, vol. 11, no 4, , p. 295–305 (DOI 10.2307/3515240, JSTOR 10.2307/3515240, lire en ligne)
- ↑ Les lignes d'arrêt de croissance des squelettes d'allosaures sont rares ou absentes dans les grands os des membres, mais fréquentes dans les doigts et les orteils. Bien qu'il ne soit pas absolument prouvé que ces lignes soient corrélées à la température, elles pourraient indiquer des temps où les extrémités des membres étaient si froides qu'elles cessaient de grandir. Dans ce cas, les données isotopiques seraient incomplètes, particulièrement pour ces périodes de froid périphérique
- ↑ (en) R.T. Bakker, « Dinosaur Bioenergetics - A Reply to Bennett and Dalzell, and Feduccia », Evolution, Society for the Study of Evolution, vol. 28, no 3, , p. 497–503 (DOI 10.2307/2407178, JSTOR 10.2307/2407178, lire en ligne)
- ↑ (en) Fastovsky, D.E., Weishampel, D.B., and Sibbick, J., The Evolution and Extinction of the Dinosaurs, Cambridge, Cambridge University Press, (ISBN 978-0-521-81172-9, LCCN 2004049261, lire en ligne)
- ↑ Farlow, J.O., A cold look at the warm-blooded dinosaurs, Boulder, CO, American Association for the Advancement of Science, , PDF, 55–83 p. (lire en ligne), « Predator/prey biomass ratios, community food webs and dinosaur physiology »
- ↑ Cela fut reconnu dès 1909 : (en) « Dr. Holland and the Sprawling Sauropods » (Archive • Wikiwix • Archive.is • Google • Que faire ?) Ces arguments et beaucoup des dessins montrés ici figurent aussi dans (en) Desmond, A., Hot Blooded Dinosaurs, DoubleDay, (ISBN 978-0-385-27063-2)
- 1 2 (en) D.R. Carrier, « The evolution of locomotor stamina in tetrapods: circumventing a mechanical constraint », Paleobiology, vol. 13, , p. 326–341
- ↑ Ostrom, J.H., A cold look at the warm-blooded dinosaurs, Boulder, CO, American Association for the Advancement of Science, , PDF, 82–105 p. (lire en ligne), « The evidence of endothermy in dinosaurs »
- ↑ DOI:10.1371/journal.pone.0007783
Cette citation sera générée dans quelques minutes. Vous pouvez sauter la queue ou la compléter à la main - ↑ (en) M.H. Schweitzer, J.A. Watt, R. Avci, L. Knapp, L. Chiappe, M. Norell et M. Marshall., « Beta-keratin specific immunological reactivity in feather-like structures of the Cretaceous alvarezsaurid, Shuvuuia deserti », Journal of Experimental Zoology (Mol Dev Evol), vol. 285, no 2, , p. 146–157 (lire en ligne [abstract page])
- ↑ (en) X. Xu, M.A. Norell, X. Kuang, X. Wang et Zhao, « Basal tyrannosauroids from China and evidence for protofeathers in tyrannosauroids », Nature, vol. 431, no 7009, , p. 680–684 (PMID 15470426, DOI 10.1038/nature02855, lire en ligne [abstract page])
- ↑ (en) J.F. Bonaparte, E.E. Novas et R.A. Coria, « Carnotaurus sastrei Bonaparte, the horned, lightly built carnosaur from the Middle Cretaceous of Patagonia », Natural History Museum of Los Angeles County Contributions in Science, vol. 416, , p. 1–42 (lire en ligne)
- ↑ S. A. Czerkas, « Aspects of Sauropod Paleobiology », Gaia, Lisbon, Portugal, vol. 10,
- ↑ (en) Dodson, P., and Barlowe, W.D., The Horned Dinosaurs: A Natural History, New Jersey, Princeton University Press, (ISBN 978-0-691-05900-6, OCLC 60183976, lire en ligne) See also image at (en) « Ceratopsian skin »
- ↑ (en) Gosline, A., « Dinosaurs' "bulletproof" armour revealed », NewScientist.com news service,
- 1 2 3 4 (en) T.H. Rich, P. Vickers-Rich et R.A. Gangloff, « Polar Dinosaurs », Science, vol. 295, no 5557, , p. 979–980 (PMID 11834803, DOI 10.1126/science.1068920, lire en ligne) Voir aussi (en) Vickers-Rich, P., and Rich, T.H., « Dinosaurs of the Antarctic » [PDF], Scientific American, et (en) Fiorillo, A.R., « Dinosaurs of Arctic Alaska » [PDF], Scientific American,
- ↑ Hotton, N., A cold look at the warm-blooded dinosaurs, Boulder, CO, American Association for the Advancement of Science, , 311–350 p., « An alternative to dinosaur endothermy: The happy wanderers »
- ↑ (en) G.S. Paul, Predatory Dinosaurs of the World, New York, Simon and Schuster, (ISBN 978-0-671-61946-6, LCCN 88023052), p. 160–161
- ↑ (en) Phil R. Bell, « Polar dinosaurs on parade: a review of dinosaur migration », Alcheringa, vol. 32, no 3, , p. 271–284 (DOI 10.1080/03115510802096101)
- ↑ (en) Robin Lloyd, « Polar Dinosaurs Endured Cold Dark Winters », LiveScience.com, Imaginova, (consulté le 11 décembre 2008)
- ↑ (en) A. Chinsamy, T.H. Rich et P. Vickers-Rich, « Polar dinosaur bone histology », Journal of Vertebrate Paleontology, vol. 18, no 2 pages=385–390, Voir aussi (en) Leslie, M., « Taking a Dinosaur's Temperature », Smithsonian magazine,
- ↑ (en) V. de Bufrenil, J.O. Farlow et A. de Riqles, « Growth and function of Stegosaurus plates: evidence from bone histology », Paleobiology, Paleontological Society, vol. 12, no 4, , p. 459–473 (lire en ligne)
- ↑ (en) « Stegosaur plates and spikes for looks only »,
- ↑ (en) Kermack, D.M. and Kermack, K.A., The evolution of mammalian characters, London, Croom Helm Kapitan Szabo Publishers, (ISBN 978-0-7099-1534-8, LCCN 84005783), p. 149
- ↑ La trace la plus ancienne de poils ou de fourrure a été trouvée chez Castorocauda, il y a 164 millions d'années, (en) Q. Ji, « A Swimming Mammaliaform from the Middle Jurassic and Ecomorphological Diversification of Early Mammals », Science, vol. 311, no 5764, , p. 1123 (PMID 16497926, DOI 10.1126/science.1123026, lire en ligne [abstract page]) Voir aussi (en) « Jurassic "Beaver" Found; Rewrites History of Mammals » Dès les années 1950, il a été dit qu'il pourrait y avoir des traces de poils chez les cynodontes du Trias inférieur tels que Thrinaxodon : (en) A.S. Brink, « A study on the skeleton of Diademodon », Palaeontologia Africana, vol. 3, , p. 3–39 et (en) T.S. Kemp, Mammal-like reptiles and the origin of mammals, London, Academic Press, , p. 363, mais les petits canaux (foramina) trouvés dans les os du museau des cynodontes ne constituent pas une preuve convaincante de cela, puisque l'on trouve des foramina semblables chez plusieurs reptiles actuels : (en) R. Estes, « Cranial anatomy of the cynodont reptile Thrinaxodon liorhinus », Bulletin of the Museum of Comparative Zoology, no 1253, , p. 165–180 et (en) Ruben, J.A., and Jones, T.D., « Selective Factors Associated with the Origin of Fur and Feathers », Am. Zool., vol. 40, no 4, , p. 585–596 (DOI 10.1093/icb/40.4.585, lire en ligne)
- 1 2 (en) McGowan, C., Dinosaurs, Spitfires and Sea Dragons, Cambridge, Harvard University Press, (ISBN 978-0-674-20769-1), p. 151–152
- ↑ (en) « Secret of the crocodile heart »
- ↑ Summers, A.P. (2005). Evolution: Warm-hearted crocs. Nature 434: 833-834
- ↑ (en) R. S. Seymour, C. L. Bennett-Stamper, S. D. Johnston, D. R. Carrier et G. C. Grigg, « Evidence for endothermic ancestors of crocodiles at the stem of archosaur evolution », Physiological and Biochemical Zoology, vol. 77, no 6, , p. 1051–1067 (PMID 15674775, DOI 10.1086/422766, lire en ligne [abstract page]) Voir aussi une explication illustrée à (en) Myers, P.Z., « Hot-blooded crocodiles? »,
- ↑ (en) J.R. Hutchinson, « The evolution of locomotion in archosaurs », Comptes Rendus Palevol, vol. 5, no 3-4, march-april 2006, p. 519–530 (DOI 10.1016/j.crpv.2005.09.002, lire en ligne)
- Portail de la paléontologie
- Portail de l’évolution
- Portail des dinosaures
- Portail de la zoologie