
??tain (II) chlorure
Contexte des ??coles Wikip??dia
Enfants SOS b??n??voles ont aid?? ?? choisir des articles et faites autre mat??riel de curriculum Voir http://www.soschildren.org/sponsor-a-child pour conna??tre le parrainage d'enfants.
| ??tain (II) chlorure | |
|---|---|
 | |
??tain (II) chlorure | |
Autres noms Chlorure d'??tain | |
| Identificateurs | |
| Num??ro RTECS | XP8700000 (anhydre) XP8850000 (dihydrate) |
| Propri??t??s | |
| Formule mol??culaire | SnCl 2 |
| Masse molaire | 189,60 g / mol (anhydre) 225,63 (dihydrate) |
| Apparence | Solide cristallin blanc |
| Densit?? | 3,95 g / cm??, solide anhydre 2,71 g / cm??, dihydrate (15 ?? C) |
| Point de fusion | 246 ?? C (519 K) |
| Point d'??bullition | 623 ?? C (896 K) |
| Solubilit?? dans l'eau | 83,9 g / 100 ml (0 ?? C) Hydrolyse dans l'eau chaude |
| Structure | |
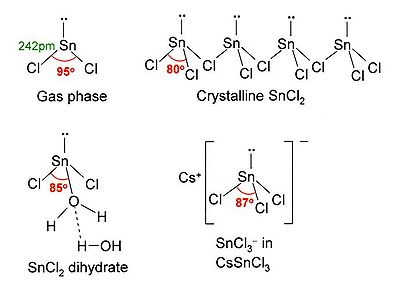
| Crystal structure | Structure de la couche (cha??nes de SnCl 3 groupes) |
| Coordination g??om??trie | Trigonale pyramidale (anhydre) Dihydrate ??galement trois coordonn??es |
| Forme mol??culaire | Bent (phase gazeuse) |
| Risques | |
| FS | MSDS externe |
| Phrases-R | 22-34-37 |
| Phrases S | 26-36 / 37 / 39-45 |
| Principal dangers | Corrosif |
| Des compos??s apparent??s | |
| D'autres anions | ??tain (II) fluorure Bromure d'??tain (II) |
| D'autres cations | Tin (IV) chloride Germanium dichlorure Plomb (II) chlorure |
| Page de donn??es suppl??mentaire | |
| Structure et propri??t??s | n, ε r, etc. |
| Thermodynamique donn??es | comportement de phase Solide, liquide, gaz |
| Les donn??es spectrales | UV, IR, RMN , MS |
| Sauf indication contraire, les donn??es sont donn??es pour le mat??riel dans leur ??tat standard (?? 25 ?? C, 100 kPa) | |
| R??f??rences d'Infobox | |
Tin chlorure (II) (chlorure stanneux) est un blanc cristallin solide ?? la formule Sn Cl 2. Il forme un dihydrate stable, mais les solutions aqueuses ont tendance ?? subir hydrolyse, en particulier si chaud. SnCl 2 est largement utilis?? comme un agent r??ducteur (en solution acide), et d'??lectrolyse de bains ??tamage. Tin (II) ne doit pas ??tre confondu avec l'autre chlorure d'??tain; ??tain (IV) de chlorure stannique ou le chlorure (SnCl 4).
Structure chimique
SnCl 2 a un seule paire d' ??lectrons , de telle sorte que la mol??cule dans la phase gazeuse est pli??. ?? l'??tat solide, cristalline SnCl 2 formes reli??es par des cha??nes ponts de chlorure de l'illustration. Le dihydrate est ??galement trois coordonn??es, avec une eau ?? la coordonn??e sur l'??tain, et une deuxi??me coordonn??e de l'eau ?? la premi??re. La partie principale de la mol??cule piles en couches doubles dans le r??seau cristallin, avec le ??deuxi??me?? l'eau en sandwich entre les couches.
Propri??t??s chimiques
Tin (II) chlorure peut se dissoudre dans moins de sa propre masse d'eau sans d??composition apparente, mais la solution est dilu??e hydrolyse se produit pour former un sel basique insoluble:
- SnCl 2 (aq) + H 2 O (l) ↔ Sn (OH) Cl (s) + HCl (aq)
Par cons??quent, si des solutions claires d'??tain (II) chlorure doivent ??tre utilis??s, l'acide chlorhydrique doit ??tre ajout?? afin de maintenir l' ??quilibre vers la gauche (?? l'aide Le principe de Le Chatelier). Solutions de SnCl 2 sont ??galement instable vers l'oxydation par l'air:
Ceci peut ??tre ??vit?? en stockant la solution sur des morceaux de m??tal ??tain.
Il existe de nombreux cas o?? les actes d'??tain (II) de chlorure en tant qu'agent r??ducteur, la r??duction de l'argent et l'or des sels de m??tal, et le fer (III) des sels de fer (II), par exemple:
- SnCl 2 (aq) + 2 FeCl3 (aq) → SnCl 4 (aq) + 2 FeCl 2 (aq)
Solutions d'??tain (II) peuvent ??galement servir simplement en tant que source d'ions Sn 2+, qui peut former un autre ??tain (II) des compos??s par r??actions de pr??cipitation, par exemple brun (ou noir) ??tain (II): le sulfure
- SnCl 2 (aq) + Na 2 S (aq) → SnS (s) + 2 NaCl (aq)
Si alcalin est ajout?? ?? une solution de SnCl 2, un pr??cipit?? blanc hydrat?? de ??tain (II) les formes d'oxyde initialement; cette dissout ensuite dans un exc??s de base pour former un sel tel que stannite stannite de sodium:
- SnO ?? H 2 O (s) + NaOH (aq) → NaSn (OH) 3 (aq)
SnCl2 anhydre peut ??tre utilis?? pour fabriquer une vari??t?? de int??ressant ??tain (II) des compos??s dans des solvants non aqueux. Par exemple, le lithium le sel de 4-m??thyl-2,6-di-tert-butylph??nol r??agit avec SnCl 2 dans THF pour donner le lin??aire jaune ?? deux coordonn??es compos?? Sn (OAr) 2 (Ar = aryle).
??tain (II) chlorure se comporte aussi comme un Acide de Lewis, formant des complexes avec des ligands tels que l'ion chlorure, par exemple:
- SnCl 2 (aq) + CsCl (aq) → CsSnCl 3 (aq)
La plupart de ces complexes sont pyramidale , et depuis complexes tels que SnCl 3 ont une pleine octet, il ya peu de tendance ?? ajouter plus d'un ligand. Le seule paire d'??lectrons dans ces complexes est disponible pour la liaison, cependant, et par cons??quent le complexe lui-m??me peut agir en tant que Base ou ligand Lewis. Cette vue dans le produit de la r??action suivante concernant ferroc??ne:
- SnCl 2 + Fe (η 5 -C 5 H 5) (CO) 2 HgCl → Fe (η 5 -C 5 H 5) (CO) 2 SnCl 3 + Hg
SnCl 2 peut ??tre utilis?? pour fabriquer une vari??t?? de tels compos??s contenant des liaisons m??tal-m??tal, par exemple:
- SnCl 2 + Co 2 (CO) 8 → (CO) 4 Co (SnCl 2) -CO (CO) 4
Pr??paration
Anhydre SnCl 2 est pr??par?? par l'action de sec le chlorure d'hydrog??ne gazeux sur l'??tain m??tal. Le dihydrate est effectu??e par une r??action similaire, en utilisant de l'acide chlorhydrique :
L'eau est ensuite soigneusement ??vapor?? de la solution acide pour produire des cristaux de SnCl 2 ?? 2H 2 O. Cela peut ??tre dihydrate d??shydrat?? pour anhydre aide l'anhydride ac??tique.
Utilisations
Une solution d'??tain (II) contenant un peu de chlorure de l'acide chlorhydrique est utilis?? pour le ??tamage de l'acier, afin de faire des bo??tes de conserve. Un potentiel ??lectrique est appliqu??, et l'??tain m??tallique est form??e au niveau de la cathode par l'interm??diaire d'??lectrolyse .
Il est utilis?? comme catalyseur dans la production de la mati??re plastique acide polylactique (PLA).
??tain (II) chlorure trouve aussi large utilisation en tant que agent r??ducteur. Cela se voit dans son utilisation pour les miroirs d'argenture, o?? l'argent m??tal est d??pos?? sur la vitre:
- Sn 2+ (aq) + 2 Ag + → Sn 4+ (aq) + 2 Ag (s)
Une r??duction li??e a ??t?? traditionnellement utilis?? comme un test analytique pour Hg 2+ (aq). Par exemple, si on ajoute SnCl2 goutte ?? goutte dans une solution de de mercure (II) chlorure, un pr??cipit?? blanc de mercure (I) est le chlorure d'abord form??; comme plus SnCl 2 est ajout?? devient noir comme le mercure m??tallique est form??. Chlorure stanneux peut ??tre utilis?? pour tester la pr??sence de l'or compos??s . SnCl 2 tourne lumineuse violet en pr??sence d'or.
Cette r??action entre le chlorure d'??tain tr??s et or a ??t?? utilis?? dans l'??pisode # 215: Clueless des Maison d'affirmer l'intoxication d'or.
En chimie organique , SnCl 2 est principalement utilis?? dans la Stephen r??duction, par lequel un nitrile est r??duite (par l'interm??diaire d'un le chlorure d'imidoyle de sel) ?? un imine qui est facilement hydrolyse en un ald??hyde.
La r??action fonctionne g??n??ralement mieux avec des nitriles aromatiques Aryl-CN. Une r??action associ??e (appel??e m??thode Sonn-M??ller) commence par un amide, qui est trait?? avec PCI5 pour former le sel de chlorure d'imidoyle.
La r??duction Stephen est moins utilis?? aujourd'hui, car il a ??t?? remplac?? par la plupart diisobutylaluminium hydrure de r??duction.
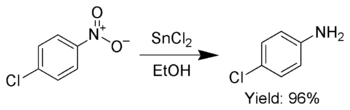
En outre, SnCl 2 est utilis??e pour r??duire s??lectivement aromatique groupes nitro en anilines.
SnCl 2 r??duit ??galement Qui??ones hydroquinones.
Le chlorure stanneux est ??galement ajout?? comme Additif alimentaire avec Num??ro E E512 ?? certains aliments en conserve et en bouteille, o?? il sert comme agent couleur r??tention et antioxydant .
Dans la culture populaire
Ce compos?? a ??t?? s??lectionn??e dans le House, MD ??pisode " Clueless ??, dans lequel il a ??t?? utilis?? pour d??tecter la pr??sence de thiomalate or et de sodium utilis?? par l'??pouse du patient de l'empoisonner.
