
Le chlorure de phosphoryle
?? propos de ce ??coles s??lection Wikipedia
Les articles de cette s??lection ??coles ont ??t?? organis??s par sujet du programme d'??tudes gr??ce aux b??n??voles d'enfants SOS. Avant de vous d??cider ?? propos de parrainer un enfant, pourquoi ne pas en apprendre davantage sur diff??rents organismes de parrainage premier ?
| Le chlorure de phosphoryle | |
|---|---|
 | |
 | |
Le chlorure de phosphoryle ou | |
Autres noms L'oxychlorure de phosphore | |
| Identificateurs | |
| Num??ro CAS | 10025-87-3 |
| Num??ro RTECS | TH4897000 |
| Propri??t??s | |
| Formule mol??culaire | POCl 3 |
| Masse molaire | 153,33 g / mol |
| Apparence | Liquide clair, incolore, vapeurs dans l'air humide |
| Densit?? | 1,645 g / cm 3, un liquide |
| Point de fusion | 1,25 ?? C (274,4 K) |
| Point d'??bullition | 105,8 ?? C (379,0 K) |
| Solubilit?? dans l'eau | R??agit |
| Viscosit?? | ? c P au? ?? C |
| Structure | |
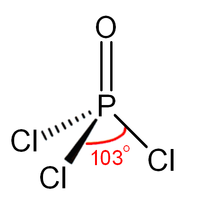
| Forme mol??culaire | t??tra??drique |
| Moment de dip??le | 2,54 R?? |
| Risques | |
| FS | MSDS externe |
| Phrases-R | 14-22-26-29-35-48 / 23 |
| Phrases S | 26-45-7 / 8 |
| Principal dangers | Tr??s corrosif, lacrymog??ne, toxique |
| Des compos??s apparent??s | |
| Des compos??s apparent??s | Chlorure de thiophosphoryle Oxybromure de phosphore |
| Page de donn??es suppl??mentaire | |
| Structure et propri??t??s | n, ε r, etc. |
| Thermodynamique donn??es | comportement de phase Solide, liquide, gaz |
| Les donn??es spectrales | UV, IR, RMN , MS |
| Sauf indication contraire, les donn??es sont donn??es pour le mat??riel dans leur ??tat standard (?? 25 ?? C, 100 kPa) | |
| R??f??rences d'Infobox | |
Le chlorure de phosphoryle (commun??ment appel?? oxychlorure de phosphore) est un liquide incolore ayant la formule P O Cl 3. Il se hydrolyse dans l'air humide ?? l'acide phosphorique en d??gageant des vapeurs d'??touffement de du chlorure d'hydrog??ne. Il est fabriqu?? industriellement ?? grande ??chelle ?? partir de trichlorure de phosphore et de l'oxyg??ne ou le pentoxyde de phosphore. Il est principalement utilis?? pour fabriquer des esters de phosphate tels que tricr??sylphosphate.
Structure
Comme phosphate, chlorure de phosphoryle est t??tra??drique en forme. Il dispose de trois liaisons P-Cl et une tr??s forte P = O double liaison, avec une estimation obligataire ??nergie de dissociation de 533,5 kJ / mol. Sur la base de longueur de la liaison et ??lectron??gativit??, la r??gle Schomaker-Stevenson sugg??re que la forme de double liaison est tr??s dominant (en contraste avec POF 3). Le P = O obligataire ne ressemble pas ?? la π obligataire dans un un groupe carbonyle comme dans une c??tone. La description appropri??e de l'interaction de PO est une question de longue discussion. Manuels ??g??s favorisent une description qui appelle la participation de la d -orbitals sur le phosphore. Certains de ces orbitales d saillie vers l'atome de O, qui se chevauchent avec p -orbitals sur l'oxyg??ne. Textes plus modernes semblent favoriser une description o?? le PO π liaison implique le sigma * composants des liaisons P-Cl. Ces descriptions ne consid??rent pas un r??le pour D-orbitales.
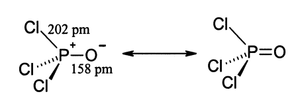
- o?? h = picom??tres
Propri??t??s chimiques
POCl 3 r??agit avec l'eau et les alcools pour donner de l'acide phosphorique ou les esters de phosphate, respectivement, par exemple
- O = PCl 3 + 3 H 2 O → O = P (OH) 3 + 3 HCl
Si l'eau est remplac??e par un alcool , les esters phosphates de trialkyle r??sultent. De telles r??actions sont souvent r??alis??es en pr??sence d'un accepteur d'HCl tel que la pyridine ou une amine . Si POCl 3 est chauff??e avec un exc??s d'un ph??nol ( ArOH) en pr??sence d'un Lewis catalyseur acide tel que du chlorure de magn??sium d'un ester phosphate de triaryle est form??e, par exemple:
- 3 C 6 H 5 OH + O = PCl 3 → O = P (OC 6 H 5) 3 + 3 HCl
POCl 3 peut ??galement agir en tant que Base de Lewis, formant produits d'addition avec une vari??t?? d'acides de Lewis tels que du t??trachlorure de titane:
- Cl 3 P + -O - + TiCl 4 Cl → P + 3 -O- - TiCl4
Le chlorure d'aluminium produit d'addition (POCl 3 ?? AlCl 3) est tout ?? fait stable, et ainsi de POCl 3 peut ??tre utilis?? pour enlever compl??tement AlCl 3 ?? partir de m??langes r??actionnels ?? la fin d'un R??action de Friedel-Crafts. POCl 3 r??agit avec le bromure d'hydrog??ne en pr??sence de AlCl 3 pour produire POBr 3.
Pr??paration
Le chlorure de phosphoryle peut ??tre pr??par?? par la r??action du trichlorure de phosphore avec de l'oxyg??ne ?? 20-50 ?? C (air est inefficace):
Une synth??se alternative implique la r??action de le pentachlorure de phosphore et le pentoxyde de phosphore. ??tant donn?? que ces compos??s sont des solides, un moyen commode d'effectuer la r??action consiste ?? chlorer un m??lange de PCl 3 et P 4 O 10, qui g??n??re le PCl 5 in situ. Comme le PCl 3 est consomm??e, le POCl 3 devient le solvant de r??action.
6 PCl 5 + P 4 O 10 → 10 POCl 3
Pentachlorure de phosphore constitue ??galement POCl 3 par r??action avec de l'eau, mais cette r??action est moins facilement contr??l?? que la r??action ci-dessus.
Utilisations
L'utilisation la plus importante de chlorure de phosphoryle est dans la fabrication d'esters de triarylphosphate (comme d??crit ci-dessus ), tels que le phosphate de triph??nyle et tricr??sylphosphate. Ces esters sont utilis??s depuis de nombreuses ann??es comme des retardateurs de flamme et plastifiants pour PVC. Pendant ce temps, les esters de trialkyle tels que le phosphate de tributyle (fabriqu?? de mani??re similaire ?? partir de butan-1-ol) sont utilis??s comme les solvants d'extraction liquide-liquide dans retraitement nucl??aire et ailleurs.
Dans l'industrie du semi-conducteur, POCl 3 est utilis?? comme source de phosphore liquide en toute s??curit?? dans des processus de diffusion. Le phosphore joue le r??le de dopant utilis?? pour cr??er des couches de type N sur une tranche de silicium.
Dans le laboratoire, POCl 3 est largement utilis?? comme un agent d??shydratant, par exemple la conversion de les amides ?? nitriles. De m??me, certains amides cycliques peuvent ??tre cyclis??s en dihydro des d??riv??s d'isoquinol??ine en utilisant le R??action Bischler-Napieralski.

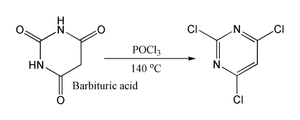
De telles r??actions sont cens??s passer par un chlorure imidoyle; dans certains cas o?? il est stable, le chlorure d'imidoyle est le produit final. Par exemple pyridones et pyrimidones peuvent ??tre convertis en d??riv??s de chloro- pyridines et pyrimidines, qui sont des interm??diaires importants dans l'industrie pharmaceutique. ??galement l'acide barbiturique est converti en 2,4,6-trichloropyrimidine. par r??action avec du POCl 3 ?? 140 ?? C.
En relation avec la chimie est l'utilisation de POCl 3 en acylation activ?? de des cycles aromatiques via le R??action pour produire de Vilsmeier-Haack aryle des ald??hydes et des c??tones . La r??action utilise le plus souvent un formamide tel que DMF ou la N -ph??nyl- N -methylformamide, et il produit un sel d'iminium qui est facilement hydrolyse en l'ald??hyde sur bilan. Par exemple 9-anthrac??ne donne anthrald??hyde:
