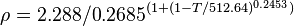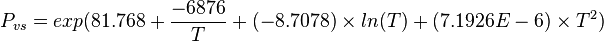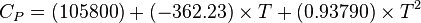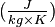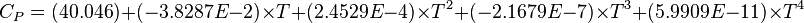Méthanol
| Méthanol | |||
|---|---|---|---|
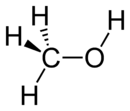  Molécule de méthanol | |||
| Identification | |||
| Nom UICPA | Méthanol | ||
| Synonymes | alcool méthylique | ||
| No CAS | |||
| No EINECS | |||
| PubChem | |||
| SMILES | |||
| InChI | |||
| Apparence | liquide incolore, d'odeur caractéristique[1]. | ||
| Propriétés chimiques | |||
| Formule brute | CH4O [Isomères] | ||
| Masse molaire[2] | 32,0419 ± 0,0014 g/mol C 37,48 %, H 12,58 %, O 49,93 %, | ||
| pKa | 15,2 | ||
| Moment dipolaire | 1,70 ± 0,02 D [3] | ||
| Diamètre moléculaire | 0,408 nm [4] | ||
| Propriétés physiques | |||
| T° fusion | −98 °C[1] | ||
| T° ébullition | 65 °C[1] | ||
| Paramètre de solubilité δ | 29,7 MPa1/2 (25 °C)[5]; 12,9 cal1/2·cm-3/2[6] | ||
| Miscibilité | miscible dans l'eau et dans l'acétone en toute proportion[1] | ||
| Masse volumique | 0,7910 g·cm-3 [7]
| ||
| T° d'auto-inflammation | 464 °C[1] | ||
| Point d’éclair | 12 °C (coupelle fermée)[1] | ||
| Limites d’explosivité dans l’air | Inférieure : 6,7 Vol% Kohn-Birett Supérieure : 36,5 Vol% Kohn-Birett | ||
| Pression de vapeur saturante | à 20 °C : 12,3 kPa[1], 410 mmHg à 50 °C | ||
| Viscosité dynamique | 0,5513 mPa·s à 25 °C (liquide) | ||
| Point critique | 239,35 °C, 8,08 MPa, 0,117 l·mol-1[9] | ||
| Conductivité thermique | 190,16 mW m-1 K-1 à 25 °C (liquide) | ||
| Conductivité électrique | 5.10-9 Ω-1 cm-1 à 25 °C | ||
| Vitesse du son | 1 121 m·s-1 à 20 °C [10] | ||
| Thermochimie | |||
| S0gaz, 1 bar | 186,9 J/mol.K | ||
| S0liquide, 1 bar | 127,19 J/mol.K | ||
| S0solide | 1,117 J/mol.K | ||
| ΔfH0gaz | -201,54 kJ·mol-1 [11] | ||
| ΔfH0liquide | -239,00 kJ·mol-1 [11] | ||
| Cp | 79,5 J/mol.K
| ||
| Propriétés électroniques | |||
| 1re énergie d'ionisation | 10,85 ± 0,01 eV (gaz)[13] | ||
| Cristallographie | |||
| Classe cristalline ou groupe d’espace | P212121[14] | ||
| Paramètres de maille | a = 4,873 Å b = 4,641 Å | ||
| Volume | 200,53 Å3 [14] | ||
| Densité théorique | 1,061 [14] | ||
| Propriétés optiques | |||
| Indice de réfraction | 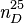 1,3265 [4] 1,3265 [4] | ||
| Précautions | |||
 T  F Phrases R : 11, 23/24/25, 39/23/24/25, Phrases S : 7, 16, 36/37, 45,
| |||
3 1 0 | |||
  B2, D1B, D2A, D2B, | |||
   Danger | |||
| Inhalation | Toxique, peut être mortelle. | ||
| Peau | assèchement | ||
| Yeux | dangereux, rend aveugle. | ||
| Écotoxicologie | |||
| LogP | -0,82/-0,66[1] | ||
| Seuil de l’odorat | bas : 4,2 ppm haut : 5 960 ppm[18] | ||
Le méthanol (ou alcool méthylique, carbinol, alcool de bois, naphte de bois ou esprit de bois) est un composé chimique de formule : CH3OH (souvent abrégé en MeOH). C’est le plus simple des alcools. C'est un liquide léger, volatil, incolore, inflammable, toxique avec une odeur caractéristique, plus douce et sucrée que celle de l’éthanol (alcool éthylique). À température ambiante, ce liquide polaire sert d'antigel (pour liquide de refroidissement par exemple), de solvant, carburant (en aéromodélisme ou en speedway) et comme dénaturant de l’alcool éthylique. Ces deux alcools restent néanmoins dissociables par distillation. En effet la température d'ébullition de l'alcool méthylique n'est que de 65°C alors que celle de l'éthanol est de 79°C. Le méthanol sert aussi à produire le biodiesel par réaction de trans-estérification.
Le méthanol est naturellement produit par le métabolisme d'organismes anaérobies de nombreuses variétés de bactéries, ce qui explique une petite fraction de vapeur de méthanol présente dans l'atmosphère. En quelques jours, ce méthanol atmosphérique est oxydé par l'oxygène de l’air avec l’action favorisante de la lumière du soleil pour former du dioxyde de carbone et de l'eau.
Le méthanol brûle dans l'air en formant du dioxyde de carbone et de l'eau : 2 CH3OH + 3 O2 → 2 CO2 + 4 H2O.
Sa flamme presque incolore et invisible est source de risque de brûlure.
Pour ses propriétés toxiques, le méthanol est fréquemment utilisé comme additif dénaturant pour l'éthanol fabriqué à usage industriel, cet ajout d'un poison permet aux industriels de l'éthanol d’économiser le versement des énormes taxes sur les alcools qui sont perçues sur toutes les boissons alcoolisées. Il est dit "alcool de bois", car autrefois sous-produit de la distillation du bois. Il est aujourd'hui synthétisé en plusieurs étapes. En résumé, du gaz naturel et de la vapeur sont reformés dans un four pour produire de l'hydrogène et du monoxyde de carbone, ensuite l'hydrogène et le monoxyde de carbone en mélange gazeux à haute pression réagissent ensemble en présence d'un catalyseur.
Histoire
Dans leur procédé d’embaumement, les anciens Égyptiens utilisaient un grand nombre de substances, y compris le méthanol, obtenu par pyrolyse du bois. Cependant le méthanol pur n’a été isolé pour la première fois qu’en 1661 par Robert Boyle, qui lui donna le nom d’esprit des boîtes, parce qu'il était produit par la distillation de caisses en bois. Il fut connu plus tard sous le nom d’esprit de pyrolyse . En 1834, les chimistes français Jean-Baptiste Dumas et Eugène-Melchior Péligot ont déterminé sa composition élémentaire. Ils ont aussi introduit le mot méthylène en chimie organique, formé à partir des mots grecs methy = vin + hŷlē = bois (écorce d'arbres). À l’origine il signifiait " alcool fabriqué à partir du bois ", mais une erreur a été commise dans l’utilisation du grec. Le terme dérivé «méthyle» est apparu aux environs de 1840 par abréviation du mot méthylène, et a ensuite été utilisé pour décrire «l'alcool méthylique». Ce terme a ensuite été transformé en "méthanol" en 1892 par la Conférence internationale sur la nomenclature des produits chimiques. Le suffixe -yl qui est utilisé en chimie organique pour former les noms des radicaux, est dérivé du mot «méthyle».
En 1923, le chimiste allemand Matthias Pier, travaillant pour BASF a développé un procédé pour convertir un gaz de synthèse (un mélange d’oxydes de carbone - monoxyde et dioxyde - et d’hydrogène) en méthanol. Cette méthode utilise le chromate de zinc comme catalyseur, et exige des conditions de pression extrêmes allant de 30 à 100 MPa (300 à 1000 atmosphères), et des températures très élevées de l'ordre de 400 °C. La production moderne du méthanol a été rendue plus efficace grâce à l'utilisation de catalyseurs (en général le cuivre) capables d’agir à basse pression.
L'utilisation du méthanol comme carburant a suscité beaucoup d’intérêt pendant les crises pétrolières des années 1970 en raison de sa disponibilité et de son faible coût. Les problèmes sont survenus très rapidement dans l'élaboration des mélanges essence-méthanol. En raison de son faible prix, certains ont commercialisé du carburant contenant trop de méthanol. D'autres ont utilisé des techniques de manipulation et de mélange inappropriées.
En 2006, des astronomes utilisant le radio télescope MERLIN de l’Observatoire Jodrell Bank ont découvert dans l'espace un nuage de méthanol d'un diamètre de cinq cent milliards de kilomètres.
Source
Le méthanol est naturellement présent dans le corps humain, les animaux, les plantes et les aliments. Il est produit par fermentation, dégradation de composés organiques (feuille) et via les métabolismes. La source principale de méthanol pour l'homme provient de notre alimentation lors de la consommation de fruits et légumes frais, de jus de fruit, de boissons fermentées et d'aliments allégés contenant de l'aspartame.
| Aliment | Concentration en Méthanol |
|---|---|
| Bière | 6–27 mg·l-1[19] |
| Vin | 96–321 mg·l-1[19] |
| Spiritueux | 10–220 mg·l-1[19] |
| Vinaigre | 10–100 mg·l-1[20] |
| Jus d'orange | 11–80 mg·l-1 (moyenne 34 mg·l-1)[21] |
| Jus de pamplemousse | 13–40 mg·l-1 (moyenne 27,4 mg·l-1)[21] |
| Jus de tomate | > 100 mg·l-1[22] |
De façon générale, le taux de méthanol dans les jus frais augmente au cours du stockage. La variation dépend, dans les jus de fruits frais, du type de fruit et de l'activité de deux enzymes : la pectinesterase et la pectate lyase. Dans les jus de légumes, la variation du taux de méthanol est liée à l'activité de l'enzyme pectinesterase, au pH et à l'acidité totale[22].
Production et synthèse
Le méthanol n'étant pas présent en quantité importante dans la nature, il doit être produit industriellement. Plusieurs voies de synthèse existent à partir des molécules les plus accessibles contenant un seul atome de carbone : CO et CO2. C'est ce que Igor Tkatchenko appelait déjà dans les années 1980 la chimie des molécules en C1[23]. La synthèse à partir de CO2 serait un moyen de valoriser ce gaz produit en grande quantité, mais elle n'est pas au point. La production du méthanol est donc faite à partir de CO et de H2. La question est donc de produire CO qui n'est pas non plus présent dans la nature.
La production du monoxyde de carbone a été très étudiée car son mélange avec H2 est un bon combustible industriel appelé gaz de synthèse. Il est traditionnellement produit par la réaction de la vapeur d'eau sur le carbone incandescent (à haute température). C + H2O → CO + H2
Cependant, au début du XXIe siècle, le gaz de synthèse, c'est-à-dire le mélange de CO et de H2, est le plus souvent réalisé à partir du méthane composant du gaz naturel plutôt que du charbon. Trois procédés sont utilisés commercialement. À des pressions modérées de 1 à 2 MPa (10 à 20 atm) et haute température (environ 850 °C), le méthane réagit avec la vapeur d'eau en présence d’un catalyseur, le nickel, pour produire un gaz de synthèse, selon l’équation chimique : CH4 + H2O → CO + 3 H2
Cette réaction, connue sous le nom de vaporeformage du méthane ou SMR, est endothermique et les impératifs de transfert thermique imposent des limites à la taille des réacteurs à catalyse utilisés. Le méthane peut aussi subir une oxydation partielle par l'oxygène moléculaire pour produire du gaz de synthèse, comme le montre l'équation suivante : 2 CH4 + O2 → 2 CO + 4 H2
Cette réaction est exothermique et la chaleur dégagée peut être utilisée in situ pour amorcer la réaction de reformage du méthane par la vapeur. Lorsque les deux processus sont combinés, on parle de reformage autothermique. Le rapport entre les quantités de CO et de H2 peut être ajusté en utilisant la réaction à effet de glissement de vapeur d’eau, pour fournir la stœchiométrie voulue pour la synthèse du méthanol.
Le monoxyde de carbone et l'hydrogène réagissent ensuite sur un second catalyseur pour produire du méthanol. Aujourd'hui, le catalyseur le plus largement utilisé est un mélange de cuivre, d’oxyde de zinc et d’alumine utilisé pour la première fois par ICI en 1966. À une pression de 5 à 10 MPa (50 à 100 atm) et une température de 250 °C, il peut catalyser la production de méthanol à partir du monoxyde de carbone et de l'hydrogène de façon très sélective :
La production de gaz de synthèse à partir du méthane produit 3 moles d'hydrogène pour chaque mole de monoxyde de carbone, tandis que la synthèse de méthanol consomme seulement 2 moles d'hydrogène pour chaque mole de monoxyde de carbone. Une façon de pallier l'excès d'hydrogène consiste à injecter du dioxyde de carbone dans le réacteur de synthèse du méthanol, où il réagit lui aussi, pour former du méthanol selon l’équation chimique :
La société française Air Liquide est leader mondial dans l'ingénierie de la production de méthanol à partir du méthane, c'est-à-dire en pratique du gaz naturel. En effet cette synthèse consomme des quantités très importantes d'oxygène dont l'Air Liquide est un des plus gros producteur mondial. L'ingénierie d'unité de grande taille est protégée sous le nom de «Megamethanol ». Plusieurs unités ont été installées aux États-Unis en 2014, pays où le gaz naturel est très bon marché et où la production de méthanol est un moyen de valoriser le gaz de schiste[24].
Bien que le gaz naturel soit le produit le plus économique et le plus largement utilisé, d’autres matières premières peuvent également être employées pour produire du méthanol. Là où le gaz naturel n'est pas disponible, les dérivés légers du pétrole peuvent être utilisés à sa place. La firme sud africaine Sasol produit du méthanol à l'aide de gaz de synthèse à partir du charbon.
Utilisation
Le méthanol est utilisé comme solvant dans les vernis-lacque, peintures, ciments, encres, antigel, colorants, plastiques et diverses peintures industrielles. C'est aussi un carburant pour les fusées.
Matière première
Le plus grand débouché du méthanol et de loin, est son utilisation comme matière première pour la synthèse d'autres produits chimiques. Environ 40 % du méthanol est converti en formaldéhyde, pour être transformé en produits aussi divers que des matières plastiques, des résines synthétiques (dont certaines entrent dans la fabrication du contreplaqué), des peintures, des explosifs, et des tissus infroissables.
Aussi, au début des années 1970 le procédé de l’essence au méthanol a été développé par Mobil, qui produit du carburant pour les véhicules. Une unité de production industrielle a été construite en Nouvelle-Zélande dans les années 1980. Dans les années 1990, de grandes quantités de méthanol ont été utilisées aux États-Unis pour produire un additif pour l'essence le méthyl tert-butyl éther (MTBE), malgré la défection de nombreux États où il était interdit. En plus de son utilisation directe comme carburant, le méthanol (ou plus rarement, l’éthanol) est utilisé comme composant dans la trans-estérification des triglycérides pour produire une forme de biodiesel.
Parmi les autres dérivés chimiques du méthanol on compte aussi le diméthyléther, qui a remplacé les CFC comme propulseur d’aérosols et l’acide acétique.
Carburant automobile
Le méthanol est utilisé en quantité limitée comme combustible de moteur à combustion interne, principalement en raison du fait qu'il n'est pas aussi inflammable que l’essence. L’utilisation de méthanol pur ou mélangé est imposée par le règlement pour certaines courses de voitures comme ce fut le cas aux États-Unis pour des raisons de sécurité en Champ Car ou en IndyCar. Le méthanol est indispensable pour certains moteurs suralimentés de dragster. Certains véhicules utilisent des mélanges avec de l'éthanol, de l'essence, ou du protoxyde d'azote. Le méthanol est également le carburant utilisé par les amateurs de modélisme aérien pour les maquettes radiocommandées d’avions ou encore pour les motos de speedway, discipline sportive motocycliste.
L'un des inconvénients de méthanol comme carburant est la corrosion pour certains métaux, notamment l’aluminium. Le méthanol, bien qu’il soit un acide faible, attaque la couche d'oxyde qui protège normalement l'aluminium de la corrosion. Afin de prévenir la détérioration du moteur et du carburateur, il est fortement recommandé de traiter l'hydrate de méthyl avec une huile spécialement conçue pour la protection.
6 CH3OH + Al2O3 → 2 Al(OCH3)3 + 3 H2O
Les methoxides produits sont des sels solubles dans le méthanol qui décapent la surface de l'aluminium qui est facilement oxydé par l'oxygène dissous. Ainsi le méthanol peut se comporter comme un oxydant : 6 CH3OH + 2 Al → 2 Al(OCH3)3 + 3 H2
Ce processus explique la corrosion par le combustible jusqu'à ce que le métal soit rongé ou que la concentration en CH3OH soit devenue négligeable.
Lorsqu'il est produit à partir du bois ou d'autres matières organiques, le méthanol organique obtenu (bio-alcool) pourrait devenir une solution de rechange alternative et renouvelable aux hydrocarbures à base de pétrole. Toutefois, on ne peut utiliser le méthanol pur dans les voitures à essence modernes sans modification du moteur, en raison d'éventuels dommages causés à la tuyauterie en métal et aux joints en caoutchouc.
Autres applications
Le méthanol est utilisé traditionnellement comme dénaturant de l'éthanol, ce qui est explique l’origine du terme Alcool dénaturé.
Le méthanol est également utilisé comme solvant, et comme antigel dans les oléoducs et le liquide des lave-glaces.
Dans certaines stations d’épuration, une petite quantité de méthanol est ajouté aux eaux usées pour leur fournir une source de carbone afin d’alimenter les bactéries dénitrifiantes, qui transforment les nitrates en azote.
Au cours de la Seconde Guerre mondiale, le méthanol a été utilisé comme combustible par l’armée allemande pour plusieurs modèles de fusées, sous le nom de M-Stoff, et dans un mélange connu sous le nom de C-Stoff.
Le méthanol est utilisé comme agent de dénaturation dans l’électrophorèse sur gel de polyacrylamide.
Les piles à combustible fonctionnant au méthanol sont les seules qui soient utilisables à basse température, à pression atmosphérique, ce qui permet leur miniaturisation à un niveau jusqu’alors inconnu. Cette caractéristique, associée à un stockage et une manipulation relativement simple et sûre du méthanol peut ouvrir la voie aux piles à combustible pour le fonctionnement des appareils électroniques, comme les ordinateurs portables[25].
Santé et sécurité
Le méthanol est toxique par deux mécanismes. Premièrement, le méthanol (s’il pénètre dans l’organisme par ingestion, inhalation, absorption cutanée) peut provoquer la mort en raison de ses propriétés de dépresseur du système nerveux central de la même façon que l’éthanol. Deuxièmement, il devient toxique après avoir été métabolisé dans le foie sous l’action d’une enzyme, l’alcool déshydrogénase qui le transforme en formaldéhyde. Celui-ci est ensuite métabolisé en acide formique par une aldéhyde déshydrogénase ou une formaldéhyde déshydrogénase. Ces composés sont à l'origine d'acidose métabolique, de cécité par destruction du nerf optique[26], etc. Les tissus fœtaux sont très sensibles aux effets du méthanol. La dose dangereuse est rapidement atteinte si une personne est régulièrement exposée à des vapeurs ou manipule des liquides sans protection cutanée. Si le méthanol a été ingéré, un médecin doit être contacté immédiatement. La dose mortelle communément admise est de 100 à 125 mL (4 fl oz). Les effets toxiques apparaissent au bout de plusieurs heures et des antidotes efficaces peuvent souvent éviter la survenue de dommages irréversibles. Ce traitement utilise l’éthanol ou le fomépizole[27]. Ces deux médicaments ont pour effet de ralentir l'action de l’alcool déshydrogénase sur le méthanol par le mécanisme de l’inhibition compétitive, pour qu'il soit excrété par le rein, plutôt que transformé en métabolites toxiques.
Les premiers symptômes de l'intoxication par le méthanol sont les signes de dépression du système nerveux central : maux de tête, étourdissements, nausées, troubles de coordination, confusion, somnolence, et aux doses élevées, le coma et la mort. Les premières manifestations de l'exposition au méthanol sont en général moins graves que les symptômes résultant de l'ingestion d'une quantité analogue d’alcool éthylique.
Lorsque les premiers symptômes ont disparu, de nouveaux symptômes apparaissent 10 à 30 heures après la première exposition au méthanol : diminution ou perte complète de la vision, accompagnée d’une acidose. Ces symptômes sont provoqués par l'accumulation de formiate atteignant des niveaux toxiques dans le sang, et peuvent conduire à la mort par insuffisance respiratoire. Les esters dérivés du méthanol ne jouent aucun rôle dans cet effet toxique.
L'éthanol est parfois dénaturé (frelaté), et par conséquent rendu imbuvable, par l'ajout de méthanol. Le résultat est connu sous le nom d’alcool dénaturé ou « meths » (utilisation au Royaume-Uni). (Cette dernière ne doit pas être confondue avec meth, une abréviation désignant communément la méthamphétamine.)
Le méthanol pur a été utilisé dans des courses automobiles open depuis le milieu des années 1960. Contrairement aux feux de pétrole, les feux de méthanol peuvent être éteints avec de l'eau ordinaire (bien que le méthanol soit moins dense que l'eau, les deux substances sont miscibles, et l'ajout d'eau absorbe la chaleur de l'incendie pour faire bouillir l'eau). En outre, un incendie à base de méthanol brûle sans fumées, à la différence de l'essence, qui brûle en produisant une épaisse fumée noire. Si un incendie se produit sur la piste, il n'y a pas de dégagement de fumée risquant de diminuer la visibilité des pilotes arrivant à pleine vitesse sur les lieux de l’accident. La décision de passer au méthanol en permanence dans la course américaine de l’IndyCar (American Car Championship) a été une conséquence du crash et de l'explosion dévastatrice à la course d’Indianapolis de 1964, qui a provoqué la mort des pilotes Eddie Sachs et Dave MacDonald.
Ces considérations sur l'ajout de méthanol aux carburants auto ont été mis en lumière par l’impact récemment constaté sur les eaux souterraines d'un additif du carburant le méthyl tert-butyl éther (MTBE). Un défaut d’étanchéité des réservoirs souterrains de stockage d'essence a provoqué des fuites de MTBE dans les nappes contaminées. La solubilité élevée du méthanol dans l'eau suscite des préoccupations analogues à propos de l’éventuelle contamination de l'eau qui pourrait découler de l'utilisation généralisée du méthanol comme carburant automobile.
Précautions
Le méthanol est une substance très toxique. Sa consommation peut entraîner la cécité et même la mort. De l'alcool frelaté est parfois fabriqué avec du méthanol : le buveur est moins sujet à l'ébriété (qu'avec de l'éthanol) mais le nerf optique est atteint avec un risque certain de cécité.
Avant toute utilisation régulière, consulter la fiche toxicologique de l'INRS
Radiolyse du méthanol
La radiolyse du méthanol en présence d'une radioactivité intense présente certaines similitudes avec celle de l'eau[28].
Notes et références
- 1 2 3 4 5 6 7 8 METHANOL, fiche de sécurité du Programme International sur la Sécurité des Substances Chimiques, consultée le 9 mai 2009
- ↑ Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- ↑ (en) David R. Lide, Handbook of chemistry and physics, CRC, , 89e éd., 2736 p. (ISBN 142006679X et 978-1420066791), p. 9-50
- 1 2 (en) Yitzhak Marcus, The Properties of Solvents, vol. 4, England, John Wiley & Sons Ltd, , 239 p. (ISBN 0-471-98369-1)
- ↑ (en) James E. Mark, Physical Properties of Polymer Handbook, Springer, , 2e éd., 1076 p. (ISBN 0387690026, lire en ligne), p. 294
- ↑ (en) Șerban Moldoveanu, Sample preparation in chromatography, Elsevier, , 930 p. (ISBN 0444503943), p. 258
- ↑ (en) J. G. Speight, Norbert Adolph Lange, Lange's handbook of chemistry, McGraw-Hill, , 16e éd., 1623 p. (ISBN 0071432205), p. 2.289
- 1 2 3 (en) Robert H. Perry et Donald W. Green, Perry's Chemical Engineers' Handbook, USA, McGraw-Hill, , 7e éd., 2400 p. (ISBN 0-07-049841-5), p. 2-50
- ↑ (en) Claudio A. Faúndez et José O. Valderrama, « Activity Coefficient Models to Describe Vapor-Liquid Equilibrium in Ternary Hydro-Alcoholic Solutions », Chinese Journal of Chemical Engineering, vol. 17, no 2, , p. 259-267 (DOI 10.1016/S1004-9541(08)60203-7)
- ↑ (en) W. M Haynes, Handbook of chemistry and physics, CRC, 2010-2011, 91e éd., 2610 p. (ISBN 9781439820773), p. 14-40
- 1 2 (en) Irvin Glassman, Richard A. Yetter, Combustion, Elsevier, , 4e éd., 773 p. (ISBN 978-0-12-088573-2), p. 6
- ↑ (en) Carl L. Yaws, Handbook of Thermodynamic Diagrams, vol. 1, 2 et 3, Huston, Texas, Gulf Pub. Co., (ISBN 0-88415-857-8, 0-88415-858-6 et 0-88415-859-4)
- ↑ (en) David R. Lide, Handbook of chemistry and physics, CRC, , 89e éd., 2736 p. (ISBN 9781420066791), p. 10-205
- 1 2 3 4 « Methanol », sur www.reciprocalnet.org (consulté le 12 décembre 2009)
- ↑ « méthanol » sur ESIS, consulté le 18 février 2009
- ↑ « Alcool méthylique » dans la base de données de produits chimiques Reptox de la CSST (organisme québécois responsable de la sécurité et de la santé au travail), consulté le 23 avril 2009
- ↑ Numéro index dans le tableau 3.1 de l'annexe VI du règlement CE N° 1272/2008 (16 décembre 2008)
- ↑ « Methyl alcohol », sur hazmap.nlm.nih.gov (consulté le 14 novembre 2009)
- 1 2 3 (en) HB Greizerstein, « Congener contents of alcoholic beverages », J Stud Alcohol, no 42, , p. 1030-1037
- ↑ (en) GP Blanch, J. Tabera, J. Sanz, M. Herraiz et G. Reglero, « Volatile composition of vinegars. Simultaneous distillation-extraction and gas chromatographic-mass spectrometric analysis », J Agric Chem, no 40, , p. 1046-1049 (DOI 10.1021/jf00018a027, lire en ligne [PDF])
- 1 2 (en) E.D. Lund, C.L. Kirkland et P.E. Shaw, « Methanol, ethanol and acetaldehyde contents of citrus products », J Agric Food Chem, no 29, , p. 361-366 (DOI 10.1021/jf00104a034, lire en ligne [PDF])
- 1 2 (en) Chih-Yao Hou, Yeong-Shenn Lin, Yuh Tai Wang, Chii-Ming Jiang et Ming-Chang Wu, « Effect of storage conditions on methanol content of fruit and vegetable juices », Journal of Food Composition and Analysis, vol. 21, no 5, , p. 410-415 (DOI 10.1016/j.jfca.2008.04.004)
- ↑ http://cat.inist.fr/?aModele=afficheN&cpsidt=9579149
- ↑ Compte rendu de l'Assemblée Générale des actionnaires d'Air Liquide du 6 mai 2015à Paris
- ↑ (en) S Berger, « Methanol Laptop Fuel », Hi-Tech & Gadgets, sur http://www.compukiss.com, Compu•Kiss, (consulté le 22 mai 2007)
- ↑ (en) Anonyme, « Methanol and Blindness », Ask A Scientist, sur http://www.newton.dep.anl.gov, Newtown, (consulté le 31 octobre 2008)
- ↑ (en) MJ Casavant, « Fomepizole in the Treatment of Poisoning », Pediatrics, vol. 107, no 1, , p. 170 (ISSN 0031 4005, DOI 10.1542/peds.107.1.170, résumé, lire en ligne [PDF])
- ↑ C. et J. -P. Jay-Gerin, Quelques aspects actuels de la radiolyse du méthanol liquide: Une revue ; Radiation Physics and Chemistry Volume 48, Issue 4, October 1996, Pages 473-480 doi:10.1016/0969-806X(96)00007-2 ; Radiation chemistry (Résumé, en français et anglais)
Voir aussi
Articles connexes
Autres alcools :
- éthanol
- propanol
- butanol
Liens externes
- Fiche toxicologique de l'INRS
- Fiche internationale de sécurité
- (en) ENVIRONMENTAL HEALTH CRITERIA 196 Methanol
- (en) Race Car Book RaceCarBook.com, includes technical articles and methanol racing book information.
- (en) The Methanol Institute Industry trade group, lots of information on methanol's use in fuel cells and as an alternative fuel.
- (en) The methanol story: a sustainable fuel for the future article by Ford Motor's Roberta Nichols, the mother of the flexible fuel vehicle, discussing Gasoline-Ethanol-Methanol flexibility in the Journal of Scientific & Industrial Research
Bibliographie
- (en) Robert Boyle, The Sceptical Chymist (1661) – contains account of distillation of wood alcohol.
- Portail de la chimie
- Portail de l’énergie