Nombre d'Avogadro
En chimie et en physique, le nombre d'Avogadro (ou constante d'Avogadro), noté NA[1], est défini comme le nombre d'entités qui se trouvent dans une mole. Il correspond au nombre d'atomes de carbone dans 12 grammes de l'isotope 12 du carbone. De par sa définition, le nombre d'Avogadro possède une dimension, l'inverse d'une quantité de matière, et une unité d'expression dans le système international d'unités : la mole[2] à la puissance moins un. Sa valeur numérique est :
Le nombre d'Avogadro est nommé en l'honneur du physicien et chimiste italien Amedeo Avogadro (1776 - 1856).
Jean Perrin a décrit dans son livre de vulgarisation important Les atomes (1913) les expériences concordantes qui ont permis d'approcher le nombre supposé par Avogadro et ainsi d'asseoir la théorie atomique.
Si N(X) désigne le nombre d'entités X d'un échantillon donné d'un corps pur, et si n(X) désigne la quantité de matière d'entités X du même échantillon, on obtient la relation[2] :
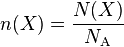 .
.Le nombre d'Avogadro correspond également au facteur de conversion entre le gramme et l'unité de masse atomique (u) :
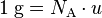
Valeur numérique
Dans les unités SI, le CODATA de 2010 recommande la valeur suivante[3] :
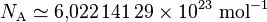 .
.
Avec une incertitude standard de :
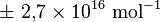 .
.
Soit une incertitude relative de :
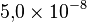 .
.
Des travaux visant à préciser cette mesure ont été publiés en janvier 2011[4] et proposent la valeur 6,022 140 82(18)×1023 mol-1, avec une incertitude relative de 3,0×10-8.
Exposé simplifié
La masse de l'atome est pratiquement égale à la masse du noyau. Cela tient à deux choses :
- les électrons sont environ 2 000 fois plus légers que les nucléons (nucléon = constituant du noyau atomique. Il y a deux "types" de nucléons : le proton et le neutron) ;
- les électrons sont moins nombreux que les nucléons (mais dans l'atome neutre il y a autant d'électrons que de protons).
En outre, le proton et le neutron ont quasiment la même masse. Par conséquent, on obtient une mesure assez précise de la masse de l'atome en multipliant son nombre de nucléons (encore appelé nombre de masse, A) par la masse du nucléon. La masse d'un nucléon au repos est de l'ordre de 1,67·10-24 g, de sorte qu'un gramme de matière en contient environ six cent mille milliards de milliards. Ce nombre est proche du nombre d'Avogadro, noté NA.
Ainsi, la masse de NA molécules est proche de A grammes où A est le nombre de nucléons de la molécule. Par exemple, la molécule d'eau (constituée de deux atomes d'hydrogène H et d'un atome d'oxygène O) comporte 18 nucléons (1 nucléon pour chaque H et 16 nucléons pour l'O, en négligeant les isotopes), donc 18 grammes d'eau contiennent six cent mille milliards de milliards de molécules. L'atome de fer comporte 56 nucléons, donc 56 grammes de fer contiennent environ six cent mille milliards de milliards d'atomes. En réalité, les différents isotopes naturels des éléments (qui diffèrent par leur nombre de neutrons, le nombre de protons étant caractéristique d'un élément) font que la masse de NA atomes d'un élément X peut être assez différente : par exemple une mole de fer a une masse moyenne d'environ 55,846 g, et non 56 g.
Autres utilisations
- La constante des gaz parfaits est le produit de la constante de Boltzmann k par le nombre d'Avogadro.
- La constante de Faraday est le produit de la charge élémentaire e par le nombre d'Avogadro.
Histoire
Une conséquence du positivisme
La difficulté de diffusion des hypothèses d'Avogadro est due à la philosophie scientifique de l'époque : elle interdisait les « hypothèses » non démontrées, ou non démontrables. Il valait mieux faire une théorie qui s'en passât.
Elle est aussi due à l'incompréhension de la liaison covalente, qui n'a été réellement comprise par Heitler et London qu'en 1927, grâce à la mécanique quantique (1926)[5]. La théorie ionique de Berzelius ne permettait pas l'existence du dihydrogène ou du dioxygène.
De ce fait, le langage hésite : avant de comprendre qu'une molécule est composée d'atomes, et pourquoi H2 plutôt que H4, et pourquoi NO2 plutôt que N2O4, il faut du temps pour amasser suffisamment de données compatibles, et écarter les « inclassables » (par exemple, les berthollides[6]).
Au début du XIXe siècle, Avogadro énonça sa loi, dite aussi loi des gaz parfaits (1811). Ampère l'encouragea en 1814, mais il se rétracta devant une levée de boucliers. La réaction des anti-atomistes (on disait les Équivalentistes), d'inspiration positiviste, se durcit encore avec Dumas en 1836, puis Berthelot et Le Chatelier.
Le Congrès de Karlsruhe de 1860 permit aux deux communautés d'enterrer la hache de guerre. Mais les jeunes chimistes en revinrent convertis à la théorie atomique par le rapport de Cannizzaro.
Il est alors admis que dans un gaz dit parfait, le volume V0 occupé par N particules, sous la pression P0 et la température T0 est le même quel que soit le gaz, ceci étant en fait une définition d'un gaz parfait, théorique.
Il restait à mesurer ce nombre, ce qui n'était plus qu'une question de métrologie.
L'intervention de Maxwell
Le premier texte important de théorie cinétique des gaz est celui du XVIIIe siècle de Daniel Bernoulli qui calcula correctement la pression cinétique (1738, Hydrodynamica)[7]. Mais ce document passa inaperçu.
Lorsque Loschmidt trouva la première valeur en ordre de grandeur : 1024, cela donnait aux atomes une taille de 0,1 nm. Et il fallut toute l'autorité de Maxwell pour que ces résultats fussent considérés comme crédibles. La théorie cinétique des gaz avait acquis « ses galons » (1870).
La mesure proprement dite
Elle n'a aucun intérêt en elle-même : le tableau de Mendeleïev décrivait les éléments et leur masse relative respective. Choisir tel ou tel élément comme référence est une convention, qui d'ailleurs a changé : il aurait été naturel de choisir la masse d'une mole de protons égale à 1 gramme ; mais à l'époque, on ne savait pas si l'atome était sécable. Il fallait donc une mesure dont la traçabilité soit reconnue : le choix s'est fixé jusqu'à 2005, sur la définition : 12 grammes de 12C contiennent NA atomes.
Ce nombre est connu avec une précision relative de 5×10-8 et vaut : NA = 6,022 140 82(18)×1023 mol-1.
Dès que l'on saura compter les atomes en grande quantité via des écluses à atomes individuels, cette valeur s'améliorera. Pour l'instant, c'est toujours le résidu d'impuretés dans le silicium qui est source de problème.[réf. souhaitée]
Compléments
Il existe au fond deux problèmes distincts :
- la compréhension en chimie du fait que les molécules sont constituées d'atomes, et échangent ces atomes lors d'une réaction chimique pour donner d'autres molécules (de propriétés différentes) ;
- le fait que ces « particules » (molécules ou atomes), dans un état gazeux dit parfait, occupent toutes le même volume moyen : soit 22,414 L sous une pression de 1,013 25×105 Pa et une température de 273,15 K, pour le nombre de particules égal au nombre d'Avogadro : cette mesure relève plutôt de la physique.
Gassendi rénove la théorie atomique (1638) ; le premier théorème de théorie cinétique des gaz date de Bernoulli en 1738. Mais il sera oublié jusqu'à Clausius, vers 1855. La raison en est qu'il faut que la chimie se dépêtre de l'alchimie grâce à la balance.
Atomes et Chimie
Il fallut extraire les corps purs des mélanges (piège des eutectiques et des azéotropes, piège des cristaux isomorphes) : après Wenzel (1782), Richter (1795), la querelle Berthollet-Proust (1799-1806), il fut admis qu'un corps pur est composé des mêmes corps simples dans les mêmes proportions discontinues et définies : eau et eau oxygénée sont deux corps purs différents. John Dalton (1808) propose la classification en corps binaire (A+B→AB), ternaire (A+2B→AB2), indiquant clairement sa vision atomique des molécules, et donne les masses relatives des « équivalents ». Berzelius proposera de nommer chaque élément par un symbole. Gay-Lussac établit pour les composés gazeux les lois des volumes en proportions définies (1809). Voir aussi Loi des proportions définies.
La difficulté était celle-ci : en eudiométrie, la décomposition de l'eau donne 2 volumes de dihydrogène et 1 volume de dioxygène. La recomposition de l'eau fait que ces volumes ne redonnent que 2 volumes de vapeur d'eau.
Le pas immense que franchit Avogadro est d'admettre l'existence du dihydrogène et du dioxygène, qui devaient se décomposer pour donner deux molécules d'eau H2O ; ce qui permettait de résoudre les conflits entre Dalton et Gay-Lussac. Mais ces « décomposition » et recombinaison étaient en tout état de cause fort problématiques. Il est peu écouté : la théorie de Berzelius ne permet pas de rendre compte de l'existence de la « molécule » H2.
Néanmoins Berzelius perfectionne la notion de masse relative des éléments (la loi de Dulong et Petit joue alors un rôle important (1819) ; la loi cristalline de Mitscherlich (en) (1819-1823) aussi).
Dumas, en 1826, est adepte convaincu du système atomique de Dalton, et permet par sa fameuse loi (d = M/29) de déterminer moult masses molaires[8]. Mais convaincu par la philosophie positiviste, il rejette l'atomisme en 1836 : ses vapeurs de phosphore blanc P4, et d'hexasoufre (en) S6, puis graduellement de disoufre (en) S2 l'ont, à l'évidence, contrarié.
Gmelin, anti-atomiste convaincu, ne fait toujours pas la différence entre atome et molécule et donne la Table des Equivalents (1830).
Faraday publie ses équivalents électrochimiques ioniques dans les lois de l'électrolyse (1833).
Conclusion : faute de comprendre H2, P4 et S6, la théorie atomique achoppe, malgré Gaudin (1833), qui, sans succès, reprend Avogadro, et définit le dihydrogène, le tétraphosphore… et distingue parfaitement entre molécule, faite d'atomes éléments.
La chimie organique (Wöhler, synthèse de l'urée (1828)) et son omniprésente covalence, fait oublier Berzelius ; et Gerhardt (1843), puis Laurent (1846) redécouvrent ce qu'avait dit Gaudin. La thermochimie naissante des années 1845 confirme : il faut briser H2 et Cl2 pour donner 2 HCl.
Restaient les étranges variations « graduelles ». Cannizzaro sauve la théorie atomique : il y a dissociation progressive. Sainte-Claire Deville confirme. On est en 1856.
Le congrès de Karlsruhe de 1860 enterre la hache de guerre entre équivalentistes et atomistes ; mais clairement les atomistes seront avantagés dans leur compréhension de la chimie.
Physiciens et la taille des atomes
La théorie du calorique de Black vient perturber la physique du XVIIIe. En Angleterre, Joule (1848) redécouvre les travaux de Bernoulli. Krönig (1856) améliore ; Clausius (1857) trouve l'expression de la vitesse quadratique moyenne des atomes.
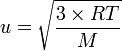 , soit
, soit 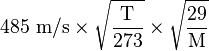 .
.
Et il retrouve l'explication d'Avogadro, de Gaudin et autres : l'« hydrogène » est du dihydrogène.
La vitesse moyenne était très élevée ; mais Clausius invente la notion géométrique capitale de libre parcours moyen.
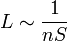 , avec S = section efficace.
, avec S = section efficace.
La théorie cinétique des gaz est née ; l'ordre de grandeur du coefficient de diffusion sera :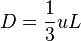 en m2·s-1, comme la viscosité cinématique. Loschmidt en tirera (1865) la valeur de la taille des atomes et le nombre d'Avogadro. W. Thomson-Lord Kelvin essaiera de leur donner une structure de nœuds, mais ce sera en 1926, l'équation de Schrödinger, puis les équations de Hartree-Fock qui donneront la solution actuelle.
en m2·s-1, comme la viscosité cinématique. Loschmidt en tirera (1865) la valeur de la taille des atomes et le nombre d'Avogadro. W. Thomson-Lord Kelvin essaiera de leur donner une structure de nœuds, mais ce sera en 1926, l'équation de Schrödinger, puis les équations de Hartree-Fock qui donneront la solution actuelle.
Notes et références
- ↑ Le Chimie.
- 1 2 « Unité de quantité de matière »
- ↑ (en) Peter J. Mohr, Barry N. Taylor et David B. Newell, « CODATA Recommended Values of the Fundamental Physical Constants: 2006 », Rev. Mod. Phys., vol. 80, , p. 633–730 (DOI 10.1103/RevModPhys.80.633, lire en ligne) lien direct vers la valeur.
- ↑ (en) Andreas, B. et al., « Counting the atoms in a 28Si crystal for a new kilogram definition », Metrologia, vol. 48, no 2, , S1 (DOI 10.1088/0026-1394/48/2/S01)
- ↑
- ↑ Un berthollide est un composé non-stœchiométrique. Antonyme : daltonide (en).
- ↑ Britannica.
- ↑ Voir Densité des gaz.
Voir aussi
Articles connexes
- Constante physique
- Théorie cinétique des gaz
- Loi d'Avogadro
Bibliographie
- Jean Perrin, Les Atomes, (1913) , Éditions Félix Alcan, Paris, [détail des éditions] présente (entre autres) une description détaillée des différentes méthodes et expériences imaginées pour mesurer la constante d'Avogadro.
- Jean-Paul Mathieu, Histoire de la constante d'Avogadro, 1984 (ISBN 2-7359-0016-9)
- Alfred Kastler, « Le concept d'atomes depuis 100 ans », Journal de Physique, tome 34, 1973, C.10, 33-43.
Liens externes
- Particle data group
- Atomic Mass Data Center
- Le texte d'Avogadro (1811) à l'origine du nombre d'Avogadro en ligne et commenté sur le site BibNum
- Portail de la physique
- Portail de la chimie

