Électrochimie
|
|
Cet article ne cite pas suffisamment ses sources (mars 2013). Si vous disposez d'ouvrages ou d'articles de référence ou si vous connaissez des sites web de qualité traitant du thème abordé ici, merci de compléter l'article en donnant les références utiles à sa vérifiabilité et en les liant à la section « Notes et références » (modifier l'article, comment ajouter mes sources ?).
|
L’électrochimie est la discipline scientifique qui s’intéresse aux relations entre la chimie et l’électricité. Elle décrit les phénomènes chimiques couplés à des échanges réciproques d’énergie électrique. L'électrochimie comprend toutes technologies et techniques issues de ses travaux scientifiques (électrolyse, corrosion, piles, batteries, électrodéposition, etc.).
De plus, l’électrochimie s’intéresse à des systèmes hétérogènes comportant aux deux extrémités des matériaux conducteurs électroniques (métal, carbone…) et, entre ces deux conducteurs, au moins un matériau conducteur ionique (électrolyte liquide ou gélifié, sel fondu…)[1].
Description
Les réactions électrochimiques sont les phénomènes qui ont lieu à l'interface de deux systèmes conducteurs (électronique : électrodes et ionique : solutions) lors du transfert de charge composé de un ou plusieurs électrons. Ces transferts de charges s'accompagnent de modification des états d'oxydation des matériaux (oxydation ou réduction) et donc de leur nature physico-chimique (dépôt métallique, évolution de gaz, formation d'espèces radicalaires, réactions chimiques couplées…). L'ensemble des réactions élémentaires peut ainsi atteindre un haut niveau de complexité. L'électrochimie permet de mieux appréhender les phénomènes d'oxydoréduction et de corrosion.
Remarque : une jonction P-N entre deux semi-conducteurs n’est pas du ressort de l’électrochimie, mais de la physique du solide. En revanche, une jonction P-N en contact avec un électrolyte relève de l'électrochimie et pas de la physique du solide.
Histoire
Grands domaines d’applications
On classe généralement les applications industrielles de l’électrochimie dans 5 grandes catégories :
Électrosynthèse
L’électrosynthèse est parfois utilisée dans l’industrie chimique lourde au détriment d’une synthèse par voie thermique, les procédés d’électrosynthèse étant généralement plus facilement contrôlables et sélectifs. Les principales matières premières produites par électrosynthèse sont : l’aluminium (environ 24 Mt/an), le dichlore et la soude (environ 40 Mt/an). On produit également en quantité moindre du difluor, du lithium, du sodium, du magnésium et du dihydrogène.
On rangera dans la même catégorie la purification de certains métaux par électroaffinage (notamment le cuivre, le zinc et l’aluminium).
Traitement de surface et corrosion
Les traitements de surface par voie électrochimique sont nombreux car l’électrochimie permet de bien contrôler la nature et la qualité du dépôt. Ce dépôt de métal (nickel, zinc, or, etc.) de quelques micromètres d'épaisseur (allant d'un flash (~0.1um) à une ou plusieurs centaines de micromètres selon le métal déposé) joue un rôle esthétique ou de protection contre la corrosion. Les méthodes électrochimiques peuvent aussi servir à la restauration d’objets anciens.
Stockage et la conversion de l’énergie
Les piles et accumulateurs électriques sont des générateurs électrochimiques. Les accumulateurs se distinguent des piles par le fait qu'ils sont électriquement rechargeables. Leur domaine est en pleine expansion.
- Dans des applications de type « grand public » comme les batteries pour téléphones portables.
- Dans les applications professionnelles, les plus courantes sont les batteries au Plomb, elles assurent le rôle de source d'énergie auxiliaire des véhicules automobiles permettant entre autres, leur mise en route.
- D'autres types d'accumulateurs, plus sophistiquées, commencent à jouer un grand rôle dans les véhicules hybrides ; ils stockent l'énergie récupérée par l'intermédiaire de générateurs lors des freinages et, la restituent avec des moteurs électrique lors des phases d'accélération : exemple, certains modèles Toyota.
- D'autre part, de nombreuses recherches sont aujourd’hui effectuées dans le domaine des piles à combustible afin d'équiper ces mêmes véhicules. Ceci bien que la ressource en hydrogène propre soit encore hypothétique.
Les supercondensateurs sont des condensateurs (capacités) aptes à accumuler rapidement une grande quantité d'énergie électrique puis de servir de générateurs. Les électrodes ne sont pas réactives, on parle d'électrode bloquante. Les ions de l'électrolyte s'accumulent aux électrodes à la charge et rétablissent l'électroneutralité lors de la décharge.
Méthodes d’analyse et de mesure
Du fait de leur faible coût, on utilise de plus en plus de capteurs électrochimiques. Le plus simple d’entre eux est l’électrode à pH. Le plus utilisé est le capteur à dioxygène, notamment pour l’analyse des gaz de combustion. Les capteurs électrochimiques ont aussi de nombreuses applications dans le domaine biomédical ou pour l’analyse de la pollution.
L'appareil de mesure le plus utile à l'électrochimie s'appelle le potentiostat ou galvanostat.
La cellule électrochimique la plus courante est la cellule à trois électrodes :
- l'électrode de travail et la contre électrode entre lesquelles passe le courant ;
- l'électrode de référence (ou impolarisable) qui permet d'évaluer la différence de potentiel entre l'électrode de travail et l'électrolyte.
Environnement et biologie
Dans ce domaine en forte expansion, les techniques électrochimiques permettent la séparation (électrodialyse), la récupération, la concentration ou la destruction de certains éléments. Un exemple type d’application est le dessalement des eaux saumâtres par électrodialyse.
Grands concepts en électrochimie
La complexité des phénomènes électrochimiques alliant aux étapes de transfert de charge élémentaire (le départ ou l'arrivée d'un électron, selon que l'on étudie une oxydation ou une réduction) des réactions chimiques de transfert de matière, peut être étudiée de façon analytique et détaillée ou bien de façon globale. Dans la première approche on va s'occuper de chaque étape élémentaire, étudier sa cinétique et son interaction sur les étapes précédentes ou suivantes. Dans la deuxième approche on va étudier les grands équilibres d'une réaction globale, réaliser les bilans énergétiques et thermiques, c'est l'approche thermodynamique.
Thermodynamique électrochimique
La thermodynamique est étroitement liée à l'électrochimie. Le travail fourni par la réaction est ici fourni sous deux formes :
- sous forme de travail mécanique s'il y a un dégagement gazeux lors de la réaction.
Exemple : Zn(s) + 2HCl → ZnCl2 + H2(g) ;
- il est également fourni sous forme de travail électrique dans le cas d'une pile (l'exemple ci-dessus est une pile).
On a alors la relation 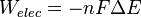 avec n le nombre d'électrons échangés lors de la réaction, F la constante de Faraday et ΔE la force électromotrice de cette pile.
La chaleur échangée lors de cette réaction et notée Q s'exprime par Q = Qp - Wélec avec Qp la quantité de chaleur échangée à pression constante c'est-à-dire quand
avec n le nombre d'électrons échangés lors de la réaction, F la constante de Faraday et ΔE la force électromotrice de cette pile.
La chaleur échangée lors de cette réaction et notée Q s'exprime par Q = Qp - Wélec avec Qp la quantité de chaleur échangée à pression constante c'est-à-dire quand 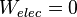 .
.
Cette relation peut être démontrée de la maniée suivante :
Soit une pile de force électromotrice ∆E débitant un courant d'intensité i, tentons de lier ces grandeurs électriques aux grandeurs thermodynamiques.
Partons de la définition de l'enthalpie libre : 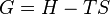 (1)
(1)
Supposons ensuite que la réaction est relativement lente : i faible.
En différenciant (1) :
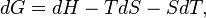
or 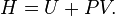
Donc
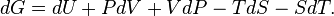
Le premier principe de la thermodynamique donne
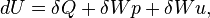
de plus, si la transformation est quasi-statique : 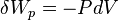
Selon le deuxième principe pour une transformation quasi-statique : 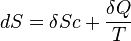
Réinjectons le premier et second principe dans l'expression de dG:
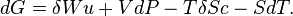
La transformation est supposée isobare et isotherme, dG devient alors :
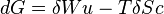
Si, de plus, la transformation est réversible, c'est-à-dire si 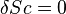 , alors
, alors
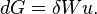
Lorsque la pile débite une intensité 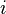 , elle fournit un travail
, elle fournit un travail
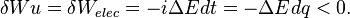
Ainsi, 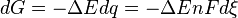 , (d'après la loi de Faraday)
, (d'après la loi de Faraday)
avec (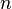 le nombre d'électrons échangés). Par définition,
le nombre d'électrons échangés). Par définition, 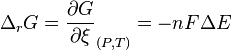 .
.
Finalement 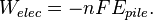
Cinétique électrochimique
Mécanisme de réaction
La méthode la plus rigoureuse pour analyser tous les chemins réactionnels d'une réaction électrochimique couplée à des réactions chimiques est de représenter sur un axe horizontal les réactions électrochimiques élémentaires et sur un axe vertical les réactions chimiques couplées. (Méthode de Jacq).
Analysons par exemple l'oxydation de l'hydroxyde de nickel en milieu aqueux alcalin : il apparaît simplement que se forme par oxydation monoélectronique et perte d'un proton la forme oxy-hydroxy NiOOH à la valence III, puis une autre oxydation avec perte du deuxième proton conduit à l'oxyde de Nickel NiO2 à la valence IV. L'existence de divers chemins réactionnels associés à diverses espèces ioniques intermédiaires peuvent être envisagés ; leur identification demeure très complexe dans ce cas.
Notes et références
- ↑ (en) John Newman et Karen E. Thomas-Aleya, Electrochemical Systems, wiley-interscience, , 647 p. (ISBN 0471477567)
Articles connexes
- Chimie physique
- Métallurgie
- Magnétoélectrochimie
- Électrochimie bipolaire
Liens externes
- Société internationale d’électrochimie (ISE) : http://www.ise-online.org/
- Portail de l’électricité et de l’électronique
- Portail de la chimie