Batterie au plomb
| Batterie au plomb[1],[2] | |
 Batterie d'automobile (12V 40Ah) |
|
| Caractéristiques | |
|---|---|
| Énergie/Poids | 20-40 Wh/kg |
| Énergie/Volume | 40-100 Wh/ℓ |
| Rendement charge-décharge | 50–92[3] % |
| Auto-décharge | 3–20% / mois[4] |
| Durée de vie | min. 4 à 5 ans[5] |
| Nombre de cycles de charge | 500 à 1200 |
| Tension nominale par élément | 2,1 V |
| modifier | |
Une batterie au plomb est un ensemble d'accumulateurs au plomb-acide sulfurique raccordés en série, afin d'obtenir la tension désirée, et réunis dans un même boîtier.
Ce système de « stockage » d'électricité est largement utilisé dans l'industrie, dans l'équipement des véhicules ferroviaires et automobiles (camions compris) mais aussi à chaque fois que l'on a besoin d'une énergie électrique immédiatement disponible (avion, satellite, etc.).
Historique
L'accumulateur au plomb a été inventé en 1859 par le français Gaston Planté. Il a été en effet le premier à avoir mis au point la batterie rechargeable. À l'origine, les accumulateurs étaient situés dans des cuves en verre. Par la suite, on a systématisé l'emploi des cuves en plastique, qui résistent mieux aux chocs.
De nos jours, les batteries sans entretien se généralisent : cosses traitées anti-sulfatage, plaques au plomb-calcium, supprimant le besoin de refaire le niveau de liquide, et donc permettant le scellement.
Les batteries constituent aujourd'hui la principale utilisation du plomb. Cette technique simple et robuste est également très compétitive et reste à ce jour la principale technique pour les batteries de démarrage des véhicules. Ainsi, en 2010, les batteries au plomb représentaient plus de 99 % en tonnage des batteries utilisées dans l’automobile[6].
Caractéristiques techniques
Une batterie au plomb se caractérise essentiellement par :
- La tension nominale qui dépend du nombre d'éléments, la tension nominale U est égale au nombre d'éléments multiplié par 2,1 V. Généralement on considère qu'un accumulateur au plomb est déchargé lorsqu'il atteint la tension de 1,8 V par élément, donc une batterie de 6 éléments ou 12 V est déchargée, lorsqu'elle atteint la tension de 10,8 V).
- La capacité de stockage, notée Q, représente la quantité d'énergie disponible (ne pas confondre avec la capacité électrique). Elle s'exprime en ampère-heure.
- Le courant maximal qu'elle peut fournir pendant quelques instants, ou courant de crête en ampères CCA (jusqu'à une température de 0°F soit -17,78°C).
Les valeurs maximales sont données par le constructeur pour une batterie neuve et chargée à 100 %, elles varient sensiblement en fonction de l'état de charge, se dégradent en fonction du temps ainsi que de l'usage qui est fait de la batterie.
- Les réactions électrochimiques aux électrodes sont les suivantes :
Anode (oxydation) :
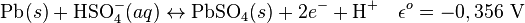
Cathode (réduction) :
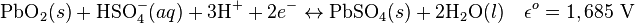
Performances
La batterie au plomb est celle qui a la plus faible énergie massique 35 Wh/kg, après la batterie Nickel-Fer. Mais comme elle est capable de fournir un courant crête de grande intensité, utile pour le démarrage électrique des moteurs à combustion interne, elle est encore très utilisée en particulier dans les véhicules automobiles et dans la plupart des véhicules ferroviaires. Elle présente aussi l'avantage de ne pas être sensible à l'effet mémoire.
Utilisation
Cette batterie sert à alimenter les composants électriques des véhicules à moteur à combustion interne, particulièrement le démarreur électrique. Lorsque le moteur fonctionne, elle est rechargée par une dynamo ou un alternateur.
Historiquement, les batteries de voitures ou de motocyclettes faisaient le plus souvent 6 volts (3 éléments). À l'époque moderne (1987), les batteries de 12 volts (6 éléments) sont généralisées sur les voitures et motocyclettes, alors que les véhicules lourds ou militaires utilisent le 24 volts et finalement, les engins ferroviaires utilisent des groupes allant de 72 volts en France à 110V dans la plupart des autres pays européens.
Les batteries au plomb servent aussi à alimenter toutes sortes d'engins électriques. En 2012, les voitures électriques (autonomie de 60 à 502 km[7]) sont moins nombreuses que les voitures à explosion (autonomie de 600 à 2536 km[8]).
Ces batteries servent également à alimenter les équipements de sécurité et de mise en service ainsi que les éclairages de secours dans la plupart des trains. Elles sont principalement montées en groupes de six batteries de 12 volts pour produire 72 volts et sont redondantes en cas de panne d'un des deux groupes.
Ces batteries peuvent aussi servir à stocker de l'énergie produite par intermittence, comme l'énergie solaire ou éolienne.
Charge
On charge une batterie au plomb en lui appliquant un courant continu d'une valeur quelconque (sous réserve de limites technologiques liées à la batterie elle-même ou à ses connexions), pourvu qu'elle n'entraîne pas aux bornes de la batterie l'apparition d'une tension supérieure à 2,35 à 2,40 V/élément (valeur à 25 °C)[réf. nécessaire].
L'application de cette règle conduit à constater dans la pratique deux phases de charge successives :
- 1/ La phase dite CC (Constant Current ou Courant Constant) au cours de laquelle la tension par élément est inférieure à 2,35 V malgré l'application du courant maximum dont est capable le chargeur : le courant est déterminé par le chargeur, et la tension par la batterie. La tension aux bornes de chaque élément augmente au fur et à mesure que la batterie se recharge.
- 2/ La phase dite CV (Constant Voltage ou TC Tension Constante), dite aussi « phase d'absorption » commence dès que la tension par élément atteint la valeur de 2,35 V/élément puisque l'application de la consigne ci-dessus conduit le chargeur (son système asservi le transformant en un générateur de tension) à ajuster le courant de telle sorte que la tension reste égale à 2,35 V/élément alors que la batterie continue de se charger. Le courant au cours de cette phase est donc une fonction décroissante du temps. Il tend théoriquement vers 0 asymptotiquement.
En fin de charge le courant en phase CV ne s'annule pas. Il se stabilise à une valeur faible mais non nulle qui n'accroît plus l'état de charge mais électrolyse l'eau de l'électrolyte. On préconise donc d'interrompre la charge, ou, si l'on veut appliquer une charge permanente (dite d'entretien ou de "floating", afin de compenser le phénomène d'autodécharge), de baisser la tension de consigne à une valeur de l'ordre de 2,3 V/élément.
La charge CC/CV s'est généralisée car elle seule permet de charger à fort courant (donc rapidement) sans endommager la batterie. Ce mode de charge est utilisé dans toutes les automobiles : en phase CC, le courant de charge dépend essentiellement de la vitesse de rotation de l'alternateur (et donc du moteur). En phase CV, la tension de consigne est maintenue par l'asservissement que constitue le régulateur de tension. Celui-ci diminue en effet le courant d'excitation de l'alternateur, de façon que le courant de sortie de l'alternateur n'ait jamais pour résultat une tension supérieure à 2,35 V/élément (avec une légère correction en fonction de la température).
Lorsque dans le cas des chargeurs bon marché, on ne dispose pas d'un chargeur capable de limiter sa tension à la valeur de consigne correspondant à 2,35 V/élément, on recommande de limiter le courant de charge à par exemple 10 % de la capacité de la batterie, afin de minimiser les conséquences dommageables du dépassement de tension qui risque de se produire en fin de charge (ainsi que les conséquences néfastes pour la durée de vie des électrodes pendant la charge ?).
La tension de 2,34 volts par élément est appelée « Vgaz ». Elle correspond à la tension à laquelle l'électrolyte sous forme liquide, s'électrolyse (2 H2 + O2).
Une batterie ne doit jamais être déchargée à plus de 80 % de sa capacité nominale. La tension n'est pas une référence fiable dans le temps, puisque plus la batterie est âgée, plus la tension a tendance à baisser.
Causes de dégradation
Les principales causes de dégradation des batteries sont :
- la décharge complète
- le cyclage (nombre de cycles complets de charge décharge)
- l'oxydation des électrodes
- l'oxydation des bornes
La sulfatation
La sulfatation représente l'accumulation de sulfate de plomb sur les électrodes. Ce phénomène apparait naturellement à chaque décharge de la batterie, et disparait lors d'une recharge. Cependant sous certaines conditions (décharge prolongée ou trop profonde, température importante, gazéification de l'électrolyte), des ilots stables de sulfate de plomb apparaissent et ne sont plus dissous lors de la charge. Le sulfate de plomb ainsi généré diminue la capacité de la batterie en empêchant les réactions sur l'électrode de par sa faible conductivité électrique[9].
Le processus de sulfatation est interrompu dès que la batterie est remise en charge.
Exemple : une batterie sulfatée de 1000 CCA à l'état neuf, mais contrôlée à 12 V et avec une puissance de 500 CCA, reprendra après recharge une tension supérieure ou égale à 12,6 V mais la puissance mesurée de 500 CCA évoluera peu. Une batterie dans cet état ne permettra pas plusieurs démarrages consécutifs d'un véhicule automobile et pourra provoquer, par exemple, une panne immobilisante dès les premiers froids.
Désulfatation
Il existe un moyen d'inverser le processus de sulfatation d'une batterie. Cela consiste en l'envoi d'impulsions électriques à la fréquence de résonance de la batterie (entre 2 et 6 MHz). Durant ce processus, les ions de soufre entrent en collision avec les plaques, ce qui a pour effet de dissoudre le sulfate de plomb qui les recouvre[10],[11].
La décharge complète
Pour un véhicule automobile, la décharge complète de la batterie intervient généralement par une faible consommation pendant une durée prolongée (exemple : plafonniers) ou par une consommation importante (ex feux de croisement, ventilation), moteur à l'arrêt. La tension est alors très faible aux bornes de la batterie, inférieure à 10 volts pour une batterie dont la tension nominale est de 12 V.
La batterie a besoin de se recharger assez fréquemment afin d'éviter de s'abimer par la décharge complète et aussi pour pouvoir démarrer le moteur. En effet, elle se décharge dans le temps, sans l'utilisation du véhicule et essentiellement lors du démarrage du moteur. La décharge est d'autant plus importante que la température est basse (en cas de grand froid, on voit souvent des véhicules ne pouvant pas démarrer). Des « chargeurs d'entretien de batteries » sont utiles, par exemple quand le moteur du véhicule fonctionne une fois par mois.
La plupart des batteries neuves ne sont que préchargées.
Une batterie neuve, qui n'est pas rechargée au préalable avec un chargeur adapté, peut être amenée en décharge complète si le véhicule n'est pas utilisé pour recharger la batterie (avec un nombre suffisant de kilomètres).
Par exemple en 1985 :
- Les batteries se rechargent avec le moteur en fonctionnement et l'alternateur, que la voiture soit à l'arrêt ou en mouvement.
- Installation de la batterie (sans recharge), démarrage (pour test), suivi d'un long stationnement... décharge complète.
- Installation de la batterie (sans recharge), démarrage suivi d'un nombre de kilomètres limité (la batterie n'est donc pas suffisamment rechargée), stationnement, démarrage suivi de nouveau d'un nombre de kilomètres limité... ainsi de suite jusqu'à décharge complète.
Les batteries en état de décharge complète doivent être rechargées dans un délai maximum de 48 heures : au-delà, les dommages sont irréversibles (sauf par désulfatation)[réf. nécessaire].
Cyclage
Les constructeurs de batteries indiquent leur durée de vie sous la forme d'un nombre de cycles normalisés de décharge/recharge.
À l'issue d'un certain temps de fonctionnement dépendant du nombre et de l'amplitude des cycles, la batterie est usée : l'électrolyte présente un aspect noirâtre.
Exemple : l'utilisation répétée du hayon élévateur motorisé d'un camion quand son moteur est à l'arrêt accélère l'usure de la batterie du véhicule par cyclage.
Oxydation des électrodes
L'oxydation est une cause de dysfonctionnement des batteries. Lorsque le niveau d'électrolyte est trop bas, les plaques entrent au contact de l'air et s'oxydent. La puissance au démarrage est amputée, même si le niveau d'électrolyte est complété. Le manque d'électrolyte peut venir d'une utilisation intensive (exemple : équipements auxiliaires, etc), d'une température extérieure importante (supérieure ou égale à 30 °C) ou d'une tension de charge trop élevée.
Oxydation des bornes
Il arrive qu'une batterie dont les cosses sont peu ou pas serrées voie ses bornes s'oxyder, ce qui empêche le courant de passer.
Régénération de batterie
Les batteries plomb ouvert (chariots élévateur, nacelles etc) ont une durée de vie limitée à environ 1 500 cycles. Lors du stockage et de la restitution de l'énergie au cours de cycles d'utilisation normaux, des cristaux de sulfate s'accumulent graduellement sur les électrodes, empêchant la batterie de fournir efficacement du courant. Les cristaux "étouffent" en fait la batterie. Même une charge de désulfatation n'empêche pas toujours que l'on doive remplacer la batterie après quelques années.
Une entreprise française a breveté un procédé de régénération : le procédé Phoenix. Les batteries subissent un traitement qui consiste à injecter dans celles-ci des fréquences séquentielles variables et modulables pendant un certain nombre d'heures (en fonction de l'état et de la puissance de la batterie). L'effet de ce traitement est de dissoudre les cristaux et les impuretés qui se sont déposés sur les plaques intérieures de la batterie. Les batteries ainsi traitées, recouvrent des fonctions d'emmagasinage et de conductivité électrique proches de celles d'une batterie neuve. Ce procédé est valable sur des batteries au plomb de type démarrage, stationnaire ou de traction.
Selon des estimations récentes, environ 80 % des batteries au plomb hors d'usage peuvent être régénérées. Il est cependant impossible de restaurer la plaque positive après 4 ou 5 ans d'utilisation normale d'une batterie. En conséquence une batterie de quelques mois peut effectivement être régénérée et l'on peut atteindre le taux de 80 % de remise en état de fonctionner, plus sa durée d'utilisation augmente dans le temps et moins cela est possible (la dégradation naturelle, due à la montée en température de la batterie, est inévitable).
Recyclage
Le recyclage des batteries au plomb est rendu complexe par la présence de matériaux très différents (plomb métallique, pâte de plomb, solution d’acide sulfurique, polypropylène) et par la dangerosité de certains de ces composants. Ce recyclage s’effectue le plus souvent en quatre étapes :
- Broyage des batteries,
- Séparation des divers éléments,
- Fusion-réduction des pâtes de plomb et du plomb métallique afin d’obtenir du plomb métallique brut non affiné,
- Affinage du plomb métallique et addition d’autres métaux pour obtenir des alliages de compositions bien définies.
Le plomb affiné est ensuite vendu sous la forme de lingots ou de blocs. Une fois lavé, le polypropylène broyé est vendu à des recycleurs de matières plastiques. Le recyclage du plomb ainsi obtenu permet ensuite d’alimenter de nouveau les usines de fabrication de batteries. On estime d’ailleurs au niveau mondial qu’en 2011, 55 % de la production de plomb affiné est issue de plomb recyclé[12].
La capacité de traitement des usines françaises spécialisées dans cette activité est en adéquation avec le gisement de batteries usagées collectées chaque année en France. Le taux de collecte de la filière est d’ailleurs régulièrement supérieur à 100 % comme le révèle le rapport annuel de l’ADEME. En outre, les performances de cette filière de recyclage répondent bien au minimum de recyclage de 65 % en poids qui est fixé réglementairement [13]. Les entreprises françaises spécialisées dans le recyclage des batteries au plomb sont également strictement encadrées par la législation et font l’objet de contrôles réguliers de la part des Directions Régionales de l’Environnement, de l’Aménagement et du Logement (DREAL).
Aspects environnementaux et santé humaine
S’il est ingéré ou respiré, le plomb peut être la cause d’intoxications aigües ou chroniques. Il peut être à l’origine de cas de saturnisme. Une bonne maîtrise des risques présentés par les batteries au plomb usagées est donc indispensable et, parce qu’il s’agit d’un déchet dangereux pour la santé et pour l’environnement, ces batteries doivent être collectées et retraitées par des sociétés spécialisées. Afin de prévenir les risques de pollution, les entreprises françaises ont l’obligation de mettre en place des procédés conformes aux meilleures techniques disponibles[14] et font l’objet de contrôles stricts et réguliers. Elles doivent également garantir un niveau élevé de protection de leurs salariés. Cette protection passe par la formation aux risques liés au plomb et par l’utilisation systématique d’équipements de protection collective et individuelle. L’efficacité de ces mesures est régulièrement vérifiée par la mesure de la plombémie des salariés.
Un démantèlement réalisé dans de mauvaises conditions peut engendrer des décès et une pollution durable. C’est ce qu’a mis en évidence l’Organisation mondiale de la santé dans un quartier de Thiaroye-sur-mer (Sénégal) où une activité clandestine de recyclage s’était mise en place pour alimenter un marché parallèle de batteries[15]. Dans ce quartier, des analyses ont révélé des taux de plomb allant jusqu’à 1 000 μg/L de sang chez certaines personnes, alors que des concentrations supérieures à 100 μg/L peuvent altérer le développement neurologique chez l’enfant.
Notes et références
- ↑ Yuasa - Spécifications électriques de la famille NP, sur le site yuasa.fr
- ↑ Spécifications électriques de la famille SWL, sur le site yuasa.fr
- ↑ [PDF]+(en) A study of lead acide battery efficiancy, sur le site osti.gov
- ↑ (en) Generic battery technology comparison, sur le site madkatz.com, consulté le 6 juin 2013
- ↑ La batterie, en tant qu’accumulateur, est le nerf vital de toute voiture, sur le site agvs.ch du 28 septembre 2012
- ↑ Rapport annuel du registre des piles et accumulateurs 2011, sur le site ademe.fr
- ↑ Tesla S autonomie maximum NEDC teslamotors.com consulté février 2015
- ↑ 2 536,4 kilomètres avec un seul plein de diesel larevueautomobile.com 14 juin 2012
- ↑ site personnel du professeur Ernest Matagne (2004)
- ↑ [PDF]Plus d'informations sur la désulfatation par impulsions électriques ainsi que des instructions pour réaliser un dispositif de désulfatage, sur le site alton-moore.net
- ↑ (en)[PDF]Do you want to extend the life of your lead-acid batteries?, Department of the Navy - Environmental Program - 6 août 2002
- ↑ (en) Lead and Zinc Statistics, sur le site ilzsg.org - consulté le 24 octobre 2012
- ↑ décret n° 2009-1139, transposant la directive européenne 2006/66/CE, sur le site legifrance.gouv.fr - consulté le 24 octobre 2012
- ↑ [PDF] BREF Métaux non ferreux, sur le site eippcb.jrc.es
- ↑ Saturnisme au Sénégal, sur le site who.int du 23 juin 2008 - consulté le 23 octobre 2012
Voir aussi
Articles connexes
- Chargeur (électricité)
- Plomb
- Plombémie
- Saturnisme
- Sécurité sanitaire
- Santé au travail
- Santé environnementale
Liens externes
- Ressources sur les batteries au plomb des installations photovoltaïques autonomes
- Expérience pour enfants en images
- Batterie d'accumulateurs au plomb
- Animation en Flash
- Site d'information sur les batteries
- Portail de la chimie
- Portail de l’électricité et de l’électronique
- Portail de l’énergie
