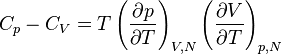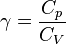Capacité thermique massique
La capacité thermique massique (symbole c ou s), anciennement appelée chaleur massique ou chaleur spécifique[1] , est déterminée par la quantité d'énergie à apporter par échange thermique pour élever d'un kelvin la température de l'unité de masse d'une substance. C'est donc une grandeur intensive égale à la capacité thermique rapportée à la masse du corps étudié.
L'unité du système international est alors le joule par kilogramme-kelvin (J·kg-1·K-1). La détermination des valeurs des capacités thermiques des substances relève de la calorimétrie.
Suivant le type de transformation thermodynamique, on considère soit l'énergie interne massique, soit l'enthalpie massique. Si on note U l'énergie interne, H l'enthalpie et m la masse d'un corps on a donc les capacités thermiques massiques :
- à volume constant :
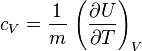 ;
; - à pression constante :
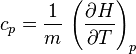 .
.
La différence entre la chaleur spécifique à pression constante 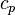 et la chaleur spécifique à volume constant
et la chaleur spécifique à volume constant 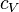 est liée au travail qui doit être fourni pour dilater le corps en présence d'une pression externe. Si elle est souvent négligeable pour les phases condensées réputées peu compressibles et peu dilatables (liquides ou solides) la différence entre
est liée au travail qui doit être fourni pour dilater le corps en présence d'une pression externe. Si elle est souvent négligeable pour les phases condensées réputées peu compressibles et peu dilatables (liquides ou solides) la différence entre 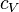 et
et 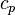 est importante pour les gaz.
est importante pour les gaz.
La capacité thermique volumique exprimée en Joule par mètre cube-kelvin est égale à la capacité thermique massique multipliée par la masse volumique.
Cas des gaz parfaits
D'après la théorie cinétique des gaz, l'énergie interne d'une mole de gaz parfait monoatomique est égale à (3/2)RT, et plus élevée pour les gaz dont les molécules sont polyatomiques ; par exemple, (5/2)RT pour un gaz diatomique. Le calcul théorique n'est plus possible pour les molécules complexes.
La capacité massique à volume constant est ainsi de :
-
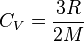 pour un gaz parfait monoatomique ;
pour un gaz parfait monoatomique ;
-
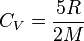 pour un gaz parfait diatomique, lorsque sa température
pour un gaz parfait diatomique, lorsque sa température 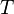 vérifie
vérifie 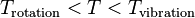 . En effet si
. En effet si 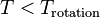 on aura
on aura 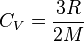 (son comportement sera celui d'un gaz monoatomique), et si
(son comportement sera celui d'un gaz monoatomique), et si 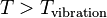 on aura
on aura 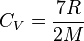 pour un gaz diatomique.
pour un gaz diatomique.
La capacité massique à pression constante d'un gaz parfait peut être déterminée à partir de la capacité massique à volume constant, puisque l'équation des gaz parfaits exprime que :
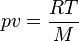 , et donc :
, et donc : 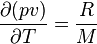
p étant la pression, v le volume massique[2], R la constante molaire des gaz[3], et M la masse molaire du gaz considéré.
La différence théorique entre ces deux valeurs donne alors la relation de Mayer :
où p, V, N et T sont respectivement la pression, le volume, le nombre de particules et la température du système considéré ;
soit :
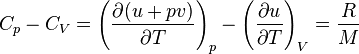 , u (l'énergie interne) ne dépendant que de la température.
, u (l'énergie interne) ne dépendant que de la température.
Le rapport des deux capacités d'un gaz est important en thermodynamique ; il est noté gamma :
Sa valeur dépend de la nature du gaz considéré ; pour un gaz parfait, la valeur théorique de γ est :
- γ = 5/3= 1,67 pour un gaz monoatomique (1/(γ-1)=3/2=1,5) ;
- γ = 7/5= 1,4 pour un gaz diatomique (1/(γ-1)=5/2=2,5).
| Gaz | Masse molaire (kg/mol) |
température (°C) |
cp capacité massique J/(kg.K) |
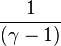 |
|---|---|---|---|---|
| Air | 29×10-3 | 0-100 | 1004 | 2,48 |
| Argon | 39,948×10-3 | 15 | 520 | 1,54 |
| Diazote | 28,013×10-3 | 0-200 | 1025 | 2,46 |
| Dioxyde de carbone | 44,01×10-3 | 20 | 650 | 3,44 |
| Hélium | 4,003×10-3 | 18 | 3160 | 1,52 |
| Dihydrogène | 2,016×10-3 | 16 | 10140 | 2,46 |
| Dioxygène | 31,999×10-3 | 13-207 | 920 | 2,50 |
| Vapeur d'eau | 18,015×10-3 | 100 | 2010 | 3.65 |
D'une manière générale pour les gaz parfaits, on a les capacités thermiques molaires [J/mol/K] suivantes : 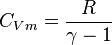 et
et 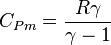
Cas des solides
Valeurs courantes
| Substance
(phase solide) |
Capacité thermique
massique J·kg-1·K-1 |
|---|---|
| Asphalte | 1021 |
| Brique | 840 |
| Béton | 880 |
| Granite | 790 |
| Gypse | 1090 |
| Marbre | 880 |
| Sable | 835 |
| Verre | 720[4] |
| Bois | ≈ 1200-2700[5],[6] |
Cas des solides cristallisés
Dans le cas des solides, à suffisamment haute température, la loi de Dulong et Petit est applicable et permet notamment de retrouver que, à basse température, 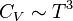 du fait de la contribution des phonons. Si le solide est un métal, il faut ajouter la contribution des électrons qui est proportionnelle à la température.
du fait de la contribution des phonons. Si le solide est un métal, il faut ajouter la contribution des électrons qui est proportionnelle à la température.
Les coefficients de dilatation des corps solides et liquides sont généralement suffisamment faibles pour qu'on néglige la différence entre Cp et CV pour la plupart des applications.
| Substance |  (K) (K) |
|---|---|
| Al | 398 |
| C (diamant) | 1860 |
| Cu | 315 |
| Fe | 420 |
| K | 99 |
| Pb | 88 |
Suivant la théorie de Debye, la capacité thermique molaire d'un corps simple solide peut être déterminée au moyen de la formule :
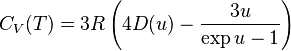
avec 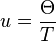 ,
,
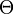 est la température de Debye, qui est une caractéristique de chaque substance,
est la température de Debye, qui est une caractéristique de chaque substance,
R est la constante molaire des gaz[3],
et 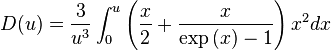 .
.
Cette formule se simplifie à basse température, ainsi qu'à haute température ; dans ce dernier cas, nous retrouvons la loi de Dulong et Petit :
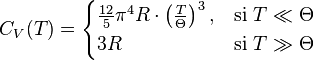
La théorie n'est plus valable pour les corps composés.
Formules empiriques
Pour des corps purs (solides, liquides ou gazeux) et à pression constante, 2 formules empiriques à 3 paramètres ont pu être dégagées, pour un intervalle de température donné :
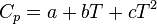 ou bien
ou bien 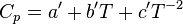 .
.
Les valeurs des coefficients sont indiqués dans des tables et sont caractéristiques d'un corps donné.
Pour le bois sec, par exemple, on a[6] :
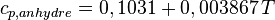
avec :
-
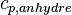 : exprimé en kJ·kg–1·K–1
: exprimé en kJ·kg–1·K–1 - T : température thermodynamique (K).
À 20 °C, on obtient 1236 J/kg.K pour le bois sec.
Pour le bois humide[6] :
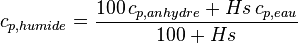
où Hs est la masse d'eau rapportée à la masse du bois sec en %.
Mesure de la capacité thermique massique d'un solide
La capacité thermique massique d'un solide peut être mesurée en utilisant un appareil de type ATD (analyse thermodifférentielle, ou DSC pour differential scanning calorimetry). Elle peut se définir de la façon suivante : quand un système passe de la température T à une température T+dT, la variation d’énergie interne du système dU est liée à la quantité de chaleur échangée δQ selon :
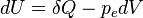
avec pe la pression extérieure à laquelle est soumis le système et dV la variation de volume. Si V=Cte:
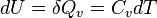
En revanche, si la transformation est isobare (pression constante), on obtient en utilisant la fonction enthalpie du système, la relation :
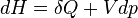
Si P= cte
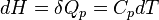
avec Cp la capacité à pression constante. La mesure consiste donc à mesurer la différence de température créée par un échange thermique donné, ou le flux d'énergie se traduit par une différence de température.
Le schéma suivant illustre la technique instrumentale utilisée dans le cas de la première méthode (mesure de la différence de température).

L’appareil est constitué de deux « plots » indépendants et d’un four. Des thermocouples permettent de mesurer la température de la face supérieure des plots en contact avec l’échantillon, ainsi que la température du four. Celle-ci correspond à la température de mesure. Toutes les mesures sont effectuées en utilisant un porte-échantillon d’aluminium vide sur l’un des plots. Une première mesure d’un autre porte-échantillon d’aluminium vide permet d’obtenir une ligne de base (dépendant de la mesure de température par les thermocouples). Puis une mesure d’un échantillon de référence de chaleur massique connue permet d’étalonner l’appareil. Enfin, l’échantillon sous forme de poudre est mesuré et sa chaleur massique est obtenue par comparaison avec celle de l’échantillon de référence. Pour améliorer la précisions de la mesure, il convient de prendre en compte le cas échéant la différence de masse entre les deux porte échantillons (la correction s'effectue en utilisant la chaleur massique de l'aluminium). La source d’erreur principale provient de la qualité du contact thermique entre le plot et le porte-échantillon.
Valeurs pour différentes substances
| Substance | v wcv | Phase | Capacité thermique massique J·kg-1·K-1 |
|---|---|---|---|
| dv | v | gaz | 1005 |
| Air (saturé en vapeur d'eau) | gaz | ≈ 1030 | |
| Aluminium | dcv | solide | 897 |
| Azote | dv | 1042 | |
| Cuivre | cv | solide | 385 |
| Diamant | d | solide | 502 |
| Eau | gaz | 1850 | |
| ws | liquide | 4185 | |
| solide (0 °C) | 2060 | ||
| Éthanol | liquide | 2460 | |
| Fer | solide | 444 | |
| Graphite | solide | 720 | |
| Hélium | gaz | 3160 | |
| Hexane | liquide | ≈ 2267.95 | |
| Huile | liquide | ≈ 2000 | |
| Hydrogène | gaz | 14300 | |
| Laiton | solide | 377 | |
| Lithium | solide | 3582 | |
| Mercure | liquide | 139 | |
| Octane | liquide | ≈ 1393.33 | |
| Or | solide | 129 | |
| Dioxygène | gaz | 920 | |
| Zinc | solide | 380 |
Notes
- ↑ On rencontre parfois le terme spécifique, dans le même sens que massique. C'est un calque de l'anglais specific heat désignant le terme français chaleur massique
- ↑ Le volume massique est la grandeur inverse de la masse volumique.
- 1 2 R = 8,314 4 J/K/mol.
- ↑ http://www.verreonline.fr/v_plat/prop_therm1.php
- ↑ Eugène Péclet, Traité de la chaleur, considérée dans ses applications, D. Avanzo et Ce, , 420 p. (lire en ligne), p. 17Les valeurs indiquées sont en calorie/kg/°C.
- 1 2 3 « Bois énergie », Techniques de l'ingénieur, 10 juillet 2004, réf BE 8535.
Voir aussi
- Loi de Joule
- Capacité thermique
- Capacité thermique volumique
Bibliographie
- J. Boutigny, Thermodynamique, Vuibert.
- Lev Landau et Evguéni Lifchitz, Physique théorique, tome 5 : Physique statistique [détail des éditions]
- Charles Kittel (trad. Nathalie Bardou, Évelyne Kolb), Physique de l’état solide [« Solid state physics »], [détail des éditions]
- Portail de la physique
- Portail de la chimie
- Portail de l’énergie
- Portail des sciences des matériaux