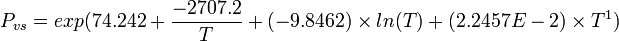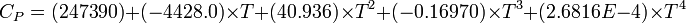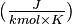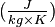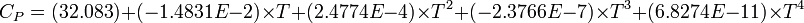Éthylène
| Éthylène | |||||
|---|---|---|---|---|---|
  | |||||
| Formule brute et représentation 3D de l'éthylène | |||||
| Identification | |||||
| Synonymes | éthène | ||||
| No CAS | |||||
| No EINECS | |||||
| SMILES | |||||
| InChI | |||||
| Apparence | gaz comprimé incolore, d'odeur caractéristique[1]. | ||||
| Propriétés chimiques | |||||
| Formule brute | C2H4 [Isomères] | ||||
| Masse molaire[2] | 28,0532 ± 0,0019 g/mol C 85,63 %, H 14,37 %, | ||||
| Propriétés physiques | |||||
| T° fusion | −169,2 °C[1] | ||||
| T° ébullition | −103,9 °C [3] | ||||
| Solubilité | dans l'eau : nulle[1] | ||||
| Masse volumique | |||||
| T° d'auto-inflammation | 490 °C[1] | ||||
| Point d’éclair | gaz inflammable[1] | ||||
| Limites d’explosivité dans l’air | 2,7–36,0 %vol[1] | ||||
| Pression de vapeur saturante | à 15 °C : 8 100 kPa[1]
| ||||
| Point critique | 5 060 kPa [5], 9,19 °C [3] | ||||
| Vitesse du son | 1 309 m·s-1 (liquide,−103,8 °C) 331 m·s-1 (gaz,−103,8 °C,1 atm)[6] | ||||
| Thermochimie | |||||
| ΔfH0gaz | 52,38 kJ·mol-1 [7] | ||||
| Cp | |||||
| Propriétés électroniques | |||||
| 1re énergie d'ionisation | 10,5138 eV ± 0,0006 (gaz)[9] | ||||
| Cristallographie | |||||
| Classe cristalline ou groupe d’espace | P21/n [10] | ||||
| Paramètres de maille | a = 4,626 Å b = 6,620 Å | ||||
| Volume | 124,18 Å3 [10] | ||||
| Densité théorique | 0,750 [10] | ||||
| Précautions | |||||
 F+ Phrases R : 12, 67, Phrases S : (2), 9, 16, 33, 46,
| |||||
   A, B1, D2B, | |||||
   Danger | |||||
| Groupe 3 : Inclassable quant à sa cancérogénicité pour l'Homme[13] | |||||
| Écotoxicologie | |||||
| Seuil de l’odorat | bas : 17 ppm haut : 959 ppm[14] | ||||
L'éthylène, ou, selon la nomenclature de l'IUPAC, éthène, est un hydrocarbure insaturé. On peut aussi le trouver sous l'appellation R1150.
Chimie
Propriétés physiques
L'éthylène est le plus simple des alcènes.
| - brute : | C2H4 |
| - semi-développée : | CH2=CH2 |
| - développée : |  |
| - représenté généralement par une double liaison : |
C'est un gaz incolore, volatil, de densité proche de l'air avec lequel il forme des mélanges explosifs.
À partir de 425 °C, il s'enflamme et brûle avec une flamme claire ; chaleur de combustion : 47 200 kJ/kg.
Propriétés chimiques
C'est un gaz très réactif.
- Hydratation
L'éthylène peut être hydraté en éthanol par addition d'une molécule d'eau en milieu acide.
- H2C=CH2 + H2O ⇒ H3C-CH2OH
- Halogénation
Par halogénation, l'éthylène conduit au dibromoéthane.
- H2C=CH2 + Br2 ⇒ BrH2C-CH2Br
- Hydroxylation
L'éthylène est hydroxylé en 1,2-éthanediol (glycol) en présence de catalyseurs.
- Polymérisation
La polymérisation de l'éthylène en polyéthylène basse densité s'effectue par un polymérisation radicalaire à haute pression. Quant à la production de polyéthylène haute densité, ou basse densité linéaire, elle est possible grâce à la polymérisation coordinative en utilisant des catalyseurs type Ziegler-Natta, métallocène ou post-métallocène.
Production et synthèse
La production globale d´éthylène a été de 138 millions de tonnes en 2010 et 141 millions de tonnes en 2011. L´Europe de l´ouest en a produit 25 millions de tonnes en 2011 ; dont 2,46 millions de tonnes en Belgique ; 3,37 millions de tonnes en France ; 5,74 millions de tonnes en Allemagne ; 2,17 millions de tonnes en Italie ; 3,96 millions de tonnes aux Pays-Bas ; 1,43 millions de tonnes en Espagne et 2,85 millions de tonnes au Royaume-Uni[15].
Dans l'industrie pétrochimique, l'éthylène est obtenu :
- à partir de gaz naturel riche en éthane (USA) par pyrolyse ou craquage à température élevée. Dans ce procédé, la proportion d'éthylène dans le mélange gazeux résultant est environ 45 %.
- à partir du naphta provenant de la distillation fractionnée du pétrole (Europe) par vapocraquage. La proportion d'éthylène dans le mélange obtenu est d'environ 25 %.
Les principales sociétés fabriquant l'éthylène sont la Sabic, Dow Chemical, ExxonMobil Chemical, Royal Dutch Shell, Sinopec et Total[16]. Technip est le leader mondial de la conception d’unités de production d’éthylène, de la conception à la construction et la mise en service[17].
Les sous-produits gazeux obtenus sont : le dihydrogène, le méthane, l'acétylène, l'éthane, le propadiène, le propène. Ces gaz sont ensuite séparés.
Utilisation
L'éthylène est à la base d'un grand nombre de molécules dans l'industrie chimique. Avec ses dérivés immédiats, il est à la source d'un grand nombre de polymères et de matières plastiques.
Les produits issus de l'éthylène sont entre autres : le chlorure de vinyle, l'éthylbenzène, l'oxyde d'éthylène, l'éthanol (ou alcool éthylique),
Le monomère peut être utilisé directement pour produire du polyéthylène.
Le chlorure de vinyle est polymérisé en polychlorure de vinyle (PVC), matière plastique bien connue, et l'une des plus anciennes.
L'éthylbenzène donne deux produits : du styrène et du caoutchouc SBR (Styrene-Butadiene-Rubber).
Le styrène est polymérisé en polystyrène, avec lequel on produit du polystyrène expansé ou des matières plastiques.
À partir du caoutchouc SBR, on obtient d'autres copolymères, comme le SBS (Styrene-Butadiene-Styrene).
L'oxyde d'éthylène ((CH2)2O) donne de l'éthylène-glycol, qui lui-même, combiné à l'acide téréphtalique, fournira des fibres polyesters.
L'éthanol peut être utilisé comme simple solvant.
L'oxyde d'éthylène ((CH2)2O) est un produit très instable à cause de «l'insaturation» de sa structure chimique. Il explose immédiatement en présence d'oxygène, c’est-à-dire qu'il cherche à combler le vide atomique de sa structure en captant les atomes d'oxygène de l'air. En 1957, un réacteur pilote d'oxyde d'éthylène a explosé à Anvers (Belgique), faisant plusieurs morts. Le souffle de l'explosion a déplacé un spectromètre de masse (de plus de cent tonnes) de plusieurs dizaines de mètres. L'éthylène-glycol sert également dans la fabrication des antigels.
Le PTFE (Poly-Tétra-Fluor-Éthylène), plus connu sous son nom commercial, le Téflon, est un polymère technique utilisé industriellement dans une grande variété d'applications - il est notamment l'un des meilleurs isolants électriques connus à ce jour, est chimiquement inerte, et a des propriétés tribologiques hors du commun. Il est également connu du grand public comme joint de plomberie ou comme revêtement anti-adhérant pour les poêles de cuisson.
Hormone végétale
C'est aussi une phytohormone (hormone végétale) aux effets multiples.
Histoire
Le rôle d'hormone végétale de l'éthylène a été découvert en 1901 : on remarqua que les feuilles des plantes situées à proximité des lampadaires (à bec de gaz) tombaient prématurément.
En 1910, on s'aperçoit qu'un fruit confiné mûrit plus vite qu'un fruit à l'air libre. On fait alors un premier rapprochement avec l'éthylène. En 1934 on découvre les voies métaboliques de l'éthylène.
Et en 1960, par chromatographie en phase gazeuse, on arrive à doser l'éthylène émis par les plantes.
Biosynthèse

L'éthylène a pour origine la méthionine.
Dans le cycle de Yang la méthionine est transformée en S-adénosylméthionine (SAM) par la SAM Synthétase :
Méthionine + ATP → SAM + PPi + P (SAM Synthétase)
La SAM est ensuite dégradée en 5'méthylthioadénosine (qui est réutilisé par le cycle de Yang) et en acide 1-aminocyclopropane-1-carboxylique (ACC) par l' ACC Synthase. Une partie de l'ACC est ensuite convertie en éthylène (volatil) grâce à l'ACC Oxydase, le reste va se conjuguer avec du N-Malonyl pour donner du N-Malonyl ACC (non volatil) stocké en une réserve métabolique qui pourra être hydrolysée en fonction des besoins de la plante.
Facteurs inducteurs
Le facteur limitant est la production d'ACC (Acide 1-AminoCyclopropane-1-Carboxilique) par l'ACC Synthase. Cette hormone est présente en quantité très faible dans le cytosol, dans les fruits en maturation (au moment où l'éthylène est le plus abondant), elle représente environ 0,0001%. Sa production est régulée par des facteurs environnementaux comme une blessure, le froid, un stress hydrique, une diminution de l'O2 (immersion dans l'eau); ainsi que par des facteurs endogènes : l'auxine ou les cytokinines, mais aussi l'éthylène. Pour cela, la production d'éthylène est un phénomène autocatalytique.
Inhibiteurs
L'AOA (acide aminooxyacétique) et l'AVG (Aminoéthoxyvinyglycine) bloquent le fonctionnement de l'ACC Synthase.
Une absence d'oxygène (anaérobie), des fortes températures (sup. à 35 °C), des ions cobalt Co2+, inhibent le fonctionnement de l'ACC Oxydase.
Le nitrate d'argent AgNO3-, le thiosulfate d'argent Ag(S2O3)2−3 ou un milieu enrichi en CO2, inhibent en aval l'action de l'éthylène.
Le cyclopropène de méthyle (1-MCP) se fixe de façon presque irréversible sur les récepteurs éthylène, qui transmettent alors un signal conduisant à l'inactivité du système de perception, malgré la présence de molécules d'éthylène sur des récepteurs proches.
Effets
L'éthylène module de nombreux métabolismes (réponses des plantes aux stress biotiques et abiotiques), est impliquée dans les étapes de floraison et stimule la maturation de nombreux fruits. Cette molécule a des effets si variés parce qu'elle est très simple et donc peu spécifique.
Maturation des fruits
L'éthylène est un catalyseur essentiel de la maturation des fruits. Par exemple, un avocat ne mûrit pas sur l'arbre mais six à huit jours après la récolte. On observe alors un pic de production d'ACC, puis d'éthylène qui déclenche la maturation du fruit. Un fruit dont la maturation est dépendante de l'éthylène est classé comme fruit climactérique.

La banane produit de l'éthylène pour mûrir. Pour empêcher le murissement, le froid ne suffit pas. Il faut aussi ventiler pour éviter l'accumulation d'éthylène. Quand on veut redémarrer le murissement, il suffit de diffuser de l'éthylène.
On peut ajouter du permanganate de potassium dans les sachets contenant des bananes ou des tomates afin d'oxyder l’éthylène en éthylène glycol ce qui arrête le mûrissement et prolonge la durée de vie des fruits[18],[19],[20].
Sénescence des organes
La sénescence des organes est un processus génétiquement programmé influençant l'âge physiologique des entités vivantes. Un apport exogène d'ACC ou d'éthylène entraîne une sénescence prématurée, alors qu'un apport exogène de cytokinine retarde le processus.
Une augmentation de la production d'éthylène est associée à une perte de chlorophylle des feuilles, une dégradation des protéines et des ARN, une perte de pigmentation des fleurs, et autres symptômes de vieillissement.
Abscission des feuilles
(= chute des feuilles - ou d'autres parties de la plante)
/!\ Ne pas confondre avec l'acide abscissique.
Les cellules des zones nécessitant une abscission répondent spécifiquement à l'éthylène. Une multitude d'enzymes hydrolytiques telles que des pectinases ou des polygalacturonases (qui dégradent l'acide galacturonique) sont alors stimulées, lysent les parois cellulaires et fragilisent la structure du végétal. Le plus souvent un agent extérieur tel que le vent, donne le coup de grâce et fait tomber l'organe.
Les jeunes feuilles produisent de l'auxine qui les insensibilise à l'éthylène. Après le développement de la feuille, la production d'auxine diminue puis s'arrête : les cellules du pétiole sont alors exposées à des concentrations de plus en plus fortes d'éthylène. Au bout d'un certain temps les zones d'abscission répondent par la synthèse d'enzymes hydrolytiques.
De très fortes concentrations d'auxine inhibent la production d'éthylène et donc la chute des feuilles, alors qu'avec de faibles concentrations d'auxine, l'inhibition de la synthèse d'éthylène n'a plus lieu, ce qui permet l'augmentation de la concentration d'éthylène et donc la chute des feuilles
Mouvements d'épinastie
Les racines perçoivent l'inondation par une forte diminution de la concentration en dioxygène dans le milieu. L'anoxie stimule la production de SAM (SAM Synthétase) et entraîne une augmentation de la teneur en ACC car l'ACC Oxydase ne fonctionne pas : elle ne peut pas oxyder sans oxygène ! L'ACC excédentaire des racines finit par se retrouver dans les feuilles pour être transformé en éthylène. C'est cet éthylène qui est responsable des mouvements d'épinastie.
La floraison
Cette hormone inhibe la floraison sauf chez certaines espèces comme la mangue ou l'ananas, chez lesquels on synchronise la floraison des fruits en apportant de l'éthylène sur l'arbre.
L'éthylène peut changer la nature des organes floraux. Chez les espèces monoïques, c'est une hormone féminisante.
L'éthylène comme polluant de l'air
freeportnoaa2000-2006.jpg)

- L'éthylène, en tant que phyto-hormone pourrait avoir des effets altéragènes sur certaines espèces.
- En présence d'ultraviolets solaires, c'est-à-dire de jour, ce gaz est en outre un des précurseurs de l'ozone. L'éthylène étant très réactif et photosensible, sa durée de vie dans l'air est réduite (moins d'une heure à midi à la latitude du Texas). Il a donc longtemps été peu étudié et peu suivi en tant que polluant. Puis on a constaté qu'il pouvait persister bien plus longtemps la nuit[21]. Des instruments ont été récemment développés pour des mesures en temps réel des panaches d'éthylène. Une étude (TexAQS2000) faite par NOAA au Texas a étudié des panaches d'éthylène générés par l'industrie chimique (de Freeport).
- Elle a d'abord montré que les émissions industrielles avaient été très fortement sous-estimées dans les inventaires conduits par l'État du Texas sur la base des déclarations des industriels.
- Elle a aussi montré que des taux très supérieur à la normale d'éthylène était encore présents sous le vent de ces sources, à grande distance (dizaines à centaines de km), la nuit notamment. Les auteurs de cette étude ont conclu qu'en conséquence, la production d'ozone troposphérique à partir de certains panaches industriels (contenant de l'éthylène) avait été sous-estimée par les modèles[21].
Notes et références
- 1 2 3 4 5 6 7 ETHYLENE, fiche de sécurité du Programme International sur la Sécurité des Substances Chimiques, consultée le 9 mai 2009
- ↑ Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- 1 2 (en) Iwona Owczarek et Krystyna Blazej, « Recommended Critical Temperatures. Part I. Aliphatic Hydrocarbons », J. Phys. Chem. Ref. Data, vol. 32, no 4, , p. 1411 (DOI 10.1063/1.1556431)
- 1 2 3 (en) Robert H. Perry et Donald W. Green, Perry's Chemical Engineers' Handbook, USA, McGraw-Hill, , 7e éd., 2400 p. (ISBN 0-07-049841-5), p. 2-50
- ↑ (en) Iwona Owczarek et Krystyna Blazej, « Recommended Critical Pressures. Part I. Aliphatic Hydrocarbons », J. Phys. Chem. Ref. Data, vol. 35, no 4, , p. 1461 (DOI 10.1063/1.2201061)
- ↑ (en) William M. Haynes, CRC Handbook of Chemistry and Physics, Boca Raton, CRC Press/Taylor and Francis, , 91e éd., 2610 p. (ISBN 9781439820773, présentation en ligne), p. 14-40
- ↑ (en) Irvin Glassman, Richard A. Yetter, Combustion, Elsevier, , 4e éd., 773 p. (ISBN 978-0-12-088573-2), p. 6
- ↑ (en) Carl L. Yaws, Handbook of Thermodynamic Diagrams, vol. 1, Huston, Texas, Gulf Pub. Co., (ISBN 0-88415-857-8)
- ↑ (en) David R. Lide, CRC Handbook of Chemistry and Physics, Boca Raton, CRC Press/Taylor and Francis, , 89e éd., 2736 p. (ISBN 9781420066791, présentation en ligne), p. 10-205
- 1 2 3 4 « Ethylene », sur www.reciprocalnet.org (consulté le 12 décembre 2009)
- ↑ « Éthylène » dans la base de données de produits chimiques Reptox de la CSST (organisme québécois responsable de la sécurité et de la santé au travail), consulté le 25 avril 2009
- ↑ Numéro index dans le tableau 3.1 de l'annexe VI du règlement CE N° 1272/2008 (16 décembre 2008)
- ↑ IARC Working Group on the Evaluation of Carcinogenic Risks to Humans, « Evaluations Globales de la Cancérogénicité pour l'Homme, Groupe 3 : Inclassables quant à leur cancérogénicité pour l'Homme », sur http://monographs.iarc.fr, CIRC, (consulté le 22 août 2009)
- ↑ « Ethylene », sur hazmap.nlm.nih.gov (consulté le 14 novembre 2009)
- ↑ Warren R. True, Oil & Gas Journal, 2012, vol 110, iss 7
- ↑ (en) Top 10 ethylene producers
- ↑ Technip Onshore - Éthylène
- ↑ Scott, KJ, McGlasson WB and Roberts EA, « Potassium Permanganate as an Ethylene Absorbent in Polyethylene Bags to Delay the Ripening of Bananas During Storage », Australian Journal of Experimental Agriculture and Animal Husbandry, vol. 10, no 43, , p. 237 (DOI 10.1071/EA9700237)
- ↑ Scott KJ, Blake, JR, Stracha, G, Tugwell, BL and McGlasson WB, « Transport of Bananas at Ambient Temperatures using Polyethylene Bags », Tropical Agriculture (Trinidad), vol. 48, , p. 163–165
- ↑ Scott, KJ and Gandanegara, S, « Effect of Temperature on the Storage Life of bananas Held in Polyethylene Bags with an Ethylene Absorbent », Tropical Agriculture (Trinidad), vol. 51, , p. 23–26
- 1 2 Carsten Warneke, Joost de Gouw. NOAA / ESRL PowerPoint : Ozone and Air Quality ; Some Selected Research Projects in the Chemical Sciences Division
Voir aussi
- Alcène
- Propène
- Trichloréthylène
- Ozone troposphérique
- Photochimie
- phyto-hormone
- Portail de la chimie
- Portail de la botanique