Saccharose
| Saccharose | |
|---|---|
 Saccharose en représentation polygonale  Saccharose en projection de Haworth 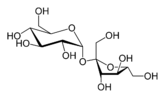  Structure 3D du saccharose | |
| Identification | |
| Nom UICPA | α-D-glucopyranosyl-(1↔2)-β-D-fructofuranoside |
| Synonymes | néohancoside D |
| No CAS | |
| No EINECS | |
| PubChem | |
| SMILES | |
| InChI | |
| Apparence | solide de forme variable blanc[1]. |
| Propriétés chimiques | |
| Formule brute | C12H22O11 [Isomères] |
| Masse molaire[2] | 342,2965 ± 0,0144 g/mol C 42,11 %, H 6,48 %, O 51,42 %, |
| pKa | 12,62[3] |
| Moment dipolaire | 3,1×10-18 C·m[4] |
| Propriétés physiques | |
| T° fusion | 185,5 °C[3] |
| T° ébullition | décomposition |
| Solubilité | 2 000 g/L (eau, 25 °C) 67,47 %m (eau, 25 °C)[5] Modérément sol. dans la pyridine, le glycérol, la méthylpyrrolidinone, la méthylpipérazine, le DMSO, le DMF[4]; |
| Masse volumique | 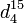 1,5879 g·cm-3[4] 1,5879 g·cm-3[4] |
| Propriétés électroniques | |
| Constante diélectrique | 3,50–3,85[4] |
| Précautions | |
1 1 0 | |
Produit non contrôlé | |
| Ingestion | favorise l'apparition de caries, à grandes doses: vomissements, diarrhées, dyspepsies |
| Écotoxicologie | |
| DL50 | 29,7 g·kg-1 (rats, oral)[3] |
| LogP | -3,67[1] |
| Composés apparentés | |
| Autres composés | Isomaltulose, Leucrose, Maltulose, Tréhalulose, Turanose |
Le saccharose (saccarose[8], sucre de table ou sucre blanc, et en anglais : sucrose) est un sucre au goût très doux et agréable, très largement utilisé pour l'alimentation, extrait de certaines plantes, principalement de la canne à sucre et de la betterave sucrière, et produit sous forme de petits cristaux blancs.
Ce glucide de la catégorie des diholosides est formé par la condensation de deux oses : une molécule de glucose et une molécule de fructose. Son nom normalisé est β-D-fructofuranosyl-(2↔1)-α-D-glucopyranoside ou α-D-glucopyranosyl-(1↔2)-β-D-fructofuranoside. Il peut être abrégé en Glc-Fru.
Les glucides, et plus particulièrement le saccharose, étaient autrefois appelés hydrates de carbone, en raison d'une ancienne expérience de déshydratation du sucre blanc par de l'acide sulfurique concentré. Cette transformation très exothermique peut être modélisée par l'équation de réaction :
Cela permettait ainsi de supposer que la formule semi-développée du saccharose était C12(H2O)11, d'où le nom d’hydrate de carbone, terme aujourd'hui désuet.
Propriétés
Structure
Le saccharose est un diholoside formé d'une molécule de glucose et d'une molécule de fructose reliées par une liaison osidique α(1↔2)β. Sa formule chimique non-développée est C12H22O11 et sa masse molaire est de 342,3 g.mol-1.
Le saccharose a cinq isomères naturels qui diffèrent par la position de la liaison osidique :
- Tréhalulose ⇒ Glucose α(1→1) Fructose[9]
- Turanose ⇒ Glucose α(1→3) Fructose[10] (diholoside réducteur)
- Maltulose ⇒ Glucose α(1→4) Fructose[11]
- Leucrose ⇒ Glucose α(1→5) Fructose[9] (diholoside réducteur)
- Isomaltulose (Palatinose) ⇒ Glucose α(1→6) Fructose[12] (diholoside réducteur)
Propriétés chimiques
Le saccharose est un sucre non réducteur[13], le carbone hémiacétalique du glucose et le carbone hémiacétalique du fructose sont impliqués dans la liaison osidique. Il est non hygroscopique et ne peut effectuer de mutarotation.
Hydrolyse
Il existe plusieurs types d'hydrolyse :
- L'hydrolyse chimique (en milieu acide)
- L'hydrolyse par résine échangeuse d'ion, cette technique permettant de contrôler le pourcentage de saccharose qui sera inverti.
- L'hydrolyse enzymatique. Elle est fonction de la température, du pH et de la concentration. Les deux enzymes entrant en jeu sont l'α-glucosidase et la β-fructosidase ou invertine.
En présence d'eau et à température modérée, soit 37 °C, le saccharose, par l'effet de l'enzyme invertase, s'hydrolyse en glucose et en fructose, ce qui permet son assimilation par l'organisme.
Le mélange produit par l'hydrolyse est un mélange équimolaire de glucose et de fructose, appelé sucre inverti. Il est néanmoins exceptionnel de trouver un sirop dans lequel la réaction a été complète et on trouvera souvent jusqu'à 30 % de saccharose résiduel[réf. nécessaire].
Propriétés physiques
Le saccharose caramélise à 160 °C[14].
La variation de la solubilité avec la température est donnée dans le tableau ci-dessous[5] :
| température | g de saccharose par g d'eau | pourcentage massique | pourcentage molaire |
|---|---|---|---|
| −10 °C | 1,7615 | 63,79 %m | 8,484 %mol |
| −5 °C | 1,7837 | 64,08 %m | 8,582 %mol |
| 0 °C | 1,8127 | 64,45 %m | 8,710 %mol |
| 5 °C | 1,8489 | 64,90 %m | 8,868 %mol |
| 10 °C | 1,8926 | 65,43 %m | 9,059 %mol |
| 15 °C | 1,9443 | 66,04 %m | 9,283 %mol |
| 20 °C | 2,0047 | 66,72 %m | 9,544 %mol |
| 25 °C | 2,0741 | 67,47 %m | 9,842 %mol |
| 30 °C | 2,1535 | 68,29 %m | 10,180 %mol |
| 35 °C | 2,2435 | 69,17 %m | 10,561 %mol |
| 40 °C | 2,3450 | 70,10 %m | 10,986 %mol |
| 45 °C | 2,4589 | 71,09 %m | 11,459 %mol |
| 50 °C | 2,5863 | 72,12 %m | 11,981 %mol |
| 55 °C | 2,7282 | 73,18 %m | 12,556 %mol |
| 60 °C | 2,8857 | 74,26 %m | 13,185 %mol |
| 65 °C | 3,0598 | 75,37 %m | 13,871 %mol |
| 70 °C | 3,2515 | 76,48 %m | 14,613 %mol |
| 75 °C | 3,4616 | 77,59 %m | 15,411 %mol |
| 80 °C | 3,6901 | 78,68 %m | 16,263 %mol |
| 85 °C | 3,9368 | 79,74 %m | 17,164 %mol |
| 90 °C | 4,2003 | 80,77 %m | 18,104 %mol |
| 95 °C | 4,4775 | 81,74 %m | 19,071 %mol |
| 100 °C | 4,7637 | 82,65 %m | 20,046 %mol |
| 105 °C | 5,0335 | 83,43 %m | 20,944 %mol |
| 110 °C | 5,4499 | 84,50 %m | 22,290 %mol |
| 115 °C | 5,9347 | 85,58 %m | 23,801 %mol |
| 120 °C | 6,5062 | 86,68 %m | 25,508 %mol |
| 125 °C | 7,1895 | 87,79 %m | 27,452 %mol |
| 130 °C | 8,0211 | 88,91 %m | 29,685 %mol |
La solubilité du saccharose dans les solvants non aqueux est généralement inférieure. De plus, le saccharose n'est pas soluble dans les solvants non polaires. Des valeurs élevées sont obtenues avec l'ammoniac condensé (72 %), le diméthylsulfoxyde (42 %) et la méthylamine (> 25 %). On obtient des valeurs plus basses avec le dioxyde de soufre liquide, les acides formique et acétique, le diméthylformamide, la pyridine (6 %), le propylène glycol, le glycérol (7 %), le méthanol, l'éthanol, l'acétone et le dioxane[5].
Le taux de sucre est donné par le degré Brix (qui correspond au pourcentage massique à 20 °C[15]). On peut évaluer la concentration d'une solution aqueuse en mesurant la densité à l'aide d'un mustimètre ou l'indice de réfraction à l'aide d'un réfractomètre.
La variation de quelques propriétés de la solution aqueuse à 20 °C est donnée dans le tableau ci-dessous[16] :
| pourcentage massique | molalité (moles par kg d'eau) | molarité (moles par litre de solution) | masse volumique | indice de réfraction | température de solidification | viscosité dynamique |
|---|---|---|---|---|---|---|
| 0,5 %m | 0,015 mol·kg-1 | 0,015 mol·l-1 | 1,0002 g·cm-3 |  1,3337 1,3337 | −0,03 °C | 1,015 mPa·s |
| 1 %m | 0,03 mol·kg-1 | 0,029 mol·l-1 | 1,0021 g·cm-3 |  1,3344 1,3344 | −0,06 °C | 1,028 mPa·s |
| 2 %m | 0,06 mol·kg-1 | 0,059 mol·l-1 | 1,006 g·cm-3 |  1,3359 1,3359 | −0,11 °C | 1,055 mPa·s |
| 3 %m | 0,09 mol·kg-1 | 0,089 mol·l-1 | 1,0099 g·cm-3 |  1,3373 1,3373 | −0,17 °C | 1,084 mPa·s |
| 4 %m | 0,122 mol·kg-1 | 0,118 mol·l-1 | 1,0139 g·cm-3 |  1,3388 1,3388 | −0,23 °C | 1,114 mPa·s |
| 5 %m | 0,154 mol·kg-1 | 0,149 mol·l-1 | 1,0178 g·cm-3 |  1,3403 1,3403 | −0,29 °C | 1,146 mPa·s |
| 6 %m | 0,186 mol·kg-1 | 0,179 mol·l-1 | 1,0218 g·cm-3 |  1,3418 1,3418 | −0,35 °C | 1,179 mPa·s |
| 7 %m | 0,22 mol·kg-1 | 0,21 mol·l-1 | 1,0259 g·cm-3 |  1,3433 1,3433 | −0,42 °C | 1,215 mPa·s |
| 8 %m | 0,254 mol·kg-1 | 0,241 mol·l-1 | 1,0299 g·cm-3 |  1,3448 1,3448 | −0,49 °C | 1,254 mPa·s |
| 9 %m | 0,289 mol·kg-1 | 0,272 mol·l-1 | 1,034 g·cm-3 |  1,3463 1,3463 | −0,55 °C | 1,294 mPa·s |
| 10 %m | 0,325 mol·kg-1 | 0,303 mol·l-1 | 1,0381 g·cm-3 |  1,3478 1,3478 | −0,63 °C | 1,336 mPa·s |
| 12 %m | 0,398 mol·kg-1 | 0,367 mol·l-1 | 1,0465 g·cm-3 |  1,3509 1,3509 | −0,77 °C | 1,429 mPa·s |
| 14 %m | 0,476 mol·kg-1 | 0,431 mol·l-1 | 1,0549 g·cm-3 |  1,3541 1,3541 | −0,93 °C | 1,534 mPa·s |
| 16 %m | 0,556 mol·kg-1 | 0,497 mol·l-1 | 1,0635 g·cm-3 |  1,3573 1,3573 | −1,1 °C | 1,653 mPa·s |
| 18 %m | 0,641 mol·kg-1 | 0,564 mol·l-1 | 1,0722 g·cm-3 |  1,3606 1,3606 | −1,27 °C | 1,79 mPa·s |
| 20 %m | 0,73 mol·kg-1 | 0,632 mol·l-1 | 1,081 g·cm-3 |  1,3639 1,3639 | −1,47 °C | 1,945 mPa·s |
| 22 %m | 0,824 mol·kg-1 | 0,7 mol·l-1 | 1,0899 g·cm-3 |  1,3672 1,3672 | −1,67 °C | 2,124 mPa·s |
| 24 %m | 0,923 mol·kg-1 | 0,771 mol·l-1 | 1,099 g·cm-3 |  1,3706 1,3706 | −1,89 °C | 2,331 mPa·s |
| 26 %m | 1,026 mol·kg-1 | 0,842 mol·l-1 | 1,1082 g·cm-3 |  1,3741 1,3741 | −2,12 °C | 2,573 mPa·s |
| 28 %m | 1,136 mol·kg-1 | 0,914 mol·l-1 | 1,1175 g·cm-3 |  1,3776 1,3776 | −2,37 °C | 2,855 mPa·s |
| 30 %m | 1,252 mol·kg-1 | 0,988 mol·l-1 | 1,127 g·cm-3 |  1,3812 1,3812 | −2,64 °C | 3,187 mPa·s |
| 32 %m | 1,375 mol·kg-1 | 1,063 mol·l-1 | 1,1366 g·cm-3 |  1,3848 1,3848 | −2,94 °C | 3,762 mPa·s |
| 34 %m | 1,505 mol·kg-1 | 1,139 mol·l-1 | 1,1464 g·cm-3 |  1,3885 1,3885 | −3,27 °C | 4,052 mPa·s |
| 36 %m | 1,643 mol·kg-1 | 1,216 mol·l-1 | 1,1562 g·cm-3 |  1,3922 1,3922 | −3,63 °C | 4,621 mPa·s |
| 38 %m | 1,791 mol·kg-1 | 1,295 mol·l-1 | 1,1663 g·cm-3 |  1,396 1,396 | −4,02 °C | 5,315 mPa·s |
| 40 %m | 1,948 mol·kg-1 | 1,375 mol·l-1 | 1,1765 g·cm-3 |  1,3999 1,3999 | −4,45 °C | 6,162 mPa·s |
| 42 %m | 2,116 mol·kg-1 | 1,456 mol·l-1 | 1,1868 g·cm-3 |  1,4038 1,4038 | −4,93 °C | 7,234 mPa·s |
| 44 %m | 2,295 mol·kg-1 | 1,539 mol·l-1 | 1,1972 g·cm-3 |  1,4078 1,4078 | 8,596 mPa·s | |
| 46 %m | 2,489 mol·kg-1 | 1,623 mol·l-1 | 1,2079 g·cm-3 |  1,4118 1,4118 | 10,301 mPa·s | |
| 48 %m | 2,697 mol·kg-1 | 1,709 mol·l-1 | 1,2186 g·cm-3 |  1,4159 1,4159 | 12,515 mPa·s | |
| 50 %m | 2,921 mol·kg-1 | 1,796 mol·l-1 | 1,2295 g·cm-3 |  1,4201 1,4201 | 15,431 mPa·s | |
| 60 %m | 4,382 mol·kg-1 | 2,255 mol·l-1 | 1,2864 g·cm-3 |  1,4419 1,4419 | 58,487 mPa·s | |
| 70 %m | 6,817 mol·kg-1 | 2,755 mol·l-1 | 1,3472 g·cm-3 |  1,4654 1,4654 | 481,561 mPa·s | |
| 80 %m | 11,686 mol·kg-1 | 3,299 mol·l-1 | 1,4117 g·cm-3 |  1,4906 1,4906 | ||
Propriétés édulcorantes
Le pouvoir sucrant du saccharose sert de référence dans l'échelle des produits sucrants, c'est-à-dire qu'il est considéré comme égal à 1 par convention. Le seuil de reconnaissance moyen du saccharose est de 0,017 mol·l-1[17].
Utilisations en agro-alimentaire
Le sucre ingrédient alimentaire majeur
Le saccharose est l'un des ingrédients les plus utilisés dans l'industrie agro-alimentaire. Il constitue la base de certains secteurs comme la confiserie, la pâtisserie, l'industrie des confitures, et des boissons.
Physico-chimie
Le saccharose est très soluble dans l'eau, et sa solubilité augmente avec la température. Il est relativement stable, il peut cependant fermenter (une évolution indésirable en général, sauf pour les boissons alcoolisées) ou s'hydroliser (s'invertir, dans le langage des confiseurs) en glucose et fructose, ce phénomène étant contrôlable.
Lors de son utilisation dans l'industrie des boissons, le saccharose peut s'invertir tout seul lors du traitement thermique. De plus, le sucre inverti étant plus soluble que le saccharose, en sa présence, il peut jouer le rôle de rétenteur d'eau et empêcher la cristallisation de ce dernier.
Le saccharose diminue l'activité de l'eau des produits qui en contiennent beaucoup, permettant ainsi leur conservation.
Il peut aussi être utilisé en tant qu'adjuvant de texture, pour ses qualités d'agglomérant.
Granulométrie
Les différentes tailles de cristaux suivants les besoins de l'industrie :
- sucre cristallisé,
- sucre semoule,
- sucre glace,
- sucre grain.
Utilisation en fermentation
Le saccharose est l'un des substrats de fermentation les plus classiques. De nombreux micro-organismes peuvent le fermenter, dont le très étudié Saccharomyces cerevisiae.
Utilisation en agriculture
Le saccharose possède un usage en agriculture[18].
Nutrition et santé
Voir Sucre/Nutrition et Sucre/Santé
Notes et références
- 1 2 SUCROSE, fiche de sécurité du Programme International sur la Sécurité des Substances Chimiques, consultée le 9 mai 2009
- ↑ Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- 1 2 3 (en) « Sucrose » sur ChemIDplus, consulté le 5 octobre 2009
- 1 2 3 4 (en) William J. Colonna, Upasiri Samaraweera, Kirk-Othmer Encyclopedia of Chemical Technology : Properties of sucrose, vol. 23, John Wiley & Sons., 4e éd., p. 4
- 1 2 3 (en) Mohammed Mathlouthi, P. Reiser, Sucrose: properties and applications, Springer, , 294 p. (ISBN 0-7514-0223-0, lire en ligne), p. 107
- ↑ « Sucrose », sur Hazardous Substances Data Bank (consulté le 18 février 2010)
- ↑ « Sucrose » dans la base de données de produits chimiques Reptox de la CSST (organisme québécois responsable de la sécurité et de la santé au travail), consulté le 24 avril 2009
- ↑ saccarose est l'orthographe préconisée par les rectifications orthographiques du français en 1990.
- 1 2 (en) (en) Peter M. Collins, Dictionary of carbohydrates, CRC Press, , 1282 p. (ISBN 0-8493-3829-8), p. 538
- ↑ (en) (en) Peter M. Collins, Dictionary of carbohydrates, CRC Press, , 1282 p. (ISBN 0-8493-3829-8), p. 948
- ↑ (en) MA Godshall, « The Expanding World of Nutritive and Non-Nutritive Sweeteners », sur http://www.sugarjournal.com, (consulté le 7 novembre 2008), p. 12-20 [PDF]
- ↑ (en) (en) Peter M. Collins, Dictionary of carbohydrates, CRC Press, , 1282 p. (ISBN 0-8493-3829-8), p. 537
- ↑ (en) (en) Shmuel Yannai, Dictionary of Food Compounds with CD-ROM: Additives, Flavors, and Ingredients, CRC Press, , 1784 p. (ISBN 1-58488-416-9, présentation en ligne), p. 1243-1244
- ↑ (en) Food-Info, caramelization
- ↑ (en) Neil L. Pennington, Charles W. Baker, Sugar, a user's guide to sucrose, Springer, , 331 p. (ISBN 0-442-00297-1, lire en ligne), p. 49
- ↑ (en) David R. Lide, CRC Handbook of Chemistry and Physics, CRC Press, , 84e éd., 2616 p. (ISBN 0-8493-0484-9), 8-81
- ↑ (en) (en) RS Shallenberger, Taste Chemistry, London, Springer, , 613 pages p. (ISBN 0-7514-0150-1, lire en ligne), « Chemical nature, psychology and physiology of taste », p. 5-46
- ↑ RÈGLEMENT D'EXÉCUTION (UE) No 916/2014 DE LA COMMISSION du 22 août 2014 portant approbation de la substance de base «saccharose», conformément au règlement (CE) no 1107/2009 du Parlement européen et du Conseil concernant la mise sur le marché des produits phytopharmaceutiques, et modifiant l'annexe du règlement d'exécution (UE) no 540/2011 de la Commission
Voir aussi
Articles connexes
- Glucide
- Diholoside
- Sucre
- Glucose
- Fructose
- Sucre inverti
Liens externes
- (en) Substance saccharose NCBI database
- (en) Compound: C00089 Sucrose www.Genome.net
- (en) Glycan: G00370 Neohancoside D www.Genome.net
- (en) Sucrose sur National Library of Medicine - Medical Subject Headings MeSH
- Portail de la biochimie
- Portail de la chimie

