Télomère
|
|
Cet article est une ébauche concernant la biologie cellulaire et moléculaire. Vous pouvez partager vos connaissances en l’améliorant (comment ?) selon les recommandations des projets correspondants.
|
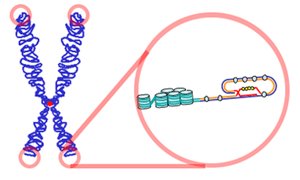
Un télomère est une région hautement répétitive, donc a priori non codante, d'ADN à l'extrémité d'un chromosome. À chaque fois qu'un chromosome en bâtonnet d'un eucaryote est répliqué, lors de la réplication, qui précède la mitose (division cellulaire), le complexe enzymatique de l'ADN polymérase s'avère incapable de copier les derniers nucléotides : l'absence de télomère signifierait la perte rapide d'informations génétiques nécessaires au fonctionnement cellulaire. De récents travaux suggèrent cependant que l'ADN répétitif des télomères pourrait être transcrit en ARN répétitifs qui joueraient un rôle dans la stabilisation du télomère[1].
Les télomères raccourcissent avec l’âge, l’inflammation et le stress. Des études ont montré que des télomères courts sont associés à un risque plus élevé de maladies liées à l’âge[2].
Historique
En 1971, le biologiste russe Alekseï Olovnikov émet pour la première fois l'hypothèse que la durée de vie maximale des cellules en culture (limite de Hayflick) est corrélée à la perte progressive de séquences télomériques. En effet, lors de chaque division cellulaire, les télomères s'érodent jusqu'à atteindre une taille critique qui déclenche alors une entrée en sénescence de la cellule. Les télomères agissent comme une horloge biologique régissant la durée de vie des cellules. Cette théorie est connue sous le nom de théorie télomérique du viellissement. Il prédit également l'existence d'une enzyme capable d'inverser le processus en synthétisant de nouvelles séquences d'ADN télomériques : il s'agit de la télomérase. L'identification de la télomérase est faite en 1985 par Elizabeth Blackburn et Carol Greider[3]. Ce travail est récompensé par le prix Nobel de physiologie ou médecine en 2009.
Structure et fonctions
Chez la plupart des procaryotes, les chromosomes sont circulaires (plasmides), et ne possèdent donc pas d'extrémité susceptible d'être altérée par une réplication incomplète. Une petite proportion des chromosomes bactériens, (comme ceux de Streptomyces et Borelia), sont en forme de bâtonnet et possèdent des télomères dont la structure et la fonction diffèrent notablement de ceux des chromosomes des eucaryotes. En période interphasique du cycle cellulaire, les télomères sont localisables dans les zones les plus éloignées du centre du noyau.
Les télomères comportent des séquences répétitives d'ADN, qui assurent une protection des terminaisons chromosomiques. Ils évitent que le chromosome ne s'effiloche et que son extrémité ne soit considérée comme une rupture du double brin d'ADN, ce qui pourrait conduire à des soudures de chromosomes par fusion de leurs télomères respectifs. De plus, la réplication de l'ADN (par l'ADN polymérase) n'est pas parfaite à ses extrémités : le segment répliqué est en règle générale plus court que l'original. La présence de télomères, sans information génétique, préviendrait ainsi la perte de données[4]. Ces séquences sont répétées plusieurs centaines de fois sur chaque chromosome humain[4]. Les télomères sont recouverts de protéines, les « shelterines »[5].
Les télomérases, enzymes transcriptases inverses spécialisées, assurent la synthèse et la croissance des télomères, chez l'humain et chez la plupart des autres organismes[6]. Ces enzymes sont très actives surtout pour les cellules qui se divisent de nombreuses fois (exemple : les cellules-souches).
Ainsi, dans beaucoup de types cellulaires humains, la réplication de l'ADN et l'expression du gène TERT, codant la télomérase inverse transcriptase, sont réprimés, les télomères de ces cellules se raccourcissent donc progressivement à chaque division : on dit qu'ils constituent des horloges biologiques.
Au contraire, dans les tissus à multiplication cellulaire intense, comme les cellules-souches ou les globules blancs du sang, le gène TERT est exprimé et la longueur des télomères reste constante.
Chez l'humain, la séquence répétitive des télomères est TTAGGG, sur une longueur de 3 à 20 kilobases. De 100 à 300 kilobases supplémentaires de répétition relient le télomère au reste du chromosome. Ces répétitions varient d'une espèce à l'autre mais comportent beaucoup de bases guanine-cytosine.
Dans certaines cellules la longueur des télomères reste constante sans que la télomérase ne soit exprimée, dans ce cas le processus de maintien des télomères implique l'action d'une machinerie cellulaire appelée "ALT" pour "Alternative Lengthening of Telomeres". Ce système utilise pour ceci la recombinaison homologue.
Télomères et télomérases en médecine
Télomères et vieillissement
Chez la majorité des eucaryotes multicellulaires, les télomérases ne sont actives que dans les cellules germinales. Le raccourcissement progressif des télomères des cellules somatiques est une cause possible de la sénescence et prévient le cancer.
Quand le télomère devient trop court, il ne joue plus son rôle protecteur: la partie enroulée se déroule. La cellule va interpréter ceci comme une corruption de son ADN, entrer en sénescence et stopper sa croissance. De tels télomères trop raccourcis peuvent aussi provoquer une fusion de deux chromosomes. Comme de telles altérations ne sont pas réparables dans les cellules somatiques ordinaires, elles peuvent provoquer une apoptose.
Plusieurs maladies du vieillissement (dont la progeria, caractérisée par un vieillissement très précoce) sont provoquées par un raccourcissement télomérique excessif. Les organes se détériorent d'autant plus que leurs cellules constitutives meurent ou entrent en sénescence.
Un raccourcissement plus important des télomères serait un marqueur de risque de maladies cardio-vasculaires chez les hommes d'âge moyen[7].
Cancer
La plupart des cancers produisent de la télomérase, mais souvent à un stade tardif, la cancérogénèse débutant par une érosion importante des télomères[8].
Avant 2015 se posait la question de la stimulation de la croissance des télomères vis à vis du cancer (étude[9] portant sur 200 sujets). Une étude danoise d'une ampleur sans précédent apporte des réponses : portant sur près de 65 000 personnes suivies pendant 7 ans, cette dernière démontre que les télomères courts ne sont pas seulement un marqueur, mais bien une cause de mortalité[10]. Résultats de l'étude:
Impact de la longueur des télomères sur la mortalité; données brutes: 3,38 (ce qui signifie que les 10% de personnes ayant les plus courts télomères étaient en train de mourir à un taux de 3,38 plus élevé que le 10% avec les plus longs télomères)
Même calcul, corrigée pour l'âge: 1,54
Même calcul, corrigée pour l'âge et toutes les autres variables* de risque: 1,40 (* tabagisme, alcool, cholestérol, sédentarité...)
Conclusion: l'âge est le facteur le plus important de la mortalité, et la longueur des télomères (courts) a un fort effet, indépendamment de l'âge. Toutes les variables de santé sont ensemble un petit facteur par rapport à l'âge et la longueur des télomères.
Mutations de la télomérase
Ces mutations sont constatées dans certaines maladies. C'est le cas de la dyskératose congénitale associant une anémie centrale (par absence de formation de globules rouges dans la moelle), des anomalies au niveau des muqueuses de la bouche, des ongles et de la peau[11].
Une mutation est également retrouvée dans un peu moins de 10 % des fibroses pulmonaires idiopathiques[12].
Notes et références
- ↑ Schoeftner, S., and M. A. Blasco. 2007. Developmentally regulated transcription of mammalian telomeres by DNA-dependent RNA polymerase II. Nat. Cell Biol. 10:228-236
- ↑ Le sport retarde le vieillissement des cellules, Sandrine Cabut, Le Figaro.fr, 5 janvier 2010
- ↑ Greider, C. W. & Blackburn, E. H., « Identification of a specific telomere terminal transferase activity in Tetrahymena extracts », Cell vol. 43, pp. 405–413 (1985).
- 1 2 Calado RT, Young NS, « Telomere diseases », The New England Journal of Medicine, vol. 361, pp. 2353-2365 (2009).
- ↑ T. de Lange, « Shelterin: the protein complex that shapes and safeguards human telomeres », Genes Dev., vol. 19, pp. 2100-2110 (2005).
- ↑ Witzany, Guenther, « The Viral Origins of Telomeres and Telomerases and their Important Role in Eukaryogenesis and Genome Maintenance », Biosemiotics, vol. 1, pp. 191-206 (2008).
- ↑ Scott W. Brouilette, Jasbir S. Moore, Alex D. McMahon, R. Thompson, Ian Ford, James Shepherd, Chris J. Packard, Nilesh J. Samani, « Telomere length, risk of coronary heart disease, and statin treatment in the West of Scotland Primary Prevention Study », Lancet, vol. 369, pp. 107-114 (2007).
- ↑ Hastie ND, Dempster M, Dunlop MG, Thompson AM, Green DK, Allshire RC, « Telomere reduction in human colorectal carcinoma and with ageing », Nature, vol. 346, pp. 866-868 (1990).
- ↑ http://www.sciencedirect.com/science/article/pii/S0140673603123847
- ↑ http://jnci.oxfordjournals.org/content/107/6/djv074.short
- ↑ Mitchell JR, Wood E, Collins K, « A telomerase component is defective in the human disease dyskeratosis congenita », Nature, vol. 402, pp. 551-555 (1999).
- ↑ Armanios MY, Chen JJ, Cogan JD et al., « Telomerase mutations in families with idiopathic pulmonary fibrosis », The New England Journal of Medicine, vol. 356, pp. 1317-1326 (2007).
Voir aussi
Bibliographie
- (en) Steven E. Artandi, « Telomeres, Telomerase, and Human Disease », The New England Journal of Medicine, vol. 355, pages 1195-97, 2006.
Articles connexes
- Télomérase
- Immortalité
- Transcription inverse
Lien externe
- Télomères et télomérase
- Portail de la biologie cellulaire et moléculaire