Apoptose


L'apoptose (ou la mort cellulaire programmée) est le processus par lequel des cellules déclenchent leur auto-destruction en réponse à un signal. C'est l'une des voies possibles de la mort cellulaire, qui est physiologique, génétiquement programmée, nécessaire à la survie des organismes multicellulaires. Elle est en équilibre constant avec la prolifération cellulaire. Contrairement à la nécrose, elle ne provoque pas d'inflammation : les membranes plasmiques ne sont pas détruites, du moins dans un premier temps, et la cellule émet des signaux (en particulier, elle expose sur le feuillet externe de sa membrane plasmique de la phosphatidylsérine, un phospholipide normalement constitutif de son feuillet interne) qui permettront sa phagocytose par des globules blancs, notamment des macrophages.
Découverte et étymologie
L'apoptose (du grec : apo - au loin et ptosis - chute) a été mise en évidence en 1972 par John Kerr, Andrew Wyllie et Alastair Currie lors de l'étude de tissu par microscopie électronique[1].
Ils choisirent ce mot apoptosis pour décrire le phénomène de mort cellulaire naturelle. Ce mot provient d'une locution grecque évoquant la « chute des feuilles »[2]. Elle avait déjà été employée en médecine par Hippocrate de Kos (460-377 av. J.-C.) dans son traité De Instruments de réduction pour décrire la décomposition des tissus après la mort (« chute des os »)[2],[3].
Exemples de rôles physiologiques
Morphogenèse
L'apoptose joue un rôle dans la formation du corps d'un organisme, par exemple l'émergence des doigts. Au début de sa formation, la main ressemble à une moufle (ou une palme), puis les cellules se trouvant entre les futurs doigts disparaissent. De même, la disparition de l'appendice caudal, chez le fœtus humain, est due à ce phénomène d'apoptose. La régression de la queue chez les têtards lors de leur métamorphose en grenouille est elle aussi due à l'apoptose.
Elle joue un rôle dans la formation du cerveau : très tôt dans l'embryogenèse, le cerveau subit une vague apoptotique qui le remodèle. Ensuite, les neurones forment entre eux des liaisons synaptiques au hasard, et une deuxième vague apoptotique élimine ceux qui n'ont pas établi de liaisons utiles.
Elle peut également avoir un rôle moteur, la rétraction des cellules mortes entraînant la mobilisation des tissus voisins. Ce mécanisme a notamment été décrit chez l'embryon de la drosophile[4].
Système immunitaire
En réponse à l'apparition d'un antigène étranger dans le corps, des lymphocytes B se mettent à produire chacun un anticorps particulier, en recombinant au hasard leurs gènes d'immunoglobulines (recombinaison VDJ). Ceux qui produisent des anticorps inactifs ou autoimmuns sont éliminés par apoptose. En cas d'infection virale, les lymphocytes T cytotoxiques produisent des molécules toxiques pour les cellules infectées; ils sont détruits par apoptose lorsque l'infection est maîtrisée. C'est le cas dans l'infection par le VIH, mais cette voie entraîne par la suite des effets néfastes car les LT4 détruits en grande quantité ne peuvent plus sécréter les interleukines à l'origine de la sélection et de l'amplification clonale.
Différenciation intestinale
Les cellules intestinales sont en perpétuel renouvellement (avec une durée de vie de quelques jours seulement) et migrent du bas des cryptes vers le sommet des villosités intestinales de l'intestin grêle où elles assurent leur fonction d'absorption des nutriments. Ultimement elles se décrochent et enclenchent un phénomène apoptotique particulier appelé anoïkose, dû à la perte de contact cellule-cellule ou cellule-matrice extracellulaire.
Dédifférenciation mammaire
Les acini des glandes mammaires après la période d'allaitement, et en absence du maintien du signal de prolifération/différenciation dû à la prolactine, vont se résorber, et perdre un nombre important de cellules épithéliales par un processus d'apoptose.
Causes
- Une cellule normale a constamment besoin que le corps lui confirme son utilité, aux moyens de facteurs de croissance. La perte de ces signaux peut déclencher un processus apoptotique.
- Des signaux émis à la suite des dommages subis par l'ADN (par exemple suite à une irradiation aux rayons UV ou aux rayons X) sont capables de déclencher l'apoptose: en effet c'est alors soit une cellule potentiellement cancéreuse, soit une cellule totalement dysfonctionnelle. Dans les deux cas, cette cellule doit être éliminée sans dommage pour le reste du tissu adjacent.
- Des signaux hormonaux, notamment par les glucocorticoïdes, peuvent déclencher l'apoptose. C'est un mécanisme important, de régulation du système immunitaire.
- Pression sur le réticulum endoplasmique : lorsqu'une cellule a un problème dans la conformation d'une protéine, qui aboutit à une accumulation de cette protéine dans le réticulum endoplasmique, elle peut entrer en apoptose.
- La perte des contacts entre certaines cellules, ou bien entre ces cellules et leur matrice extracellulaire environnante induit de façon extrêmement rapide un processus apoptotique appelé anoïkose.
- L'apoptose peut aussi être causée par la dégradation des télomères des chromosomes. Elle peut être inhibée par les télomérases. Ce processus est aussi appelé horloge biologique.

Manifestation cytologique

L'apoptose se manifeste sur ces cellules isolées (non regroupées). On constate sur les cellules concernées une compaction et une marginalisation de la chromatine nucléaire ainsi qu'une convolution des membranes cytoplasmiques et nucléaires et une condensation du cytoplasme.
L'intégrité des membranes est conservée au cours du processus apoptotique évitant ainsi toute réaction inflammatoire. Les corps apoptotiques sont protégés par une enveloppe membranaire issue de la convolution des membranes.
Mécanismes moléculaires
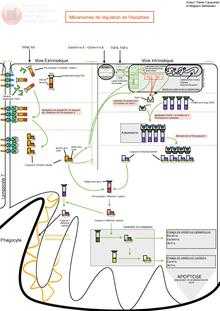
Le mécanisme d’apoptose est gouverné par deux voies principales d’activation :
- une voie dite extrinsèque, impliquant des récepteurs appartenant à la super-famille de protéines (en) des récepteurs au facteur de nécrose tumorale (TNF de l'anglais : tumor necrosis factor),
- une voie dite intrinsèque mettant en jeu la mitochondrie ; cette voie est gouvernée principalement par des protéines appartenant à la super-famille de Bcl-2.
Ces deux voies conduisent à l’activation de protéases à cystéine (caspases) dites effectrices. Celle-ci sont responsables du clivage de plusieurs molécules, comme certaines protéines de structure, ce qui se traduit des phénomènes morphologiques et biochimiques caractéristiques se terminant par le démantèlement de la cellule : exposition de phosphatidylsérine à la surface de la membrane cellulaire, arrêt de la réplication, fragmentation du noyau et du cytosquelette entraînant la formation de corps apoptotiques phagocytés par les cellules environnantes.
Voie extrinsèque
Comme son nom l'indique, la voie extrinsèque de l'apoptose est déclenchée par un signal extérieur à la cellule. Par exemple, cette voie est empruntée lorsqu'un lymphocyte T cytotoxique déclenche la mort d'une cellule indésirable. Dans ce cas, par un simple contact de membrane à membrane, la cellule immunitaire induit l'activation des récepteurs Fas et l'apoptose de la cellule ciblée. Les mécanismes induits par Fas peuvent être étendus à ceux d'autres récepteurs de mort tels que DR4/TRAIL-R1 et DR5/TRAIL-R2. L'activation de Fas par son ligand induit le recrutement d'un complexe appelé DISC (Death-Inducing Signaling Complex) composé de molécules adaptatrices FADD (Fas Associated Death Domain) et des procaspases initiatrices -8 et -10. FADD se lie par l'intermédiaire son propre domaine de mort (Death Domain ou DD) aux DD des récepteurs Fas par des liaisons homotypiques électrostatiques[5]. FADD contient également un domaine effecteur de mort (Death Effector Domain ou DED) qui, par des liaisons homotypiques hydrophobes[6], permet le recrutement des caspases initiatrices. La formation de ce complexe entraîne, par un effet de proximité, l'autoclivage des caspases -8 et -10 qui sont alors relarguées dans le cytosol sous une forme dimérique active. Cela permet l'activation séquentielle des caspases effectrices, parmi lesquelles la caspase-3. Les caspases initiatrices -8 et -10 peuvent activer la voie intrinsèque via le clivage de la protéine Bid et ainsi amplifier le signal apoptotique[7]. Dans le cas de cellules dites "de type 1", le déclenchement de l'apoptose n'est pas dépendante de la voie intrinsèque. Inversement, dans les cellules dites "de type 2", l'activation de la voie intrinsèque est nécessaire à l'apoptose et son blocage résulte en la résistance des cellules à Fas.
Voie intrinsèque
Par opposition à la voie extrinsèque, la voie intrinsèque (ou voie mitochondriale) de l'apoptose est généralement induite par des signaux internes à la cellules. Par exemple, cette voie est déclenchée par l'activation de p53 lors des dommages importants à l'ADN. L'activation de cette voie repose principalement sur la formation de pores de transition de perméabilité dans la membrane des mitochondries par l'ouverture du PTPC (Permeability Transition Pore Complex), un complexe multiprotéique de la membrane interne mitochondriale. Ces pores sont des canaux oligo-protéiques constitués au niveau de la membrane externe par la porine (ou VDAC : Voltage Dependent Anion Channel) et sur la membrane interne par l'ANT (Adenine Nucléotide Translocator). Cette phase d'activation s'accompagne d'une diminution du potentiel transmembranaire mitochondrial (Delta Psi m), suivi du gonflement de la matrice mitochondriale, d'une interruption du métabolisme énergétique aérobique et d'un stress oxydatif. Selon les modèles, il y a rupture ou ouverture de la mitochondrie, ce qui permet la libération dans le cytosol de molécules pro-apoptotiques normalement mitochondriales, telles que le cytochrome C, Smac/DIABLO, OMI/HtrA2, l'endonucléase-G ainsi que l’Apoptosis Inducing Factor (AIF). La phase de perméabilisation de la membrane mitochondriale n'est pas encore pleinement comprise. Néanmoins, celle-ci est décrite pour être sous le contrôle d'interactions complexes et dynamiques entre les membres pro- et anti-apoptotiques de la famille de Bcl-2[8]. Les membres anti-apoptotiques (Bcl-2, Bcl-xL, Mcl-1) forment des hétérodimères avec les membres pro-apoptotiques Bax et Bak, contrebalancent leur activité et permettent la stabilité de la mitochondrie. Lorsque la mitochondrie est activée, par exemple lors d'une activation de Fas et par l'intermédiaire de Bid, celui-ci intéragit et active directement Bax et Bak. Cela induit la perte d'interaction entre Bax, Bak et les membres anti-apoptotiques de la famille de Bcl-2, leur oligomérisation, la formation des pores et le relarguage des protéines mitochondriales[9]. Une fois devenus cytosoliques, les facteurs pro-apoptotiques mitochondriaux vont avoir des cibles et des effets spécifiques. Le cytochrome C cytosolique s'associe à APAF1 et la procaspase-9 pour former un complexe nommé apoptosome. La caspase-9 est activée au sein de ce complexe et est capable dʼactiver à son tour les caspases effectrices comme la caspase-3[10]. La procaspase-9 a plus dʼaffinité pour lʼapoptosome que la caspase-9 active ce qui permet une rotation/activation des procaspases-9 au sein d'un même apoptosome[11]. Smac/DIABLO et OMI/HtrA2 ciblent et inhibent les protéines de la famille des IAP (Inhibitor of apoptosis) favorisant ainsi l'activité des caspases[12][13]. Le facteur AIF est redistribué vers le cytosol puis vers le noyau cellulaire pour induire une mort par apoptose qui a la particularité d'être indépendante des caspases et ne nécessiter aucun autre intermédiaire[14].
Fragmentation de l'ADN
Durant l’apoptose, l’ADN est digéré de façon très spécifique en fragments dont les tailles sont des multiples de 180 paires de bases, ce qui cause une distribution très caractéristique des fragments d’ADN en « échelle » lorsqu'ils sont séparés par électrophorèse suivant leur taille. Cette taille est révélatrice de l'espacement entre deux nucléosomes consécutifs. Cette digestion est assurée par les protéines CAD (Caspase Activated DNase), existant en temps normal sous forme inactive en association avec une ICAD (Inhibitor of Caspase Activated DNase). Cette ICAD cache la séquence NLS de CAD et le clivage de cette association par une caspase va permettre à la protéine CAD de rentrer dans le noyau, qui jouera son rôle de DNase clivant l'ADN. La fragmentation de l'ADN est utilisée pour détecter des cellules en apoptose dans un tissu grâce à la technique du TUNEL (Terminal Transferase dUTP Nick End Labeling)[15].
L'un des mécanismes de l'apoptose dans les cellules cardiaques post ischémiques semble consister en la nitration des protéines cellulaires par un excès de peroxynitrites[16]. Ces peroxynitrites induisent également l'apoptose des monocytes[17] et des lymphocytes T[18].
Par exemple quand les cellules ne reçoivent pas en permanence de leurs voisines des messages inhibant leur autodestruction, elles disparaissent spontanément.
Conséquences d'un dysfonctionnement de l'apoptose
Maladies ou affections induites par le blocage de l'apoptose
Les cellules cancéreuses sont généralement des cellules dans lesquelles ce mécanisme ne fonctionne plus. Elles survivent et se multiplient en dépit d'anomalies génétiques survenues au cours de la vie de la cellule, alors que normalement elles auraient dû être détruites par apoptose.
La réactivation du mécanisme d'apoptose a pu toutefois être obtenue chez des cellules cancéreuses de rat[19].
Certains pathogènes empêchent l'induction de l'apoptose, comme HHV8 (herpesvirus responsable du sarcome de Kaposi), qui code la protéine v-FLIP, empêchant l'apoptose induite par les récepteurs de mort.
Certaines maladies neurodégénératives comme les tauopathies, sont également des maladies où les mécanismes apoptotiques sont impliqués, conduisant à la survivance de protéine tau pathogène qui peut alors s'accumuler anormalement, jusqu'à la mort de la cellule nerveuse. C'est le cas de la paralysie supranucléaire progressive, de la maladie d'Alzheimer, etc.
Maladies ou affections causées par l’activation intempestive de l’apoptose
Des recherches récentes[20] semblent montrer que le développement du sida en tant que maladie serait lié au déclenchement intempestif de l’apoptose des lymphocytes gérant la réponse immunitaire, ce qui permet le développement de maladies et infections opportunes. Cela ne remet pas en cause le rôle actif du virus VIH comme cause effective de cette maladie, bien que celui-ci soit bien détecté et tué par les lymphocytes.
Toutefois le blocage du virus par les anticorps produits par les lymphocytes conduirait le virus à produire avant sa destruction complète une réponse chimique de défense destinée à provoquer l’apoptose massive de tous les lymphocytes voisins, voire à faire fabriquer par les macrophages (qui absorberaient le virus neutralisé par les anticorps en même temps que le message chimique provoquant leur apoptose) cette réponse chimique qui provoquerait « à distance » le suicide de nombreux autres lymphocytes voisins alors même qu’ils n’ont jamais été directement en contact avec le VIH. En d’autres termes, le VIH provoquerait une réponse exacerbée du système immunitaire contre lui-même. C'est alors un effet « boule de neige », où un système morphologique est détourné de ses fonctions par une réponse non contrôlée, semblable à d’autres phénomènes auto-induits comme les allergies (elles aussi liées à un facteur déclenchant externe).
En provoquant cette réaction, une partie des copies du VIH parviendrait ainsi à échapper à l’action des lymphocytes T, dont un grand nombre se sont apoptosés après que quelques-uns d'entre eux seulement ont neutralisé de nombreux virus voisins. Cela expliquerait aussi pourquoi l'éradication totale du virus par le système immunitaire n’est pas possible sans une aide extérieure non sensible au phénomène de l’apoptose (une aide apportée par les médicaments anti-rétroviraux qui s'attaquent spécifiquement au VIH pour éviter que les lymphocytes s’en chargent en activant alors l'apoptose de leurs voisins par l'action ultérieure des macrophages éliminateurs)[21].
La compréhension des mécanismes chimiques de l'apoptose pourrait ainsi pallier cette fragilité intrinsèque du système immunitaire, et permettre donc le développement d'un type de vaccin particulier, non destiné à activer la réponse immunitaire contre le VIH (puisque celle-ci a bien lieu naturellement et produit de nombreux anticorps) mais à bloquer le déclenchement intempestif de l'apoptose des lymphocytes T CD4 chargés de leur neutralisation (et de la neutralisation des autres sources d'infection). Dans le cas du sida, on ne sait pas exactement quel lymphocyte possède cette fragilité (dangereuse uniquement pour les autres types de cellules mais pas lui-même directement), mais on peut penser qu'elle se situe au niveau des macrophages chargés d'éliminer les virus neutralisés par les anticorps.
Ce comportement intempestif des mêmes macrophages (les poubelles de l’organisme qui peuvent générer par leur action des tas de produits toxiques et agents chimiques difficiles à éliminer isolément) est également impliqué dans d'autres types de réactions exacerbées de l’organisme comme certaines allergies (où cette réaction, très largement auto-entretenue, se fait à destination d'autres types de cellules que les lymphocytes immunitaires), et est soupçonné également dans d'autres types de maladies dégénératives (qui possèdent aussi un facteur déclenchant externe, pas nécessairement de nature infectieuse) ou certaines réactions exacerbées face à un stress (par exemple l'extension des brûlures).
Monde végétal
Les phénomènes d'apoptose et de vitrescence sont décrits dans les cellules végétales.
Notes et références
- ↑ Kerr JFR, Willie AH, Currie AR. Apoptosis : a basic biological phenomenon with wide-ranging implications in tissue kinetics. Br J Cancer 1972 ; 26 : 239-57. PMID 4561027
- 1 2 chap 2, l'apoptose de la thèse de Doctorat en sciences vétérinaires, Identification de nouveaux mécanismes régulateurs de l'apoptose des granulocytes, 2007.
- ↑ Hellenic journal of nuclear medicine, The Journal of the Hellenic Society of Nuclear Medicine, Hell J Nucl Med 2008, 11 (1): 2-4. Useful known and unknown views of the father of modern medicine, Hippocrates and his teacher Democritus
- ↑ Davidson LA, Apoptosis turbocharges epithelial morphogenesis, Science, 2008:21;1641-1642
- ↑ Jeong EJ, Bang S, Lee TH, Park YI, Sim WS, Kim KS. "The solution structure of FADD death domain. Structural basis of death domain interactions of Fas and FADD", J Biol Chem. 1999 Jun 4;274(23):16337-42
- ↑ Eberstadt M, Huang B, Chen Z, Meadows RP, Ng SC, Zheng L, Lenardo MJ, Fesik SW. "NMR structure and mutagenesis of the FADD (Mort1) death-effector domain", Nature. 1998 Apr 30;392(6679):941-5.
- ↑ Yamada H, Tada-Oikawa S, Uchida A, Kawanishi S. "TRAIL causes cleavage of bid by caspase-8 and loss of mitochondrial membrane potential resulting in apoptosis in BJAB cells", Biochem Biophys Res Commun. 1999 Nov;265(1):130-3.
- ↑ Volkmann N, Marassi FM, Newmeyer DD, Hanein D. "The rheostat in the membrane: BCL-2 family proteins and apoptosis", Cell Death Differ. 2014 Feb;21(2):206-15. doi: 10.1038/cdd.2013.153. Epub 2013 Oct 25.
- ↑ Eskes R, Desagher S, Antonsson B, Martinou JC. "Bid induces the oligomerization and insertion of Bax into the outer mitochondrial membrane", Mol Cell Biol. 2000 Feb;20(3):929-35.
- ↑ Li P, Nijhawan D, Budihardjo I, Srinivasula SM, Ahmad M, Alnemri ES, Wang X. "Cytochrome c and dATP-dependent formation of Apaf-1/caspase-9 complex initiates an apoptotic protease cascade", Cell. 1997 Nov 14;91(4):479-89.
- ↑ Malladi S, Challa-Malladi M, Fearnhead HO, Bratton SB. "The Apaf-1*procaspase-9 apoptosome complex functions as a proteolytic-based molecular timer", EMBO J. 2009 Jul 8;28(13):1916-25. doi: 10.1038/emboj.2009.152. Epub 2009 Jun 4.
- ↑ Verhagen AM, Ekert PG, Pakusch M, Silke J, Connolly LM, Reid GE, Moritz RL, Simpson RJ, Vaux DL. "Identification of DIABLO, a mammalian protein that promotes apoptosis by binding to andantagonizing IAP proteins", Cell. 2000 Jul 7;102(1):43-53.
- ↑ Verhagen AM, Silke J, Ekert PG, Pakusch M, Kaufmann H, Connolly LM, Day CL, Tikoo A, Burke R, Wrobel C, Moritz RL, Simpson RJ, Vaux DL. "HtrA2 promotes cell death through its serine protease activity and its ability to antagonize inhibitor of apoptosis proteins", J Biol Chem. 2002 Jan 4;277(1):445-54. Epub 2001 Oct 16.
- ↑ Cregan SP, Dawson VL, Slack RS."Role of AIF in caspase-dependent and caspase-independent cell death", Oncogene. 2004 Apr 12;23(16):2785-96.
- ↑ http://www.protocol-online.org/prot/Cell_Biology/Apoptosis/Terminal_Transferase_dUTP_Nick_End_Labeling__TUNEL__Assay/
- ↑ Academic Emergency Medicine - Wiley Online Library
- ↑ [PDF]Contrasting effects of NO and peroxynitrites on HSP70 expression and apoptosis in human monocytes
- ↑ Functional studies of an HIV-1 encoded glutathione... Biofactors. 2006 - PubMed result
- ↑ Athanasiou A, Smith PA, Vakilpour S, et al (2007). Vanilloid receptor agonists and antagonists are mitochondrial inhibitors: how vanilloids cause non-vanilloid receptor mediated cell death. Biochem. Biophys. Res. Commun. 354 (1): 50–5. doi:10.1016/j.bbrc.2006.12.179. PMID 17214968.
- ↑ http://books.google.com/books?id=9qrcIMek6oIC&pg=PA47&lpg=PA47&dq=Daniel+Scott-Algara&source=bl&ots=1-zgFPuFCK&sig=2W6VOC-yRi2-VKgHKqOhAr2xKgM&hl=fr&ei=QJUXTOaBL5SV4gbctu2GDA&sa=X&oi=book_result&ct=result&resnum=9&ved=0CEEQ6AEwCA#v=onepage&q=Daniel%20Scott-Algara&f=false
- ↑ http://www.pasteur.fr/actu/presse/com/dossiers/Sida/recherchesIPParis.htm
Voir aussi
Bibliographie
|
|
Des informations de cet article ou section devraient être mieux reliées aux sources mentionnées dans la bibliographie ou en liens externes. Améliorez sa vérifiabilité en les associant par des références.
|
- Jean-Claude Ameisen, La Sculpture du vivant : Le suicide cellulaire ou la mort créatrice, Point Seuil, 2003.
- Ph.J. Coulomb et J.M. Lacombe, « Le brunissement des olives », PDF de la Faculté des Sciences d’Avignon, , p. 10 (lire en ligne)
Articles connexes
Liens externes
- Cell Death & Differentiation : la revue scientifique internationale sur l'apoptose.
- Portail de la biologie cellulaire et moléculaire
- Portail de la mort