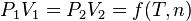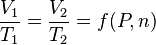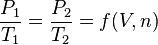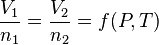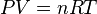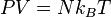Loi des gaz parfaits
Cet article traite de l'équation d'état applicable aux gaz parfaits, appelée loi des gaz parfaits ou équation des gaz parfaits.
Historique
Les premières lois physiques fondamentales relatives aux gaz furent énoncées entre le milieu du XVIIe siècle et le milieu du XVIIIe siècle, lorsque les savants constatèrent que certaines relations entre pression, volume et température demeuraient vérifiées indépendamment de la nature du gaz. Les lois des gaz décrivent le comportement des gaz lorsqu'on maintient constant l'une des variables d'état – volume, pression ou température – et que l'on étudie comment les deux autres variables changent l'une en fonction de l'autre. Ces lois ne sont toutefois applicables qu'à des pressions modérées (moins de 10 atm), pour des gaz dits « parfaits ». La loi des gaz parfaits résume ces diverses lois en une seule formule.
Aujourd'hui, à l'inverse, la loi des gaz parfaits est déduite de la théorie cinétique des gaz. Celle-ci est fondée sur un modèle de gaz idéal dont les particules constitutives (atomes ou molécules) sont réduites à des points matériels n'ayant entre eux d'autre relation que des chocs parfaitement élastiques. Les autres lois sont alors des conséquences de la loi des gaz parfaits.
Loi de Boyle-Mariotte
La loi de Boyle-Mariotte est souvent appelée « loi de Boyle » par les anglophones, « loi de Mariotte » ou « loi de Boyle-Mariotte » par les francophones. Elle fut établie en 1662 par Robert Boyle et confirmée en 1676 par l'abbé Edmé Mariotte.
La loi de Boyle-Mariotte spécifie qu'à température constante, la pression est inversement proportionnelle au volume et réciproquement. On met expérimentalement cette loi en évidence à l'aide d'un récipient hermétique de volume variable équipé d'un manomètre. Lorsqu'on réduit le volume, en veillant à ce que la température demeure constante, la pression augmente en proportion inverse, et le coefficient de proportionnalité est le même quel que soit le gaz utilisé.
Si le gaz contenu dans le récipient passe de l'état 1 (P1, V1) à l'état 2 (P2, V2) :
où P est la pression, V le volume de gaz et 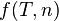 dépend de la température T et de la quantité de matière n, constantes entre les états 1 et 2.
dépend de la température T et de la quantité de matière n, constantes entre les états 1 et 2.
Loi de Charles
Quand la pression d'un gaz reste constante, le volume d'une quantité donnée d'un gaz varie proportionnellement à la température absolue. Si le gaz contenu dans le récipient passe de l'état 1 (V1, T1) à l'état 2 (V2, T2) :
où 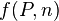 dépend de la pression P et de la quantité de matière n, constantes entre les états 1 et 2.
dépend de la pression P et de la quantité de matière n, constantes entre les états 1 et 2.
La température T est mesurée dans une échelle absolue qui a son origine au zéro absolu. Dans le système SI, elle est mesurée en kelvins.
Loi de Gay-Lussac
Si le volume reste constant, la pression d'une quantité donnée d'un gaz varie proportionnellement à la température absolue. Si le gaz contenu dans le récipient passe de l'état 1 (P1, T1) à l'état 2 (P2, T2) :
où 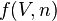 dépend du volume V et de la quantité de matière n, constants entre les états 1 et 2.
dépend du volume V et de la quantité de matière n, constants entre les états 1 et 2.
La température T est mesurée dans une échelle absolue qui a son origine au zéro absolu. Dans le système SI, elle est mesurée en kelvins.
Loi d'Avogadro
La loi d'Avogadro, appelée aussi « loi d'Avogadro-Ampère » spécifie que des volumes égaux de gaz parfaits différents, aux mêmes conditions de température et de pression, contiennent le même nombre de molécules, autrement dit qu'à pression et température données, les gaz parfaits ont tous le même volume molaire.
La relation entre nombre de particules et volume, à pression et température constante, est donnée par :
où n est la quantité de matière, et où 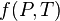 dépend de la pression et de la température, constantes entre les états 1 et 2.
dépend de la pression et de la température, constantes entre les états 1 et 2.
L'énoncé d'Avogadro a été formulé simultanément et indépendamment par Avogadro et Ampère en 1811.
Cette loi n'a pas le même statut que les lois précédentes : ce n'est pas une loi expérimentale mais une hypothèse, postulant la nature atomique de la matière à une époque où cette hypothèse atomique était purement spéculative. Elle résultait toutefois de résultats expérimentaux, connus depuis Lavoisier, sur la dissociation et la synthèse de gaz tels que la vapeur d'eau et l'acide chlorhydrique.
L'hypothèse d'Avogadro-Ampère n'a pris force de loi qu'à la fin du XIXe siècle, suite aux succès de la théorie cinétique des gaz (1866) et lorsque de multiples résultats d'expériences, dont la détermination du nombre d'Avogadro par Jean Perrin (1900)[1], conduisirent à considérer l'hypothèse atomique comme un fait expérimental.
Loi de Dalton
La loi de Dalton (ou loi des pressions partielles) établit que la pression d'un mélange de gaz parfaits dans un volume V et à une température T est la somme des pressions partielles des composants du mélange :
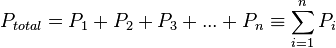 ,
,
où 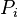 est la pression partielle du constituant i, c'est-à-dire la pression qu'aurait ce gaz s'il occupait seul le volume V à la température T.
est la pression partielle du constituant i, c'est-à-dire la pression qu'aurait ce gaz s'il occupait seul le volume V à la température T.
Équation des gaz parfaits
L'équation des gaz parfaits, ou loi des gaz parfaits, résulte de la combinaison des cinq lois précédentes reliant les quatre variables pression P, volume V, température T et quantité (nombre de moles) n de gaz :
où la constante 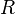 appelée « constante des gaz parfaits » vaut 8,3144621 J⋅mol-1⋅K-1. Une formulation équivalente est donnée par :
appelée « constante des gaz parfaits » vaut 8,3144621 J⋅mol-1⋅K-1. Une formulation équivalente est donnée par :
où :
-
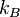 = 1,381×10-23 J⋅K-1 est la constante de Boltzmann ;
= 1,381×10-23 J⋅K-1 est la constante de Boltzmann ; -
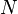 est le nombre de particules :
est le nombre de particules : 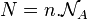 avec
avec 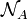 le nombre d'Avogadro, (
le nombre d'Avogadro, (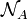 = 6,022 141 29(27)×1023 mol−1).
= 6,022 141 29(27)×1023 mol−1).
On notera que 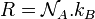 .
.
D'autre part, si le gaz parfaits est composé de k espèces différentes, chaque espèce i étant représentée par une quantité 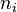 , alors la loi des gaz parfaits s'écrit :
, alors la loi des gaz parfaits s'écrit :
Équation des gaz parfaits : 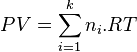 |
La loi des gaz parfaits n'est exacte que pour les gaz pour lesquels les effets des diverses interactions moléculaires sont négligeables (voir gaz réel). Cependant, cette loi constitue une bonne approximation des propriétés de la plupart des gaz réels sous pression (moins de 10 atm) et température modérées.
Notes et références
- ↑ Jean Perrin, Les atomes ; Félix Alcan, Paris, 1913. Réédition Flammarion, Paris, 1991, ISBN 2-08-081225-4
Voir aussi
Bibliographie
- (en) Joseph F. Castka, H. Clark Metcalfe, Raymond E. Davis et John E. Williams, Modern Chemistry, Holt, Rinehart and Winston, (ISBN 0-03-056537-5)
- (en) Ian Guch, The Complete Idiot's Guide to Chemistry, Alpha, Penguin Group Inc., (ISBN 1-59257-101-8)
- (en) Steven S. Zumdahl, Chemical Principles, Houghton Millfin Company, (ISBN 0-395-83995-5)
Articles connexes
- Gaz parfait
- Gaz réel
- Mélange de gaz parfaits
- Portail de la physique
- Portail de la chimie