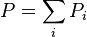Loi de Dalton
La loi de Dalton (nommée en l'honneur du physicien britannique John Dalton, qui en fait la découverte empirique en 1801), ou loi des pressions partielles, est une loi physique de la thermodynamique énonçant que dans le cas de gaz parfaits, la pression totale exercée par un mélange est égale à la somme des pressions partielles des constituants. Cette loi est une conséquence de l'équation des gaz parfaits. Elle suppose que chacune des molécules qui constituent le gaz parfait n'interagit pas avec les autres molécules de celui-ci.
L'énoncé de cette loi est :
où 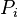 désigne la pression partielle du gaz
désigne la pression partielle du gaz 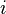 , c'est-à-dire la pression qu'aurait le gaz parfait
, c'est-à-dire la pression qu'aurait le gaz parfait 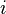 s'il occupait seul tout le volume à la même température.
s'il occupait seul tout le volume à la même température.
Voir aussi
Articles connexes
- Gaz parfait
- Loi des gaz parfaits
- Mélange de gaz parfaits
Liens extérieurs
- Bibliothèque virtuelle Allô Prof - Loi de Dalton
- Portail de la physique
- Portail de la chimie