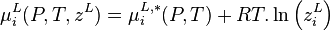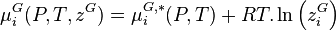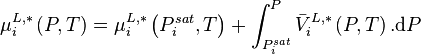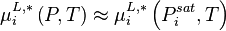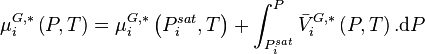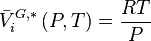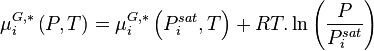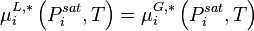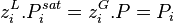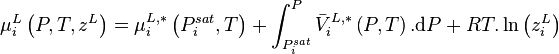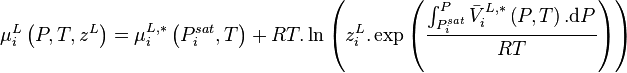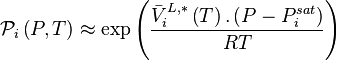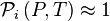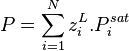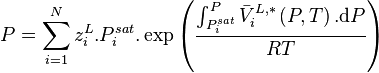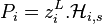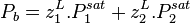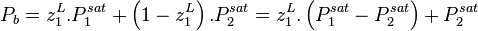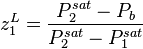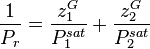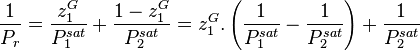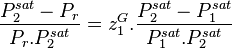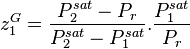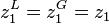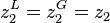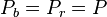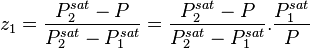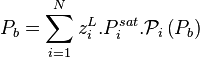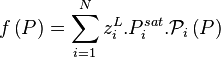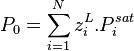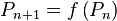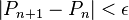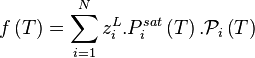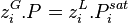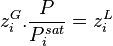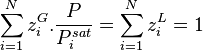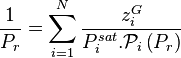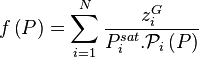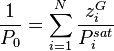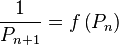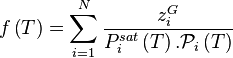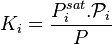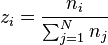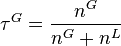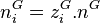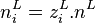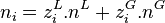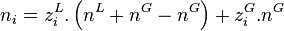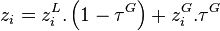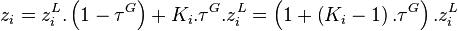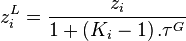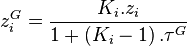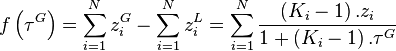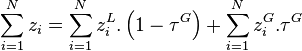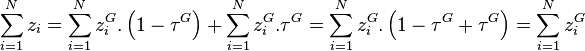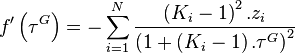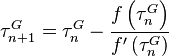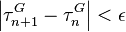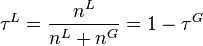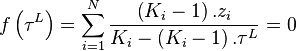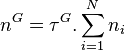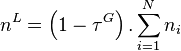Loi de Raoult
La loi de Raoult est une loi empirique de la thermodynamique émise par le physicien français François-Marie Raoult en 1882, dérivée de sa loi de la tonométrie. Elle dit que la pression totale d'une solution idéale liquide est égale à la somme des pressions de vapeur saturante de ses constituants pondérées par les fractions molaires de ceux-ci. Cette loi est utilisée dans de nombreux domaines de la chimie, de la physique et de la météorologie. Elle permet notamment de calculer les équilibres liquide-vapeur des solutions idéales liquides dont la phase vapeur est considérée comme un mélange de gaz parfaits.
Énoncé et démonstration
Énoncé
La loi de Raoult s'énonce ainsi :
« Dans une solution idéale, la pression partielle en phase vapeur d'un constituant est proportionnelle à sa fraction molaire en phase liquide. »
Étant donné que pour le corps pur la pression est égale à sa pression de vapeur saturante, le coefficient de proportionnalité est bien entendu égal à cette pression. La forme mathématique de la loi de Raoult s'écrit, pour un mélange de N composants :
| Loi de Raoult Pression partielle de i : 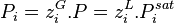 Pression totale : 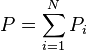 |
avec les notations :
-
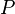 , pression totale du mélange ;
, pression totale du mélange ; -
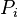 , pression partielle du composant i, par définition
, pression partielle du composant i, par définition 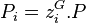 ;
; -
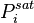 , pression de vapeur saturante du composant i pur à T du mélange ;
, pression de vapeur saturante du composant i pur à T du mélange ; -
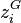 , fraction molaire du constituant i dans la phase vapeur ;
, fraction molaire du constituant i dans la phase vapeur ; -
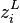 , fraction molaire du constituant i dans la phase liquide.
, fraction molaire du constituant i dans la phase liquide.
Solution idéale et gaz parfaits
Pour qu'une solution liquide obéisse à la loi de Raoult, chaque constituant doit vérifier les deux relations suivantes sur ses potentiels chimiques dans les deux phases :
avec les notations :
-
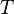 , température du mélange ;
, température du mélange ; -
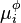 , potentiel chimique du composant i du mélange dans la phase
, potentiel chimique du composant i du mélange dans la phase 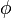 (L ou G) ;
(L ou G) ; -
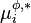 , potentiel chimique du composant i pur dans la phase
, potentiel chimique du composant i pur dans la phase 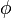 (L ou G) ;
(L ou G) ; -
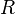 , constante universelle des gaz parfaits.
, constante universelle des gaz parfaits.
Autrement dit, la loi de Raoult n'est valable que si le liquide et sa vapeur sont tous deux des solutions idéales, la phase gaz étant de surcroît un mélange de gaz parfaits. L'application de la loi de Raoult est donc restreinte à des cas particuliers, pour certains mélanges de produits et certaines plages de température et de pression. Elle constitue néanmoins une base pour calculer les propriétés des mélanges réels à l'aide de facteurs correctifs tels que les coefficients de fugacité pour la phase gaz et les coefficients d'activité pour la phase liquide :
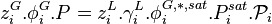
avec :
-
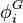 , coefficient de fugacité du corps i en phase gaz, à P, T et composition du mélange gazeux ;
, coefficient de fugacité du corps i en phase gaz, à P, T et composition du mélange gazeux ; -
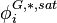 , coefficient de fugacité du corps i pur à saturation en phase gaz, à
, coefficient de fugacité du corps i pur à saturation en phase gaz, à 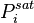 et T ;
et T ; -
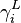 , coefficient d'activité du corps i en phase liquide, à P, T et composition du mélange liquide ;
, coefficient d'activité du corps i en phase liquide, à P, T et composition du mélange liquide ; -
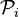 , correction de Poynting (voir plus bas).
, correction de Poynting (voir plus bas).
Démonstration
Il est à noter que la loi de Raoult a été établie empiriquement par son auteur, sur base de sa loi de la tonométrie pour les liquides et de la loi de Dalton pour les gaz. La démonstration rigoureuse qui suit est postérieure au développement du formalisme mathématique de la thermodynamique par Willard Gibbs qui introduisit notamment la notion de potentiel chimique, et par Gilbert Lewis qui introduisit les notions de fugacité et d'activité chimique.
Dans une solution à l'équilibre, les potentiels chimiques de la phase liquide et de la phase vapeur sont égaux pour chaque constituant i :
- (1)
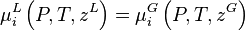
Pour la phase liquide et la phase vapeur, considérées comme des solutions idéales, les potentiels chimiques sont développés selon :
- (2)
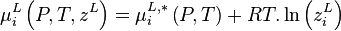
- (3)
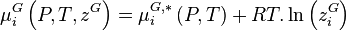
La variation isotherme du potentiel chimique en fonction de la pression permet d'écrire pour le composant i pur en phase liquide :
avec 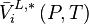 volume molaire du composant i liquide pur à P et T. Le dernier terme est appelé correction de Poynting et est généralement négligé, soit :
volume molaire du composant i liquide pur à P et T. Le dernier terme est appelé correction de Poynting et est généralement négligé, soit :
ceci traduit le fait que les liquides sont généralement peu sensibles à la pression et sont considérés comme incompressibles. En introduisant cette relation dans (2), il vient :
- (4)
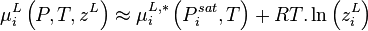
La variation isotherme du potentiel chimique en fonction de la pression permet d'écrire pour le composant i pur en phase vapeur considéré comme un gaz parfait :
Avec 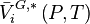 volume molaire du gaz parfait :
volume molaire du gaz parfait :
En introduisant cette relation dans (3), il vient :
- (5)
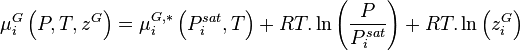
Les relations (4) et (5) permettent donc de réécrire la relation (1) selon :
- (6)
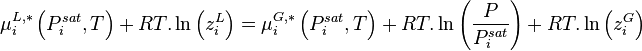
La relation (1) étant aussi valable pour un corps pur à l'équilibre liquide-vapeur (saturation), celui-ci à la température T étant à sa pression de vapeur saturante 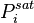 , il vient :
, il vient :
La relation (6) produit donc :
Comme par définition des fractions molaires :
Alors :
Correction de Poynting
Si l'on ne néglige pas le terme 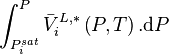 dans l'expression du potentiel chimique en phase liquide, celui-ci dans la relation (4) s'exprime exactement selon :
dans l'expression du potentiel chimique en phase liquide, celui-ci dans la relation (4) s'exprime exactement selon :
avec 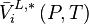 volume molaire du composant i liquide pur à P et T.
volume molaire du composant i liquide pur à P et T.
Le terme 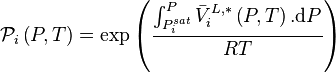 est appelé correction de Poynting.
est appelé correction de Poynting.
La loi de Raoult avec correction de Poynting devient :
| Loi de Raoult et correction de Poynting Pression partielle de i : 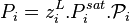 Pression totale : 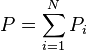 |
Les liquides étant peu compressibles, le volume molaire liquide 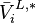 est souvent considéré comme indépendant de la pression, auquel cas :
est souvent considéré comme indépendant de la pression, auquel cas :
À basse pression (moins de 10 atm, domaine d'application de la loi des gaz parfaits), la correction de Poynting est négligeable :
Avec la loi de Raoult sans correction de Poynting, connaissant pour un mélange liquide sa composition (fractions molaires 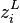 ) et la pression de vapeur saturante de chacun des composants
) et la pression de vapeur saturante de chacun des composants 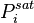 à la température T, la pression se calcule explicitement selon :
à la température T, la pression se calcule explicitement selon :
La loi de Raoult avec correction de Poynting nécessite un calcul itératif, puisque l'expression est implicite en P :
Limites de la loi de Raoult
Écarts avec la réalité
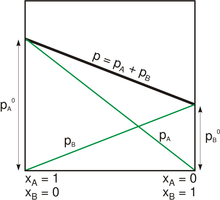
La loi de Raoult s’applique à des systèmes idéaux dans lesquels les interactions entre molécules de même espèce ou d'espèces différentes sont toutes identiques. Les écarts peuvent être positifs ou négatifs selon l'attraction électronique des composants de la solution.
- Écart positif
- Lorsque dans une solution constituée de deux constituants A et B, les molécules du même constituant (A ou B) s'attirent plus fortement que les molécules A et B entre elles, l’ajout par exemple de molécules B dans un liquide A pur a pour effet de diminuer les forces d’attraction entre les molécules A et la volatilité de A est augmentée. Il y a alors une déviation positive par rapport à la loi de Raoult : la pression totale de la vapeur en équilibre au-dessus de la solution est supérieure à celle calculée.
- Écart négatif
- Si par contre, les molécules A et B sont plus attirées entre elles que par celles du même constituant, l'ajout de molécules B au liquide A pur augmente les forces d’attraction auxquelles sont soumises les molécules A et elles deviennent moins volatiles. Il y a alors une déviation négative par rapport à la loi de Raoult : la pression totale de la vapeur en équilibre au-dessus de la solution est inférieure à celle calculée.
Cas des gaz dissouts, loi de Henry
La loi de Raoult s'applique à des composants qui présentent une pression de vapeur saturante 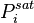 à la température T du mélange. Pour un gaz dissout, c'est-à-dire un fluide supercritique dont la température critique est inférieure à la température du mélange :
à la température T du mélange. Pour un gaz dissout, c'est-à-dire un fluide supercritique dont la température critique est inférieure à la température du mélange : 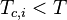 , la loi de Raoult n'est pas applicable, puisque le gaz ne possède pas de pression de vapeur saturante à cette température. Pour les gaz dissouts, le pendant de la loi de Raoult est la loi de Henry.
, la loi de Raoult n'est pas applicable, puisque le gaz ne possède pas de pression de vapeur saturante à cette température. Pour les gaz dissouts, le pendant de la loi de Raoult est la loi de Henry.
La loi de Henry établit la relation suivante entre la pression partielle 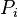 d'un constituant gazeux et sa fraction molaire
d'un constituant gazeux et sa fraction molaire 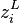 dans un solvant liquide s :
dans un solvant liquide s :
où 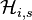 est appelé constante de Henry, bien qu'elle dépende de la température et de la pression. La constante de Henry est spécifique du gaz i dans le solvant s, c'est-à-dire qu'elle doit être déterminée pour chaque couple « gaz i - solvant s » et n'est pas valable si le gaz i est considéré avec un solvant autre que le solvant s pour lequel elle a été déterminée.
est appelé constante de Henry, bien qu'elle dépende de la température et de la pression. La constante de Henry est spécifique du gaz i dans le solvant s, c'est-à-dire qu'elle doit être déterminée pour chaque couple « gaz i - solvant s » et n'est pas valable si le gaz i est considéré avec un solvant autre que le solvant s pour lequel elle a été déterminée.
Les azéotropes
La loi de Raoult est fondamentalement incapable de représenter des azéotropes, c'est-à-dire des mélanges pour lesquels dans certaines conditions de pression, température et composition, le liquide et la vapeur en équilibre ont la même composition. Dans ces conditions, à température et composition données, la pression de bulle et la pression de rosée (voir plus bas) sont égales, or la loi de Raoult ne peut reproduire ce phénomène que pour les corps purs.
Soit un mélange binaire présentant un azéotrope (par exemple le mélange eau-éthanol). On note :
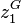 et
et 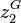 , les fractions molaires en phase vapeur ;
, les fractions molaires en phase vapeur ;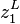 et
et 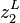 , les fractions molaires en phase liquide ;
, les fractions molaires en phase liquide ;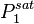 et
et 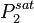 , les pressions de vapeur saturante à la température T ;
, les pressions de vapeur saturante à la température T ;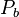 , la pression de bulle (voir définition plus bas) à la température T ;
, la pression de bulle (voir définition plus bas) à la température T ;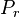 , la pression de rosée (voir définition plus bas) à la température T.
, la pression de rosée (voir définition plus bas) à la température T.
On cherche la composition de l'azéotrope, point auquel 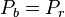 .
.
La pression de bulle est calculée par (voir démonstration plus bas) :
avec la contrainte sur les fractions molaires 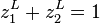 , on peut réécrire :
, on peut réécrire :
La pression de rosée est calculée par (voir démonstration plus bas) :
avec la contrainte sur les fractions molaires 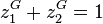 , on peut réécrire :
, on peut réécrire :
Au point d'azéotrope, on a :
soit :
Cette équation n'admet que deux solutions :
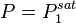 , auquel cas
, auquel cas 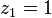 et
et 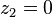 , le corps 1 est pur ;
, le corps 1 est pur ;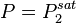 , auquel cas
, auquel cas 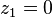 et
et 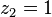 , le corps 2 est pur.
, le corps 2 est pur.
Calcul d'un équilibre liquide-vapeur
Point de bulle
Pression de bulle
Le problème est le suivant :
« Soit un mélange liquide de N composants, chaque composant i étant représenté par sa fraction molaire
, à la température T ; calculer la pression de bulle
du mélange. »
La pression de bulle d'un mélange, à température donnée, est la pression au-delà de laquelle (pour des pressions plus fortes) le mélange est entièrement liquide : à la pression de bulle apparaît la première bulle de vapeur. En deçà de la pression de bulle (pour des pressions plus faibles), le mélange présente un équilibre liquide-vapeur, ou est entièrement gazeux (en deçà de la pression de rosée).
Nous connaissons la température T du mélange, nous pouvons donc calculer la pression de vapeur saturante 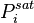 de chacun des composants. La composition de la phase liquide est connue. La pression de bulle
de chacun des composants. La composition de la phase liquide est connue. La pression de bulle 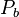 se calcule alors simplement par :
se calcule alors simplement par :
Pression de bulle : 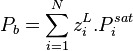 |
Toutefois, avec la correction de Poynting  , le calcul n'est pas explicite. En effet, l'équation à résoudre en P devient :
, le calcul n'est pas explicite. En effet, l'équation à résoudre en P devient :
On pourra employer la méthode du point fixe. Soit la fonction 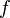 de P :
de P :
On initialise le calcul par la solution obtenue par la loi de Raoult sans correction de Poynting :
puis on calcule la pression 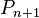 à partir de la pression
à partir de la pression 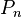 obtenue à l'itération précédente par :
obtenue à l'itération précédente par :
jusqu'à un écart  acceptable :
acceptable :
Température de bulle
Le problème est le suivant :
« Soit un mélange liquide de N composants, chaque composant i étant représenté par sa fraction molaire
, à la pression P ; calculer la température de bulle
du mélange. »
La température de bulle d'un mélange, à pression donnée, est la température en deçà de laquelle (pour des températures plus faibles) le mélange est entièrement liquide : à la température de bulle apparaît la première bulle de vapeur. Au-delà de la température de bulle (pour des températures plus fortes), le mélange présente un équilibre liquide-vapeur, ou est entièrement gazeux (au-delà de la température de rosée).
La solution n'est pas explicite, car l'expression de la loi de Raoult (avec ou sans correction de Poynting) n'est pas explicite en température. La pression étant donnée et la température étant l'inconnue, les pressions de vapeur saturante 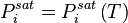 et les corrections de Poynting
et les corrections de Poynting  sont des fonctions de T . Si l'on pose la fonction
sont des fonctions de T . Si l'on pose la fonction 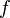 de la température T :
de la température T :
la température de bulle 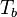 est la solution de l'équation :
est la solution de l'équation : 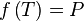 , la pression P étant une donnée du problème.
, la pression P étant une donnée du problème.
Point de rosée
Pression de rosée
Le problème est le suivant :
« Soit un mélange gazeux de N composants, chaque composant i étant représenté par sa fraction molaire
, à la température T ; calculer la pression de rosée
du mélange. »
La pression de rosée d'un mélange, à température donnée, est la pression en deçà de laquelle (pour des pressions plus faibles) le mélange est entièrement gazeux : à la pression de rosée apparaît la première goutte de liquide. Au-delà de la pression de rosée (pour des pressions plus fortes), le mélange présente un équilibre liquide-vapeur, ou est entièrement liquide (au-delà de la pression de rosée).
Nous connaissons la température T du mélange, nous pouvons donc calculer la pression de vapeur saturante 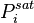 de chacun des composants. La composition de la phase vapeur est connue.
de chacun des composants. La composition de la phase vapeur est connue.
La loi de Raoult sans correction de Poynting donne pour tout constituant i :
soit, en sommant sur l'ensemble des constituants :
La pression de rosée 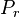 se calcule alors simplement par :
se calcule alors simplement par :
Pression de rosée : 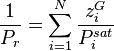 |
Toutefois, avec la correction de Poynting  , le calcul n'est pas explicite. En effet, l'équation à résoudre en P devient :
, le calcul n'est pas explicite. En effet, l'équation à résoudre en P devient :
On pourra employer la méthode du point fixe. Soit la fonction 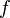 de P :
de P :
On initialise le calcul par la solution obtenue par la loi de Raoult sans correction de Poynting :
puis on calcule la pression 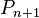 à partir de la pression
à partir de la pression 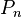 obtenue à l'itération précédente par :
obtenue à l'itération précédente par :
jusqu'à un écart  acceptable :
acceptable :
Température de rosée
Le problème est le suivant :
« Soit un mélange gazeux de N composants, chaque composant i étant représenté par sa fraction molaire
, à la pression P ; calculer la température de rosée
du mélange. »
La température de rosée d'un mélange, à pression donnée, est la température au-delà de laquelle (pour des températures plus fortes) le mélange est entièrement gazeux : à la température de rosée apparaît la première goutte de liquide. En deçà de la température de rosée (pour des températures plus faibles), le mélange présente un équilibre liquide-vapeur, ou est entièrement liquide (en deçà de la température de bulle).
La solution n'est pas explicite, car l'expression de la loi de Raoult (avec ou sans correction de Poynting) n'est pas explicite en température. La pression étant donnée et la température étant l'inconnue, les pressions de vapeur saturante 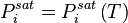 et les corrections de Poynting
et les corrections de Poynting  sont des fonctions de T . Si l'on pose la fonction
sont des fonctions de T . Si l'on pose la fonction 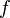 de la température T :
de la température T :
la température de rosée 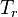 est la solution de l'équation :
est la solution de l'équation : 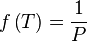 , la pression P étant une donnée du problème.
, la pression P étant une donnée du problème.
Calcul d'un équilibre liquide-vapeur
Énoncé du problème
Le problème est le suivant :
« Soit, à pression P et température T données, un mélange de N constituants, chaque constituant i étant représenté par la quantité
. Calculer la composition des phases vapeur et liquide en présence. »
Nous avons donc 2.N inconnues, il s'agit en effet de calculer pour chacun des N constituants :
-
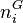 , la quantité du constituant i en phase vapeur ;
, la quantité du constituant i en phase vapeur ; -
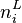 , la quantité du constituant i en phase liquide.
, la quantité du constituant i en phase liquide.
Soient :
-
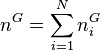 , la quantité de matière totale en phase vapeur ;
, la quantité de matière totale en phase vapeur ; -
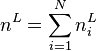 , la quantité de matière totale en phase liquide ;
, la quantité de matière totale en phase liquide ; -
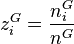 , la fraction molaire du constituant i en phase vapeur ;
, la fraction molaire du constituant i en phase vapeur ; -
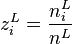 , la fraction molaire du constituant i en phase liquide.
, la fraction molaire du constituant i en phase liquide.
La pression et la température étant données, les pressions de vapeur saturante 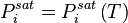 et les corrections de Poynting
et les corrections de Poynting 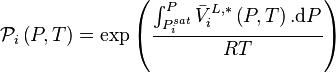 sont des constantes. On définit pour chacun des N constituants le coefficient de partage
sont des constantes. On définit pour chacun des N constituants le coefficient de partage 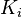 , qui est une constante en appliquant la loi de Raoult à pression et température données :
, qui est une constante en appliquant la loi de Raoult à pression et température données :
Nous avons les 2.N équations :
- équilibres chimiques selon la loi de Raoult :
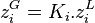
- bilans de matière :
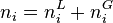
Réduction du problème
Soit pour chacun des N constituants la fraction molaire globale 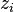 :
:
Puisque l'on connaît la quantité de matière 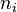 de chacun des N constituants, les fractions molaires
de chacun des N constituants, les fractions molaires 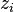 sont donc connues également.
sont donc connues également.
On définit d'autre part 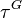 la fraction molaire globale de la phase vapeur, ou taux de vaporisation :
la fraction molaire globale de la phase vapeur, ou taux de vaporisation :
On a par définition des fractions molaires dans les deux phases :
En introduisant ces relations dans le bilan de matière de chacun des N constituants :
et en divisant par 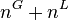 on obtient pour chacun des N constituants :
on obtient pour chacun des N constituants :
En substituant dans cette dernière relation l'équation d'équilibre chimique du constituant i :
On remarquera que si 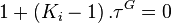 , alors
, alors 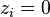 : le constituant i n'est pas présent dans le mélange ; ce cas est donc exclu. On peut donc écrire :
: le constituant i n'est pas présent dans le mélange ; ce cas est donc exclu. On peut donc écrire :
d'où également, toujours d'après la relation de l'équilibre chimique :
Dans les expressions des fractions 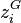 et
et 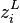 ainsi établies, seul le taux de vaporisation
ainsi établies, seul le taux de vaporisation 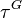 est inconnu. Nous pouvons donc réduire le problème à la recherche de cette seule inconnue. Soit la fonction
est inconnu. Nous pouvons donc réduire le problème à la recherche de cette seule inconnue. Soit la fonction 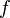 de
de 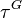 définie par :
définie par :
Cette fonction est monotone strictement décroissante en 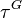 pour
pour 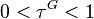 . Si l'on trouve sur cette plage une solution à l'équation
. Si l'on trouve sur cette plage une solution à l'équation 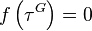 , elle est unique et
, elle est unique et 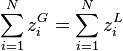 .
.
Il reste à prouver que cette solution respecte les contraintes sur les fractions molaires, soit 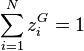 et
et 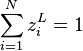 . Revenons à la relation pour chacun des constituants :
. Revenons à la relation pour chacun des constituants :
En sommant sur l'ensemble des constituants :
or puisque 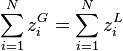 , alors :
, alors :
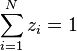 , d'où
, d'où 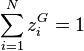 et
et 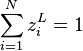 .
.Le système de 2.N équations à 2.N inconnues est réduit à une équation à une inconnue, 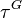 , due à Rachford et Rice (1952)[1] :
, due à Rachford et Rice (1952)[1] :
Équation de Rachford-Rice : 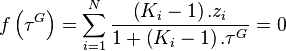 |
On pourra résoudre cette équation sur l'intervalle 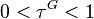 par la méthode de Newton, en considérant la dérivée
par la méthode de Newton, en considérant la dérivée 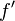 de la fonction
de la fonction 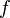 :
:
On initialisera le calcul avec 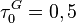 , puis on procèdera par itérations successives selon :
, puis on procèdera par itérations successives selon :
jusqu'à un écart  acceptable :
acceptable :
- Note - autre forme de l'équation de Rachford-Rice
- Plutôt que de rechercher le taux de vaporisation
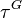 , on peut rechercher le taux de liquéfaction
, on peut rechercher le taux de liquéfaction 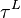 défini par :
défini par :
- L'équation de Rachford-Rice se présente alors sous la forme :
- Cette fonction est monotone strictement croissante en
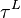 pour
pour 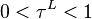 .
.
Résolution du problème
Avant de calculer un équilibre liquide-vapeur, il faut vérifier que le mélange n'est pas entièrement liquide ou gazeux. Pour cela :
- calculer les fractions molaires globales
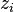 pour chacun des N constituants ;
pour chacun des N constituants ; - poser pour chacun des N constituants
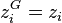 et à la température T calculer la pression de rosée
et à la température T calculer la pression de rosée 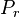 ; si
; si 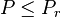 le mélange est entièrement gazeux ;
le mélange est entièrement gazeux ; - poser pour chacun des N constituants
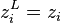 et à la température T calculer la pression de bulle
et à la température T calculer la pression de bulle 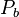 ; si
; si 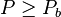 le mélange est entièrement liquide ;
le mélange est entièrement liquide ; - si
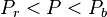 le mélange est biphasique et présente un équilibre liquide-vapeur.
le mélange est biphasique et présente un équilibre liquide-vapeur.
Si le mélange est biphasique, résoudre sur l'intervalle 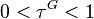 l'équation de Rachford-Rice :
l'équation de Rachford-Rice :
Les fractions molaires sont ensuite calculées par :
et les quantités globales respectives des deux phases par :
d'où l'on obtient finalement les quantités dans chaque phase pour chacun des N constituants :
Notes et références
- ↑ Rachford, H.H. and Rice, J.D. : Procedure for Use of Electrical Digital Computers in Calculating Flash Vaporization Hydrocarbon Equilibrium, Journal of Petroleum Technology (Oct. 1952) No. 4, 19-20 ; Trans., AIME, 195
Voir aussi
Articles connexes
- Loi de la tonométrie
- Loi de l'ébulliométrie
- Loi de la cryométrie
- Loi de Henry
- Solution idéale
- Théorème de Gibbs
- Fugacité
- Activité chimique
Publications
- La thermodynamique des solutions, E. Darmois, J. Phys. Radium 4, 7 (1943) 129-142
- Christophe Coquelet et Dominique Richon, « Propriétés thermodynamiques - Détermination pour les fluides purs », Techniques de l'ingénieur, base documentaire : Thermodynamique et énergétique, pack : Physique énergétique, univers : Énergies, BE 8030, pp. 1-8, 2007
- Christophe Coquelet et Dominique Richon, « Propriétés thermodynamiques - Détermination pour les mélanges », Techniques de l'ingénieur, base documentaire : Thermodynamique et énergétique, pack : Physique énergétique, univers : Énergies, BE 8031, pp. 1-12, 2007
- Jean-Pierre Corriou, « Thermodynamique chimique - Définitions et relations fondamentales », Techniques de l'ingénieur, base documentaire : Thermodynamique et cinétique chimique, pack : Opérations unitaires. Génie de la réaction chimique, univers : Procédés chimie - bio - agro, J 1025, pp. 1-19, 1984
- Jean-Pierre Corriou, « Thermodynamique chimique - Diagrammes thermodynamiques », Techniques de l'ingénieur, base documentaire : Thermodynamique et cinétique chimique, pack : Opérations unitaires. Génie de la réaction chimique, univers : Procédés chimie - bio - agro, J 1026, pp. 1-30, 1985
- Robert C. Reid, John M. Prausnitz et Bruce E. Poling, « The properties of gases and liquids », Mc Graw Hill, 4e éd., 1987 (ISBN 978-0070517998)
- Jean Vidal, « Thermodynamique », coll. Publications de l'Institut français du pétrole, Éditions Technip, 1997 (ISBN 978-2-7108-0715-5)
- Portail de la chimie
- Portail de la physique