Loi de Henry
|
|
Cet article est une ébauche concernant la thermodynamique. Vous pouvez partager vos connaissances en l’améliorant (comment ?) selon les recommandations des projets correspondants.
Consultez la liste des tâches à accomplir en page de discussion. |
La Loi de Henry, formulée en 1803 par William Henry, énonce :
À température constante et à saturation, la quantité de gaz dissous dans un liquide est proportionnelle à la pression partielle qu'exerce ce gaz sur le liquide.
La concentration maximale d'un gaz en solution, en équilibre avec une atmosphère contenant ce gaz, est proportionnelle à la pression partielle de ce gaz en ce point.
C’est-à-dire que si l'on est par exemple en un point où la pression est le double de la pression atmosphérique (c'est le cas dans l'eau à 10 m de profondeur), chaque gaz de l'air pourra se dissoudre 2 fois mieux qu'en surface. Ceci explique le problème des plongeurs : en profondeur, l'azote de l'air (que le plongeur stocke puisque les cellules ne consomment que l'oxygène) a tendance à se dissoudre dans l'organisme du plongeur (entre autres le sang). Si celui-ci remonte trop vite, l'azote dissous va avoir tendance à se dilater rapidement dans l'organisme, ce qui peut créer des bulles dans les vaisseaux sanguins et une mort par embolie gazeuse.
Formule
Cette loi établit une relation entre la pression partielle 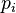 d'un corps pur gazeux et sa fraction molaire
d'un corps pur gazeux et sa fraction molaire 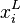 dans un solvant :
dans un solvant :
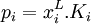
Cette loi mesure la solubilité d'un gaz dans un solvant liquide avec lequel ce gaz est en contact.
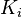 est une constante de la constante de volatilité spécifique du gaz donné. La constante de Henry, aussi notée
est une constante de la constante de volatilité spécifique du gaz donné. La constante de Henry, aussi notée 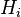 :
:
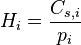
où :
-
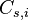 représente la concentration maximale (dite « à saturation ») du composé i
représente la concentration maximale (dite « à saturation ») du composé i -
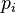 est la pression partielle du gaz
est la pression partielle du gaz -
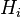 est la « constante de Henry » qui dépend de la nature du gaz, de la température, et du liquide.
est la « constante de Henry » qui dépend de la nature du gaz, de la température, et du liquide.
Il y a la relation 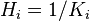 .
.
À titre d'exemples :
- Pour l'eau de mer,
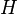 est 20 % inférieur à sa valeur pour l'eau douce, en raison de la compétition entre gaz dissous et sels dissous.
est 20 % inférieur à sa valeur pour l'eau douce, en raison de la compétition entre gaz dissous et sels dissous. - À pression atmosphérique normale, dans l'eau douce pour l'oxygène
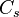 = 10 mg·l-1 à 12 °C, et 14 mg·l-1 à 0 °C.
= 10 mg·l-1 à 12 °C, et 14 mg·l-1 à 0 °C. - Le dioxyde de carbone en solution avec une boisson gazeuse ou de la bière s'échappe sous forme gazeuse lorsque le récipient est ouvert, car il y a alors sursaturation.
La loi de Henry établit un lien entre la pression partielle d'un corps pur gazeux en équilibre avec une solution qui contient également ce corps pur à l'état liquide dans une proportion importante. Dans la loi de Raoult, il n'y a pas de solvant à proprement parler : les deux corps purs du mélange sont dans des proportions de même ordre de grandeur.
Autres formes de la loi de Henry
Il existe d'autres formes de la loi de henry, discutées dans la littérature spécialisée[1],[2],[3].
| équation: | 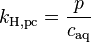 | 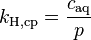 | 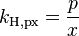 | 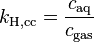 |
|---|---|---|---|---|
| unités: | 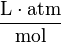 | 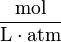 | 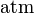 | sans dimension |
| O2 | 769,23 | 1,3×10−3 | 4,259×104 | 3,181×10-2 |
| H2 | 1282,05 | 7,8×10-4 | 7,099×104 | 1,907×10-2 |
| CO2 | 29,41 | 3,4×10-2 | 0,163×104 | 0,8317 |
| N2 | 1639,34 | 6,1×10-4 | 9,077×104 | 1,492×10-2 |
| He | 2702,7 | 3,7×10-4 | 14,97×104 | 9,051×10-3 |
| Ne | 2222,22 | 4,5×10-4 | 12,30×104 | 1,101×10-2 |
| Ar | 714,28 | 1,4×10-3 | 3,955×104 | 3,425×10-2 |
| CO | 1052,63 | 9,5×10-4 | 5,828×104 | 2,324×10-2 |
| où : | |
| caq | = concentration du gaz en solution (mol/L) |
| cgas | = concentration du gaz en phase vapeur (mol/L) |
| p | = pression partielle du gaz en phase vapeur (atm) |
| x | = fraction molaire du gaz en solution aqueuse (sans dimension) |
Comme on peut le voir en comparant les équations du tableau ci-dessus, la constante de Henry kH,pc est simplement l'inverse de la constante kH,cp. Comme toutes les constantes kH peuvent être considérées comme des constantes de la loi de Henry, les lecteurs de littérature spécialisée doivent être attentifs à noter quelle version de l'équation de la loi de Henry est utilisée[1].
Il faut également noter que la loi de Henry est une loi limitante qui s'applique seulement aux solutions suffisamment diluées. La gamme de concentrations à laquelle elle s'applique se restreint à mesure que le système diverge par rapport au comportement idéal - pour faire simple, cela signifie à mesure que le soluté a un comportement chimiquement différent du solvant. Typiquement, la loi de Henry s'applique uniquement si la fraction molaire du gaz dissout est inférieure à 0,03[4].
Elle s'applique uniquement aux solutions dans lesquelles le solvant ne réagit pas chimiquement avec le gaz dissout. Un exemple usuel dans lequel le gaz réagit avec le solvant est le dioxyde de carbone, qui forme partiellement, par réaction avec l'eau, de l'acide carbonique (H2CO3).
Voir aussi
Notes et références
- 1 2 (en) Francis L. Smith and Allan H. Harvey, « Avoid Common Pitfalls When Using Henry's Law », CEP (Chemical Engineering Progress), (ISSN 0360-7275)
- ↑ North Carolina State University CH 431/Lecture 14
- 1 2 An extensive list of Henry's law constants, and a conversion tool Après avoir lu les consignes, déroulez le menu vers la section intitulée "télécharger" (download) et cliquer sur le lien vers henry.pdf pour voir la liste (en anglais).
- ↑ (en) Prausnitz et al., Molecular Thermodynamics of Fluid Phase Equilibria, Prentice Hall, , 3e éd. (ISBN 0-13-977745-8, lire en ligne), p. 586
Articles Connexes
- Accident de décompression dû à la loi de Henry
- Physique
- Fugacité
- Activité chimique
- Loi de Raoult
Liens externes
- H. Lawrence Clever, Setchenov salt-effect parameter, J. Chem. Eng. Data, 1983, vol. 28(3), pp. 340–343. DOI:10.1021/je00033a018.
- [PDF]fiche NIST
- Portail de la chimie
- Portail de la physique
