Enthalpie libre
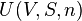 |
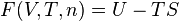 |
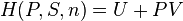 |
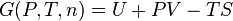 |
L'enthalpie libre (ou énergie libre de Gibbs, ou simplement énergie de Gibbs) est une fonction d'état introduite par Willard Gibbs, et généralement notée G. Elle est associée au deuxième principe de la thermodynamique, principe d’évolution des systèmes physico-chimiques.
Le second principe énonce que toute transformation réelle s’effectue avec création d’entropie, c’est-à-dire que le bilan entropique, correspondant à la somme des variations d'entropie du système et du milieu extérieur, est positif.
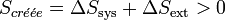 .
.
La fonction entropie peut être utilisée pour l’étude de l’évolution d’un système thermodynamique. En effet pour un système isolé l’entropie passe par un maximum à l’équilibre donc toute évolution doit aller dans ce sens.
En général, intuitivement on pense qu’un équilibre est atteint lorsque l’énergie est minimale. C’est le cas de l’énergie potentielle (gravitation, électromagnétisme…). Dans le cas de l’entropie, il faut étudier en plus du système, l’évolution de l’entropie du milieu extérieur.
Gibbs a défini une nouvelle fonction qui prend en compte ces deux remarques.
L’enthalpie libre  se comporte en effet comme une fonction potentielle et intègre le comportement du milieu extérieur. De plus elle est la fonction d'état la plus appropriée pour étudier les équilibres chimiques réalisés à température
se comporte en effet comme une fonction potentielle et intègre le comportement du milieu extérieur. De plus elle est la fonction d'état la plus appropriée pour étudier les équilibres chimiques réalisés à température 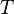 et à pression
et à pression 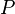 constantes, ce qui est le lot de nombreuses réactions effectuées à l'air libre, à la pression atmosphérique.
constantes, ce qui est le lot de nombreuses réactions effectuées à l'air libre, à la pression atmosphérique.
Définition
Considérons une réaction chimique effectuée à la température 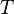 et à pression constante
et à pression constante 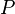 . On suppose ici que le travail n’est dû qu’aux forces de pression (pas de montage électrochimique donnant du travail électrique). Soit
. On suppose ici que le travail n’est dû qu’aux forces de pression (pas de montage électrochimique donnant du travail électrique). Soit 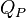 la chaleur mise en jeu par le système réactionnel. Comme la pression
la chaleur mise en jeu par le système réactionnel. Comme la pression 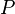 est constante, la variation d'enthalpie du système est égale à la chaleur mise en jeu :
est constante, la variation d'enthalpie du système est égale à la chaleur mise en jeu : 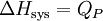 .
.
Appliquons le second principe :
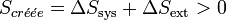
Or la chaleur fournie par le système est reçue par le milieu extérieur et réciproquement, donc son signe change lorsque l'on se place au niveau du système ou du milieu extérieur (règle des signes).
La variation d’entropie du milieu extérieur devient : 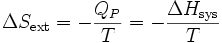 .
.
Le bilan entropique s’écrit :
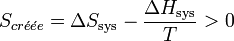 .
.
Multiplions les deux membres de cette inégalité par 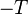 , on obtient :
, on obtient :
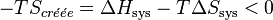 .
.
On obtient la nouvelle fonction d’état 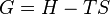
A température et pression constante 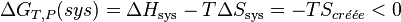
La réaction ne peut se produire que dans le sens correspondant à la diminution de la fonction 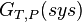 ; l’équilibre étant atteint pour le minimum de
; l’équilibre étant atteint pour le minimum de 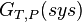 .
.
Différentielle de G = H-TS
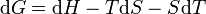
or 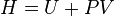
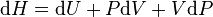
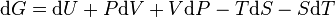
Premier principe :
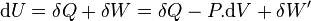
Le travail correspond soit aux forces de pression 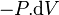 soit au travail électrique dans un montage de pile
soit au travail électrique dans un montage de pile 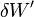 .
.
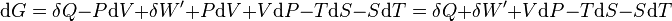
Second principe :
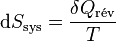
d’où 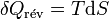
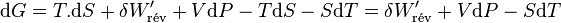
Il s'ensuit:
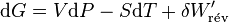 |
Variation en fonction de la température et de la pression
En absence de travail électrique, la différentielle de G (fonction d'état) devient tout simplement
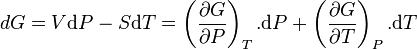
ce qui conduit directement aux relations de Maxwell:
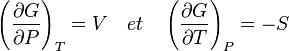
La dérivée par rapport à la température peut aussi être exprimée sous forme de la relation de Gibbs-Helmholtz, à savoir 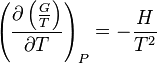 .
.
Cas d'une pile réversible qui fonctionne à T et P constantes
Une pile électrique est un dispositif particulier qui permet de transformer l'énergie chimique mise en jeu au cours d'une réaction d'oxydo-réduction, en énergie électrique fournie au milieu extérieur : 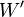 . Si la pile débite un faible courant, on peut considérer que la réaction se produit de façon proche de la réversibilité et qu'ainsi, à chaque instant, l'état de la pile est proche d'un état d'équilibre. Ce mode de fonctionnement peut être réalisé en introduisant dans le circuit extérieur une contre tension proche, à un
. Si la pile débite un faible courant, on peut considérer que la réaction se produit de façon proche de la réversibilité et qu'ainsi, à chaque instant, l'état de la pile est proche d'un état d'équilibre. Ce mode de fonctionnement peut être réalisé en introduisant dans le circuit extérieur une contre tension proche, à un  près, de la force électromotrice de la pile.
près, de la force électromotrice de la pile.
Dans ces conditions, à 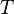 et
et 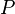 constantes :
constantes :
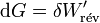 et pour une transformation finie :
et pour une transformation finie :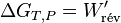
La variation d’enthalpie libre dans une pile réversible correspond au travail électrique fourni au milieu extérieur.
Si la pile n’est pas réversible comme toute pile réelle, le deuxième principe s’applique par l’inégalité de Clausius (voir entropie): 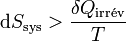 .
En reprenant les calculs, on aboutit à l’inégalité suivante :
.
En reprenant les calculs, on aboutit à l’inégalité suivante :
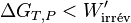
Il s'ensuit: 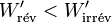 et comme le travail fourni par le système électrochimique est négatif d'après la règle des signes, il faut prendre en compte la valeur absolue de ce travail :
et comme le travail fourni par le système électrochimique est négatif d'après la règle des signes, il faut prendre en compte la valeur absolue de ce travail :
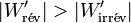 |
Le travail électrique fourni par la pile est plus important si la pile se rapproche d’un fonctionnement réversible, c’est-à-dire avec un déséquilibre de tension faible. L’irréversibilité se manifeste ici par effet Joule.
Remarque
Dans le cas de la charge d'un accumulateur par un dispositif extérieur, le système subit une transformation contrainte qui est le contraire de la transformation spontanée observée dans la décharge d'une pile. Il s'ensuit que la variation de l'enthalpie libre du système est alors positive. Ce n'est plus une transformation spontanée.
Cas d’une réaction chimique à T et P constantes, irréversible par nature
S’il n’y a pas de montage de pile, il n’y a pas de travail électrique, 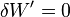 .
.
La réaction chimique est irréversible et le deuxième principe s’applique par l’inégalité de Clausius (voir entropie) : 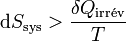 .
.
Si on reprend les calculs de la différentielle dG, on obtient alors l’inégalité :
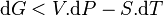
Or ici 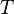 et
et 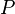 sont constantes:
sont constantes:
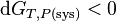 et pour une réaction chimique réelle:
et pour une réaction chimique réelle: 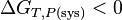
On peut exprimer la variation d'enthalpie libre en fonction de l'entropie créée:
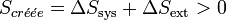
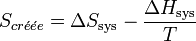 , multiplions par
, multiplions par 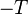
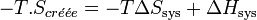
Il s'ensuit:
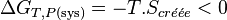 |
Par conséquent toute réaction chimique ne peut progresser que si l’enthalpie libre du système réactionnel diminue. Lorsque cette fonction atteint un minimum, le système est à l’équilibre.
La fonction 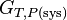 permet donc de définir le sens de la réaction et son positionnement à l’équilibre. C’est la fonction la plus importante pour l’étude des équilibres chimiques.
permet donc de définir le sens de la réaction et son positionnement à l’équilibre. C’est la fonction la plus importante pour l’étude des équilibres chimiques.
Remarque: Un changement d'état physique peut être considéré comme une réaction chimique particulière qui peut être effectuée en se rapprochant de la réversibilité. Par exemple la fusion de la glace peut être effectuée à 0 °C + ε . Dans ce cas l'entropie créée est proche de zéro. Il s'ensuit que 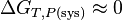 . C'est pourquoi on parle alors d'équilibre de changement d'état.
. C'est pourquoi on parle alors d'équilibre de changement d'état.
Voir aussi
- Portail de la physique
- Portail de la chimie
