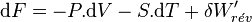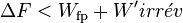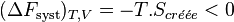Énergie libre
 |
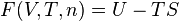 |
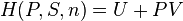 |
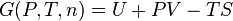 |
L'énergie libre 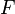 (appelée aussi énergie de Helmholtz) est, en thermodynamique, une fonction d'état extensive dont la variation permet d'obtenir le travail utile susceptible d'être fourni par un système thermodynamique fermé, à température constante, au cours d'une transformation réversible. Elle correspond à l'énergie libre de Helmholtz des anglo-saxons, qui préfèrent la symboliser par la lettre
(appelée aussi énergie de Helmholtz) est, en thermodynamique, une fonction d'état extensive dont la variation permet d'obtenir le travail utile susceptible d'être fourni par un système thermodynamique fermé, à température constante, au cours d'une transformation réversible. Elle correspond à l'énergie libre de Helmholtz des anglo-saxons, qui préfèrent la symboliser par la lettre 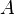 .
.
Cette fonction ne doit pas être confondue avec la fonction enthalpie libre  (énergie libre de Gibbs des anglo-saxons), qui s'applique aux systèmes évoluant à la température
(énergie libre de Gibbs des anglo-saxons), qui s'applique aux systèmes évoluant à la température 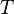 et à pression constante (cas des réactions effectuées à l'air libre).
et à pression constante (cas des réactions effectuées à l'air libre).
L'énergie libre est souvent utilisée dans l'étude des explosions qui induisent une variation de pression ou encore dans la calorimétrie à volume constant effectuée dans une bombe calorimétrique.
Néanmoins le rôle de la fonction 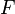 est beaucoup moins important en thermochimie que celui de la fonction enthalpie libre qui est la fonction phare, indispensable à l’étude des équilibres chimiques.
est beaucoup moins important en thermochimie que celui de la fonction enthalpie libre qui est la fonction phare, indispensable à l’étude des équilibres chimiques.
Cette fonction, qui n'est en fait rien d'autre que le logarithme de la fonction de partition, joue un rôle fondamental en physique théorique.
Définition
Considérons une transformation irréversible effectuée à la température 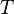 et à volume constant. S’il n’y a pas de montage électrochimique, il n’y a pas de travail électrique. Comme
et à volume constant. S’il n’y a pas de montage électrochimique, il n’y a pas de travail électrique. Comme 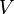 est constant, le travail des forces de pression est nul.
est constant, le travail des forces de pression est nul.
Donc en appliquant le premier principe : 
Appliquons alors le second principe : 
Le système échange avec le milieu extérieur 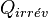 . Si on se place du côté du milieu extérieur, celui-ci reçoit
. Si on se place du côté du milieu extérieur, celui-ci reçoit 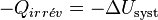 .
.
Et la variation d’entropie du milieu extérieur devient égale à :
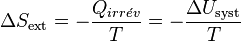
D’où : 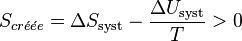
Multiplions par 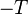 :
:
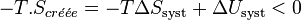
On définit ainsi la fonction énergie libre :
Pour une transformation effectuée à 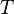 et
et 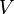 constants, on obtient :
constants, on obtient :
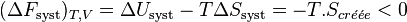
Si la transformation est réversible, 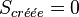 et
et 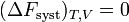
En revanche, si la transformation est irréversible,  et donc
et donc 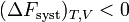
Différentielle de F

Appliquons le premier principe
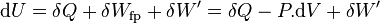
où  est le travail des forces de pression et
est le travail des forces de pression et 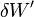 représente tout autre forme de travail, comme le travail électrique dans un montage de pile.
représente tout autre forme de travail, comme le travail électrique dans un montage de pile.
Appliquons le second principe
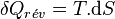
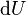 s'exprime donc :
s'exprime donc :

d'où :
Si la température est constante:
 '
'Dans le cas d'une transformation réelle donc irréversible:
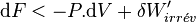
Et pour une transformation finie entre deux états d'équilibre:
On montre bien que la variation de la fonction 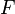 est égale au travail fourni par le système si la transformation est effectuée à
est égale au travail fourni par le système si la transformation est effectuée à 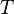 constante et si elle est réversible.
constante et si elle est réversible.
Dans le cas d'une transformation à volume constant et travail 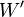 nul:
nul:

plus précisément :
La transformation réelle à 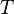 et
et 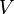 constants ne peut s’effectuer qu’avec une diminution de l’énergie libre du système.
On peut donc identifier
constants ne peut s’effectuer qu’avec une diminution de l’énergie libre du système.
On peut donc identifier 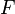 à un potentiel thermodynamique du système lors d'une transformation isotherme et isochore.
à un potentiel thermodynamique du système lors d'une transformation isotherme et isochore.
Remarque: voir à titre de comparaison Enthalpie libre; potentiel thermodynamique défini à T et P constants.
Relations utiles à partir de F ou de ses différentielles
- Relation de Maxwell :
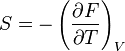
- Relation de Gibbs-Helmholtz : il existe une relation analogue à celle de Gibbs-Helmholtz concernant
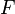 :
: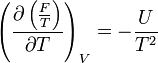
- Potentiel chimique : une définition du potentiel chimique peut être donnée à partir d'une différentielle partielle de
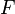 .
.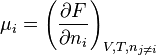
Autres fonctions d'état
- Énergie interne
- Enthalpie
- Enthalpie libre
- Entropie
- Supraconductivité
- Température
- Volume
- Pression
Références
- IUPAC definition
- Atkins' Physical Chemistry, 7th edition, by Peter Atkins and Julio de Paula, Oxford University Press
- Lev Landau et Evguéni Lifchitz, Physique théorique, tome 7 : Théorie de l'élasticité [détail des éditions]
- Portail de la physique
- Portail de la chimie
- Portail de l’énergie