Nombre d'oxydation
En chimie, l'état d'oxydation, décrit par le nombre d'oxydation (n.o.) ou le degré d'oxydation (d.o.), caractérise l'état électronique d'un élément chimique (au sein d'une molécule, d'un ion ou d'un radical) en considérant la charge réelle (dans le cas d'un ion monoatomique) ou fictive (si cet élément est combiné)[1]. Cette charge fictive se calcule, dans le cas des molécules, en considérant que l'élément :
- possède tous les électrons des liaisons chimiques établies avec les atomes moins électronégatifs que lui, ce qui se traduit donc pour lui par un gain d'électron(s) ;
- ne possède aucun des électrons des liaisons chimiques établies avec les atomes plus électronégatifs que lui, ce qui se traduit par une perte d'électron(s).
Dans un corps simple, un élément est caractérisé par un nombre d'oxydation nul.
Dans le cas d'ions monoatomiques, le nombre d'oxydation de l'ion est la valeur de la charge électrique portée par celui-ci (exemple : n.o.(Na+) = +I).
Au sein d'une molécule, la règle de l'électronégativité explicitée précédemment, s'applique. Par exemple, dans le dioxyde de soufre SO2, l'oxygène O est plus électronégatif que le soufre S. Comme ils sont doublement liés, l'atome de soufre S a fictivement perdu deux électrons pour chaque double liaison S=O. Il porte donc au total une charge fictive de +4 et a un nombre d'oxydation de +IV, en revanche chaque oxygène a gagné 2 électrons et a donc un nombre d'oxydation de -II (les nombres d'oxydation se notent conventionnellement en chiffres romains) ; la molécule de SO2 étant neutre.
En réalité, sauf dans le cas ou la différence d'électronégativité entre deux éléments est très importante, les liaisons sont covalentes et présentent un caractère ionique partiel, ce qui signifie qu'il y a un transfert de charge partiel entre les atomes liés. Si l'électronégativité des deux atomes liés est la même (par exemple, si les atomes liés sont un même élément), alors la liaison ne contribue pas au calcul du n.o.
Le nombre d'oxydation est un concept commode et utile pour l'étude des réactions d'oxydo-réduction. Il facilite le décompte des électrons et aide à vérifier leur conservation.
Définition
Les atomes sont définis comme ayant un n.o. nul car ils sont électriquement neutres : les charges positives des protons du noyau équilibrent les charges du nuage d'électrons négatifs qui l'entoure.
Si un atome perd un électron, il possède plus de protons que d'électrons et devient un ion positif (un cation). On dit que cet ion a un nombre d'oxydation égal à +I (n.o. = +I). Réciproquement, si un atome accepte un électron, il devient chargé négativement (un anion) et son nombre d'oxydation devient -I (n.o. = –I).
Un nombre d'oxydation correspondant à un nombre d'électron(s) perdu(s) ou gagné(s), c'est forcément un nombre entier. Certains décomptes du nombre d'oxydation peuvent cependant conduire à des nombres d'oxydation fractionnaires. Il s'agit alors d'un nombre d'oxydation moyen et il convient de détailler le décompte atome par atome (ou ion par ion). Par exemple, le fer de l'oxyde de fer Fe3O4 peut être considéré en comptant que les trois fers possèdent ensemble huit charges positives, car chaque oxygène est un ion O2-. En moyenne le fer possède donc un nombre d'oxydation de 8/3. En fait, deux des trois fers possèdent un nombre d'oxydation (+III) et le 3e un nombre d'oxydation (+II). Au total : 2 × (+III) + 1 × (+II) = 8.
Notation
Dans les espèces chimiques neutres ou ioniques, les nombres d'oxydation sont notés par des chiffres romains entre parenthèses, placés juste après l'élément concerné afin de tenir compte du transfert partiel d'électrons.
Par exemple, l'oxyde de fer(III) correspond à la formule Fe2O3, différent de l'oxyde de fer(II) de formule FeO.
De même, l'ion tétraoxomanganate(VII) correspond à du manganèse Mn(VII) et à la formule MnO4–, appelé encore permanganate.
Règles définissant le nombre d'oxydation
Le nombre d'oxydation est abrégé par n.o.
Règles générales
- Dans une espèce chimique hétéropolyatomique (composée d’atomes de nature différente), l’atome ayant le plus d’affinité pour les électrons, c’est-à-dire le plus électronégatif, est considéré comme recevant les électrons.
- Exemple : H2O correspond à 2 H(+I) et 1 O(-II).
- Dans une espèce chimique neutre (molécule ou radical), la somme des n.o. des atomes constitutifs est nulle. En revanche si le composé est ionique, cette somme est égale à la charge de l’ion.
- Exemple : SO42- (ion sulfate) correspond à 1 S(VI) et 4 O(-II).
- Dans une espèce chimique homopolyatomique neutre (composée d’atomes de même nature), le n.o. de chaque atome est nul.
- Dans une espèce chimique hétéropolyatomique, s'il y a des liaisons covalentes entre atomes de même nature, elles ne contribuent pas au calcul du n.o.
- Exemples : dans C2H6 et H3C-CH3(éthane), les états d'oxydation sont H(I) et C(-III).
Règles usuelles
- Un corps simple élémentaire ou moléculaire a un n.o. égal à zéro (ex., n.o.(Ne) = 0 et n.o.(H2) = 0).
- Dans un composé, le fluor a toujours un n.o. égal à –I.
- Dans un composé, un alcalin (Li, Na, etc.) a toujours un n.o. égal à +I.
- Dans un composé, un alcalino-terreux (Be, Mg, etc.) a toujours un n.o. égal à +II.
- Dans un composé, l'hydrogène possède dans la quasi-généralité des cas un n.o. égal à +I, à l’exception des hydrures de métaux, tels que NaH ou LiH (hydrure de sodium ou de lithium), pour lesquels n.o.(H) = –I.
- Dans un composé, l'oxygène a le plus souvent un n.o. égal à –II. Il existe néanmoins plusieurs exceptions :
- Dans les peroxydes, la présence d’un pont oxygène O-O induit un n.o. = –I pour chaque oxygène.
- Exemple : H2O2 (eau oxygénée), qui correspond à H-O-O-H.
- Dans les superoxydes, (l'ion superoxyde a la formule O2-), c'est -1/2 en moyenne. En fait un des atomes O est chargé –1 et a un nombre d'oxydation –I, l'autre n'est pas chargé et a un nombre d'oxydation nul.
- Dans les ozonures (l'ion ozonure a la formule O3-), c'est -1/3 en moyenne. En fait un des atomes O est chargé –1 et a un nombre d'oxydation –I, les deux autres ne sont pas chargés et ont un nombre d'oxydation nul.
- Comme le fluor est le plus électronégatif des éléments, il a un nombre d'oxydation -I dans tous ses composés. Ainsi, dans la molécule OF2 (difluorure d'oxygène), le n.o. de l'oxygène est +II.
- Dans les peroxydes, la présence d’un pont oxygène O-O induit un n.o. = –I pour chaque oxygène.
Application à une structure de Lewis
Quand la structure de Lewis d'une molécule est disponible, les nombres d'oxydation peuvent être calculés à partir des électrons de valence :
- Les électrons dans une liaison chimique entre deux atomes différents « appartiennent » à l'atome ayant l'électronégativité la plus élevée ;
- Les électrons appartenant à une liaison partagée par deux mêmes atomes sont également partagés ;
- Les électrons dans une paire d'électrons (paire seule) appartiennent exclusivement à l'atome ayant une telle paire.
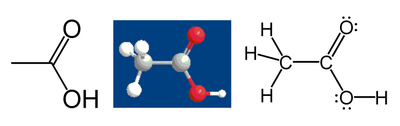
Par exemple, considérons la molécule d'acide acétique :
- Tous les atomes d'hydrogène ont un nombre d'oxydation de +1, car ils « donnent » leur électron aux autres atomes liés qui ont une électronégativité plus élevée.
- L'atome de carbone dans le groupe méthyle (CH3) a 3 × 2 = 6 électrons de valence de ses liaisons avec les trois atomes hydrogène. De plus, l'atome de carbone obtient un électron de sa liaison avec l'autre atome de carbone, car la paire d'électrons est partagée également dans la liaison C-C. Le décompte est donc de 7 électrons. Un atome de carbone seul possède 4 électrons de valence (famille IV-A du tableau périodique). La différence, 4 – 7 = –3, est son nombre d'oxydation. En faisant l'hypothèse que toutes les liaisons sont ioniques (ce qui n'est pas le cas ici), l'atome de carbone peut être représenté par C3–.
- En appliquant les mêmes règles pour le groupe carboxyle (-COOH), l'atome de carbone a un nombre d'oxydation de +III. Il obtient un seul électron de sa liaison avec l'autre atome de carbone. Les deux atomes d'oxygène « empruntent » tous les autres électrons car ils sont plus électronégatifs que le carbone. Un atome d'oxygène seul comporte 6 électrons de valence. Chaque atome d'oxygène est entouré de 8 électrons : 4 des paires seules et 4 des liaisons. En conséquence, leur nombre d'oxydation est 6 – 8 = –2.
Exemples d’éléments à nombres d'oxydation multiples
- Le chlore peut avoir plusieurs nombres d'oxydation :
| Nombre d'oxydation |
Formule chimique |
Nom | Commentaire |
|---|---|---|---|
| –1 | Cl– | chlorure | |
| 0 | Cl2 | dichlore | |
| +1 | ClO– | hypochlorite ou oxochlorate(I) | Constituant de l’eau de Javel. |
| +3 | ClO2– | chlorite ou dioxochlorate(III) | |
| +5 | ClO3– | chlorate ou trioxochlorate(V) | Connu pour ses propriétés explosives aux chocs (KClO3 : chlorate de potassium) |
| +7 | ClO4– | perchlorate ou tétraoxochlorate(VII) | Connu sous la forme de l’acide perchlorique HClO4 (acide le plus fort, dans l’eau). |
- Il en est de même pour les autres halogènes, iode et brome à l’exception du fluor qui est plus électronégatif que l’oxygène.
- Dans le cas des oxydes de fer :
- dans la wustite FeO, il s'agit de fer (+II) ;
- dans l'hématite Fe2O3, il s'agit de fer (+III) ;
- dans la magnétite Fe3O4, il s'agit de fer (+II) et de fer (+III) : Fe(II)Fe(III)2O4.
- Le manganèse peut exister sous plusieurs états d'oxydation :
- il se trouve dans l'état (+II) dans l'oxyde MnO ;
- à l'état d'oxydation (+III) dans Mn2O3 ;
- à l'état (+IV) dans MnO2 ;
- à l'état (+V) dans Na3MnO4 ;
- à l'état (+VI) dans K2MnO4 ;
- il atteint le nombre d'oxydation maximum possible, (+VII), dans le permanganate de potassium (KMnO4) ou dans l'heptoxyde de dimanganèse (Mn2O7).
Articles connexes
- Électrochimie
- Oxydo-réduction
- Spectroscopie Mössbauer
- Valence
Références
- Portail de la chimie