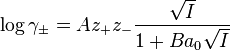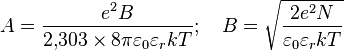Théorie de Debye-Hückel
|
|
Cet article est une ébauche concernant la chimie. Vous pouvez partager vos connaissances en l’améliorant (comment ?) selon les recommandations des projets correspondants.
|
La théorie de Debye-Hückel est un modèle destiné à expliquer l'écart à l'idéalité en solution, à travers le calcul des coefficients d'activité dans l'échelle des concentrations[1]. Proposé par Peter Debye et Erich Hückel en 1923[2], cette théorie est basée sur le modèle de l'atmosphère ionique. L'écart à l'idéalité y est vu comme la conséquence de l'interaction électrostatique entre les sphères de solvatation ioniques.
Hypothèses

La théorie de Debye-Hückel est fondée sur ce que Peter Debye appelle l'atmosphère ionique. Autour d'un ion donné, on trouve un excès d'ions de charge opposée. Ainsi, pour respecter l'équilibre des charges, la charge globale du nuage ionique est l'opposée de celle de l'ion central.
Il faut de plus considérer 5 hypothèses pour que l'énoncé soit correct[1] :
- Les ions sont considérés comme des charges ponctuelles indéformables.
- On ne considère que des électrolytes forts, quelle que soit la concentration.
- Les seuls forces d'interactions considérés sont de nature électrostatique, les interactions de Van der Waals sont négligées.
- Le solvant est considéré comme un fluide de constante diélectrique uniforme et égale à celle du solvant pur.
- L'énergie d'agitation thermique est grande devant celle issue des interactions électrostatiques.
Équation de Debye-Hückel
La résolution du calcul permet d'obtenir une expression pour le coefficient d'activité moyen d'un électrolyte, dite équation de Debye-Hückel[1].
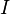 est la force ionique de la solution.
est la force ionique de la solution.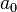 est assimilable à la distance minimale entre deux ions.
est assimilable à la distance minimale entre deux ions.
Notes et références
- 1 2 3 Hubert Girault, Électrochimie physique et analytique, PPUR presses polytechniques, (ISBN 9782880746735), p. 152
- ↑ (en) P. Debye and E. Hückel, « The theory of electrolytes. I. Lowering of freezing point and related phenomena », Physikalische Zeitschrift, vol. 24, , p. 185–206 (lire en ligne [PDF])
- Portail de la chimie