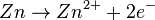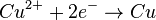Pile Daniell
La pile Daniell a été inventée par le chimiste britannique John Daniell en 1836 au moment où le développement du télégraphe faisait apparaître un besoin urgent de sources de courant sûres et constantes.
La pile électrique Daniell est constituée d'une anode (lame de zinc plongée dans une solution contenant du sulfate de zinc) et d'une cathode (lame de cuivre plongée dans une solution contenant du sulfate de cuivre). Les deux solutions sont reliées par un pont salin (solution de chlorure de potassium (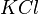 ) ou de nitrate de potassium (
) ou de nitrate de potassium (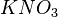 )) qui sert à équilibrer les charges.
)) qui sert à équilibrer les charges.

Étude des deux demi-piles

Demi-pile du zinc
Le couple 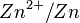 est impliqué dans la demi-équation d'oxydo-réduction :
est impliqué dans la demi-équation d'oxydo-réduction :
L'équation de Nernst qui lui est associée est :
où le potentiel standard vaut :
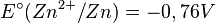 .
.
Aussi, le potentiel de l'électrode de zinc est donc :
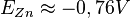 [1].
[1].
Demi-pile du cuivre
Le couple 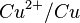 est impliqué dans la demi-équation d'oxydo-réduction :
est impliqué dans la demi-équation d'oxydo-réduction :
L'équation de Nernst qui lui associée est :
où le potentiel standard vaut :
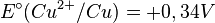 .
.
Aussi, le potentiel de l'électrode de cuivre est donc :
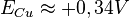 [2].
[2].
Prévision de l'évolution chimique
La « règle du gamma » impose une équation bilan de la réaction :
La constante K de cette réaction est de l'ordre de 10³⁷, c'est-à-dire que tant que le quotient de cette réaction est inférieur à K, la réaction évolue dans le sens direct, c’est-à-dire dans le sens de la consommation des réactifs.
Ainsi, il y a :
- oxydation du zinc (l'électrode de zinc est une anode) ;
- et réduction des ions cuivre II (l'électrode de cuivre est une cathode).
Fonctionnement électrochimique

À l'anode
La réaction d'oxydation d'un atome de zinc de l'anode entraîne la libération de deux électrons dans le circuit :
Le potentiel de l'électrode de zinc est le plus bas, c'est le pôle – de la pile :
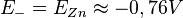 .
.
Dans les fils électriques
Les électrons libérés se dirigent alors vers l'autre électrode de la pile (le pôle +) en créant un courant dans le circuit. Ce courant est conventionnellement positif du pôle + vers le pôle – , alors que les électrons se dirigent du pôle – vers le pôle + (car les électrons sont chargés négativement).
La tension aux bornes de la pile (c’est-à-dire la différence de potentiel entre ses électrodes)
est 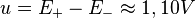 .
.
À la cathode
Arrivés à la cathode, les électrons sont impliqués dans la réduction des ions cuivre II présents dans la solution :
Ce qui entraîne la croissance de la lame de cuivre.
Le potentiel de l'électrode de cuivre est le plus haut, c'est le pôle + de la pile :
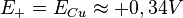 .
.
Dans le pont électrolytique
Dans le pont électrolytique (ou pont salin),
- deux anions chlorure (
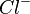 ) - ou nitrate (
) - ou nitrate (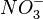 ) dans le cas d'un pont salin à base de
) dans le cas d'un pont salin à base de 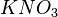 - dérivent vers la solution de sulfate de zinc ;
- dérivent vers la solution de sulfate de zinc ; - alors que deux cations potassium (
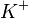 ) traversent le pont salin pour rééquilibrer la solution de cuivre.
) traversent le pont salin pour rééquilibrer la solution de cuivre.
Le pont électrolytique sert ainsi à fermer le circuit électrique, tout en assurant aux deux demi-piles des potentiels différents.
Notes et références
- ↑ L'oxydoréduction, concepts et expériences, Jean Sarrazin Michel Verdaguer, Ellipses, page 309
- ↑ L'oxydoréduction, concepts et expériences, Jean Sarrazin Michel Verdaguer, Ellipses, page 307
Voir aussi
Articles connexes
- Pile thermique
- Pile Callaud
Liens externes
- Animation sur le fonctionnement de la pile Daniell
- Portail de la chimie
- Portail de l’électricité et de l’électronique
- Portail de l’énergie

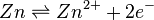
![E_{Zn} = E^\circ (Zn^{2+}/Zn) + \frac{R.T}{2.F}\ln{a(Zn^{2+})}
\approx E^\circ (Zn^{2+}/Zn) + \frac{0,059}{2}\log{\left( \frac{\left[Zn^{2+}\right]}{C^\circ} \right)}](../i/m/6016856aeaa6ff06aa36cdf509e88290.png)
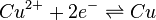
![E_{Cu} = E^\circ (Cu^{2+}/Cu) + \frac{R.T}{2.F}\ln{a(Cu^{2+})}
\approx E^\circ (Cu^{2+}/Cu) + \frac{0,059}{2}\log{\left( \frac{\left[Cu^{2+}\right]}{C^\circ} \right)}](../i/m/b102b408b50998699566260bc2935b75.png)