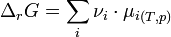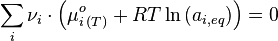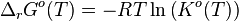Loi d'action de masse
La loi d'action de masse (ou loi de Guldberg et Waage (1864)) est une loi qui permet de définir l'équilibre d'un système réactionnel.
Historique
La loi d'action de masse a été exposée en 1867 par les chimistes norvégiens Cato Guldberg et Peter Waage à partir de leur découverte commune publiée en 1864. Mais elle a surtout connu un rayonnement scientifique prometteur à partir des développements menés en 1887 par Van 't Hoff qui lui confère un rôle fondamental en chimie analytique.
Cette loi explicite les conditions de l'équilibre chimique dans la continuité des travaux de Claude Louis Berthollet, Henry Le Chatelier, Jacobus Henricus van 't Hoff et Willard Gibbs. Un système réactionnel, soumis à une réaction chimique ayant atteint un équilibre, est caractérisé par le fait que les concentrations des réactifs de départ et des produits formés sont reliées par une expression dont la valeur est constante à une température donnée.
La constante 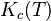 ainsi définie est appelée constante d'équilibre de Guldberg et Waage. Ils abordèrent également l'aspect cinétique chimique de l'équilibre chimique en proposant l'hypothèse que l'équilibre obtenu n'est pas statique mais dynamique ou stationnaire : les vitesses de la réaction directe et de la réaction inverse étant égales.
ainsi définie est appelée constante d'équilibre de Guldberg et Waage. Ils abordèrent également l'aspect cinétique chimique de l'équilibre chimique en proposant l'hypothèse que l'équilibre obtenu n'est pas statique mais dynamique ou stationnaire : les vitesses de la réaction directe et de la réaction inverse étant égales.
Théorie
Une réaction chimique évolue tant que son enthalpie libre de réaction à température T, et pression p constantes, 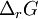 , pour un avancement donné de la réaction :
, pour un avancement donné de la réaction : 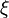 , est négative. L'équilibre est atteint lorsque
, est négative. L'équilibre est atteint lorsque 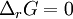 (voir Équilibre chimique).
(voir Équilibre chimique).
où :
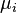 étant le potentiel chimique. Or par définition de l'activité chimique
étant le potentiel chimique. Or par définition de l'activité chimique 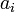 de chaque espèce :
de chaque espèce :
où 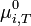 est le potentiel chimique standard à T. À l'équilibre on obtient donc :
est le potentiel chimique standard à T. À l'équilibre on obtient donc :
Or 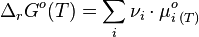
Posons alors:
Avec 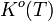 que l'on nomme constante d'équilibre. On obtient alors la "loi d'action de masse":
que l'on nomme constante d'équilibre. On obtient alors la "loi d'action de masse":
Articles connexes
- Portail de la chimie