Hydrophobie (physique)



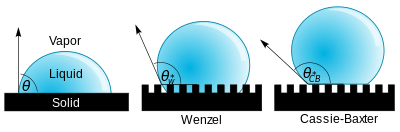
L'hydrophobie (du grec υδρο, hydro = eau, et Φόϐος, phóbos = peur) caractérise les surfaces qui repoussent l'eau
Plus généralement, c'est une propriété d'un objet moléculaire de ne pas être soluble dans l'eau ni dans les produits polaires, menant à une ségrégation de l'objet vis-à-vis du solvant (ou inversement). Des molécules comme les alcanes sont hydrophobes.
Utilisations
La propriété d'hydrophobie est essentielle en biochimie (et particulièrement dans la chimie des cellules et des protéines), et est recherchée (ou au contraire, combattue) en chimie des matériaux, et plus particulièrement des revêtements.
Des revêtements hydrophobes sont appréciés pour certains usages :
- les récipients recouverts de téflon sont moins salissants, et la nourriture n'y adhère pas.
- la selle des vélos modernes est hydrophobe. Ainsi, à la différence de l'époque où les selles étaient en cuir, elles ne perdent pas, en vieillissant, leur capacité à ne pas s'imbiber d'eau.
La cire et l'huile sont aussi hydrophobes.
Principes physico-chimiques
Un composé hydrophobe, n'a pas la capacité de créer des liaisons hydrogène avec les molécules d'eau. Il est aussi souvent apolaire, ou de faible polarité, ce qui signifie qu'il ne peut pas faire d'interactions électrostatiques avec l'eau, de type dipôle permanent/dipôle permanent (forces de Keesom) (l'eau étant très polaire, elle cherche à interagir avec des molécules polaires).
En effet, la solubilité d'un composé dans un solvant dépend de manière générale des interactions qu'il peut avoir avec le solvant. Un composé hydrophobe est donc un composé qui ne peut pas interagir physiquement avec l'eau. Il est alors généralement plutôt soluble dans les solvants organiques, comme l'acétone, les hydrocarbures légers, avec lesquels il peut faire des interactions de Van der Waals de type dipôle induit/dipôle induit (forces de London). C'est une caractéristique de beaucoup de plastiques, qui sont imperméables à l'eau mais détruits par d'autres solvants.
Il a été démontré, grâce à l'analyse d'une interface hydrophile-hydrophobe soumise à un rayonnement synchrotron, que celle-ci est en fait constituée d'un vide de 0,1 à 0,5 nanomètres d'épaisseur.
Les produits hydrophobes sont souvent lipophiles (solubles dans les corps gras), mais insolubles dans l'eau.
Dans le sol
L’imperméabilité des sols est dans la nature un phénomène beaucoup plus commun qu'on ne le pensait autrefois[1] ; certains sols naturels ou pollués sont anormalement hydrophobes, en général à cause de la présence de matières huileuses ou cireuses[1].
Il a été constaté en laboratoire que le comportement de ces sols changeait à l'égard des métaux lourds en solution[1].
Dans un sol imperméable Cr, Pb et Cu sont plus facilement adsorbés dans le sol que Zn, Cd et Ni[1].
Or, pour fertiliser les sols, on peut les arroser avec des eaux grises recyclées (technique courante dans le sud de l'Australie). Avant d’irriguer de la sorte, il est donc important de comprendre la capacité de sorption compétitive du sol et sa capacité de rétention des métaux lourds, en considérant l'origine géochimique du caractère hydrofuge (ex : cires déposées sur ou entre les particules du sol)[1].
Voir aussi
Articles connexes
- Hydrophile
- Superhydrophobe
- Omniphobe
- Effet lotus
- Polarité
- Molécule Amphipathique
Références
- 1 2 3 4 5 P. J. Li, F. Stagnitti, X. Xiong and P. Li, Competitive sorption of intermixed heavy metals in water repellent soil in Southern Australia ; Environmental Geology Volume 52, Number 4, 685-690, 2007 DOI:10.1007/s00254-006-0504-x (Résumé)
- Portail de la chimie
- Portail de la physique
- Portail de la biochimie
