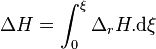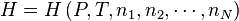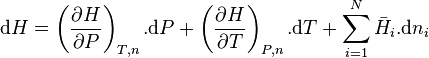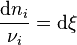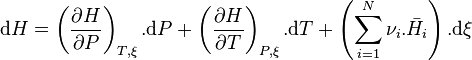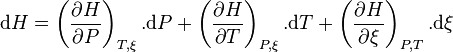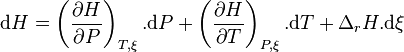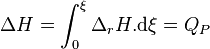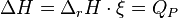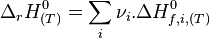Enthalpie de réaction
L'enthalpie de réaction 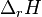 est une grandeur de réaction associée à l'écriture de l'équation-bilan d'une réaction chimique effectuée à température T et pression P constantes. Elle s'exprime en joule par mole (J/mol) et correspond à la variation d'enthalpie du mélange réactionnel pour un avancement
est une grandeur de réaction associée à l'écriture de l'équation-bilan d'une réaction chimique effectuée à température T et pression P constantes. Elle s'exprime en joule par mole (J/mol) et correspond à la variation d'enthalpie du mélange réactionnel pour un avancement 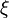 de la réaction en cours égal à 1 mol. Ainsi, si on connait l'avancement d'une réaction, on peut calculer la variation d'enthalpie
de la réaction en cours égal à 1 mol. Ainsi, si on connait l'avancement d'une réaction, on peut calculer la variation d'enthalpie 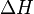 associée à cette réaction d'après la relation suivante :
associée à cette réaction d'après la relation suivante :
Pour les réactions chimiques ayant lieu à pression constante, l'enthalpie de réaction permet donc d'avoir accès à la quantité d'énergie libérée sous forme de chaleur car :
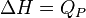 (voir enthalpie)
(voir enthalpie)
Une réaction chimique qui a une enthalpie de réaction négative est dite exothermique, puisqu'elle libère de la chaleur dans l'environnement, alors qu'une réaction chimique dont l'enthalpie de réaction est positive est dite endothermique : elle nécessite un apport de chaleur pour se produire.
Définition thermodynamique
Soit une réaction chimique quelconque notée sous la forme :
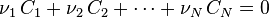
en attribuant selon la convention stœchiométrique une valeur négative aux coefficients stœchiométriques des réactifs et positive à ceux des produits :
-
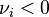 pour un réactif ;
pour un réactif ; -
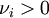 pour un produit.
pour un produit.
L'enthalpie 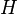 du système réactionnel est fonction des variables indépendantes P, T, n1, n2, ... ,nN (pression, température et quantité de matière de chaque constituant du système) :
du système réactionnel est fonction des variables indépendantes P, T, n1, n2, ... ,nN (pression, température et quantité de matière de chaque constituant du système) :
La fonction enthalpie étant une fonction d'état, sa différentielle totale est exacte et peut s'écrire selon :
avec 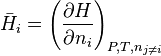 l'enthalpie molaire partielle du constituant i.
l'enthalpie molaire partielle du constituant i.
Chaque variation du nombre de mole 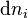 est reliée à la variation de l'état d'avancement
est reliée à la variation de l'état d'avancement 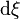 par :
par :
On obtient alors, par remplacement dans l'expression de la variation d'enthalpie :
L'expression 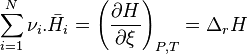 est par définition l'enthalpie de réaction de la réaction chimique envisagée à P et T constantes. L'enthalpie de réaction
est par définition l'enthalpie de réaction de la réaction chimique envisagée à P et T constantes. L'enthalpie de réaction 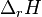 correspond donc à la différence des enthalpies molaires partielles entre les produits et les réactifs, en tenant compte de la stœchiométrie de la réaction.
correspond donc à la différence des enthalpies molaires partielles entre les produits et les réactifs, en tenant compte de la stœchiométrie de la réaction.
Calculons alors la variation d'enthalpie du système réactionnel à P et T constantes :
Intégrons pour un état d'avancement variant de zéro (début de la réaction) à 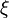 (état intermédiaire ou fin de la réaction) :
(état intermédiaire ou fin de la réaction) :
Par définition, la variation de l'enthalpie lors d'une transformation isobare est égale à la quantité de chaleur produite lors de cette transformation, d'où :
La connaissance de l'enthalpie de réaction permet donc d'avoir accès à la chaleur de réaction.
Remarque :
- Pour les systèmes réactionnels idéaux (gaz considérés comme parfaits, solutions diluées), l'enthalpie de réaction reste constante au cours d'une réaction. La variation d'enthalpie du système réactionnel mise en jeu à pression constante devient égale au produit de l'enthalpie de réaction par l'état d'avancement :
Enthalpie de réaction standard et enthalpie de formation
L'enthalpie d'un corps pur ne peut pas être calculée de façon absolue car elle dépend de l'énergie interne qui n'est pas calculable (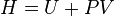 ). Néanmoins, des tables d'enthalpies molaires ont été établies afin de pouvoir calculer rapidement une enthalpie de réaction à partir des valeurs de ces enthalpies molaires :
). Néanmoins, des tables d'enthalpies molaires ont été établies afin de pouvoir calculer rapidement une enthalpie de réaction à partir des valeurs de ces enthalpies molaires : 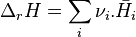 . Cela suppose de définir une échelle arbitraire d'enthalpies molaires en définissant un zéro arbitraire d'enthalpie.
. Cela suppose de définir une échelle arbitraire d'enthalpies molaires en définissant un zéro arbitraire d'enthalpie.
Pour éviter cet inconvénient il a été défini une enthalpie de formation à P et T 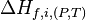 ou
ou 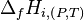 dont les valeurs pour chaque corps pur, pris dans l'état standard, ont été tabulées à la température de référence de 298,15 K. L'enthalpie variant très peu en fonction de la pression, on considère qu'elle est pratiquement indépendante de la pression si cette pression n'est pas très élevée et on prendra alors les valeurs définies dans l'état standard
dont les valeurs pour chaque corps pur, pris dans l'état standard, ont été tabulées à la température de référence de 298,15 K. L'enthalpie variant très peu en fonction de la pression, on considère qu'elle est pratiquement indépendante de la pression si cette pression n'est pas très élevée et on prendra alors les valeurs définies dans l'état standard 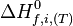 .
.
L'enthalpie de réaction standard est ainsi définie selon :
L'exposant 0 fait référence à l'état standard, c'est-à-dire que chaque composé i est pur, sous la pression standard de 1 bar. À noter que si pour un liquide, un gaz ou un solide, la notion de composé pur est claire, elle est plus problématique pour un composé dissout en solution (par exemple un sel dissout dans de l'eau) : on utilise alors comme état standard le composé infiniment dilué en phase aqueuse.
Problématique de l'état de référence

L'enthalpie molaire standard est tabulée pour de nombreux composés. Il est ainsi aisé de calculer par différence l'enthalpie de réaction, à condition de faire attention aux états de référence utilisés (Figure 1). Comme il n'existe pas de zéro absolu pour l'enthalpie, plusieurs états de références ont été définis pour les enthalpies molaires des composés.
Par analogie avec l'altitude, lorsque l'on doit calculer une dénivelée entre deux points, on calcule la différence entre leur altitudes. De manière implicite, on utilise le même état de référence, à savoir que l'altitude au niveau de la mer vaut zéro. On peut tout aussi bien utiliser un autre état de référence (par exemple en admettant que l'altitude au fond de la Fosse des Mariannes vaut zéro), mais un résultat correct n'est obtenu qu'en restant cohérent, à savoir en utilisant le même référentiel pour les points de départ et d'arrivée.
Pour dresser des tables d'enthalpies molaires standards on a choisi de définir l'échelle d'enthalpie de la manière suivante: l'enthalpie molaire standard d'un corps pur simple stable dans l'état standard est nulle à 298 K.
Exemples :
- oxygène gazeux :
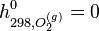
- carbone graphite :
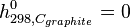
Néanmoins l'utilisation des enthalpies standards de formation permet d'éviter l'emploi d'une convention arbitraire.
Détermination de l'enthalpie de réaction
Il est possible de déterminer l'enthalpie de réaction par une mesure expérimentale ou par un calcul. Par le calcul, on peut arriver très rapidement à obtenir une valeur approximative à partir des tables thermodynamiques. La mesure expérimentale nécessite un certain savoir-faire et l'utilisation d'un calorimètre ou d'une bombe calorimétrique mais elle permet une détermination plus précise, qui tient notamment compte des conditions réelles de réactions. Elle est de plus bien souvent inévitable pour les composés sur lesquels il n'est pas possible de trouver de l'information dans les bases de données actuelles.
Détermination par le calcul

Afin de déterminer une enthalpie de réaction standard par le calcul, on utilise généralement les deux états de référence les plus courants, pour lesquels de nombreuses données sont disponibles. Le premier se base sur les enthalpies de formation. Le second est basé sur les enthalpies de combustion, pour lesquelles le niveau zéro a été fixée pour le CO2 ainsi que pour l'eau, qui sont les produits de combustion d'une molécule organique. Les deux méthodes peuvent être combinées (Figure 2).
Afin de déterminer l'enthalpie de formation ou de combustion d'un composé, il est possible de recourir à la loi de Hess en utilisant les données connues.
Il est également possible d'estimer l'enthalpie de formation d'un composé en connaissant sa structure. Cette méthode, dite de Benson, consiste à additionner les contributions enthalpiques des différents groupes fonctionnels de la molécule.
Détermination expérimentale
En l'absence de données thermodynamiques sur un composé, ou afin d'obtenir une détermination plus précise qui tient compte des conditions réelles de réaction, on procède à la détermination expérimentale de l'enthalpie de réaction. Pour cela les méthodes existantes sont:
- Bombe calorimétrique
- Calorimétrie différentielle à balayage
- Calorimétrie de réaction
Exemples et ordres de grandeur
Valeurs typiques d'enthalpie de réaction :
- Hydrogénation (alcène) : -200 kJ/mol ;
- Amination : -120 kJ/mol ;
- Neutralisation (acide chlorhydrique) : -55 kJ/mol ;
- Réaction de décomposition (groupe nitro) : -350 kJ/mol.
Voir aussi
- Thermodynamique
- Enthalpie
- Enthalpie standard de formation
- Grandeur de réaction
- Équilibre chimique
- Pouvoir calorifique
- Relations de Kirchhoff
- Loi de Hess
- Diagramme d'enthalpie
- Calorimétrie
Liens externes
Base de données du "National Institute of Standards and Technology (USA)"
- Portail de la chimie