Batterie d'accumulateurs
Une batterie d'accumulateurs, ou plus communément une batterie, est un ensemble d'accumulateurs électriques reliés entre eux de façon à créer un générateur électrique de tension et de capacité désirée. Ces accumulateurs sont parfois appelés éléments de la batterie ou cellule[1].
On appelle aussi batteries les accumulateurs rechargeables destinées aux appareils électriques et électroniques domestiques.
Vocabulaire
En France, dans le langage commun, le mot « batterie » désigne un ensemble d'accumulateurs électrique[2].
L'expression anglaise battery pack se traduit donc en français littéralement par « ensemble d'accumulateurs » mais plus simplement par « batterie ». La traduction rapide « pack de batterie » ou encore « pack batterie » est un anglicisme et un pléonasme.
Les différents types d'accumulateurs

Les batteries d'accumulateurs nécessaires aux voitures électriques mais également aux voitures hybrides ont suivi une évolution technologique continue et les progrès sont importants ; malheureusement actuellement, aucune solution n'est entièrement satisfaisante. Certaines de ces batteries ont un usage commun avec d'autres secteurs comme l'éolien ou le solaire pour stocker l’énergie produite de façon intermittente et la distribuer en période de forte demande.
Les recherches et découvertes en cours sont très prometteuses, au point que certains fabricants de batteries promettaient une autonomie des voitures électriques de 800 km pour la décennie[3], grâce à la batterie lithium air[4].

Alors que les batteries au plomb ont une densité massique de 30 Wh/kg, d'autres types se sont développés[5] :
- Nickel - cadmium (Ni - Cd), 50 Wh/kg ;
- Nickel - zinc (Ni - Zn), 80 Wh/kg ;
- Nickel Métal Hydrure (NiMH), 75 Wh/kg ;
- Plomb 2e génération (2006), 75 Wh/kg[6] ;
- Sodium - chlorure de nickel, Système zébra, 85 Wh/kg ;
- Lithium - ion 1re génération (1992), 90 Wh/kg ;
- Sodium - soufre (Na - S), 107 Wh/kg ;
- Lithium Métal Polymère (LMP) (2004), 110 Wh/kg ;
- Lithium polymère (Li - Po), 120 Wh/kg
- Lithium - ion 2e génération (2000), 125[7]à 150 Wh/kg
- Zinc - argent (2007), 200 Wh/kg[8]
- Lithium - ion - manganèse ; également dénommée lithium - manganèse (2007), LiMn, 300 Wh/kg[9]
- Lithium - soufre (Li - S) (2007), 300 Wh/kg
- Lithium - vanadium, + de 300 Wh/kg, présentée par Subaru en 2007[10]
- Lithium - air ou lithium - oxygène, en cours de développement (2010), entre 1 700 Wh/kg et 2 400 Wh/kg en pratique, théorique de 5 000 Wh/kg [11]
- Supercondensateur à la poudre de céramique - aluminium (EEStor aux États-Unis)[3],[12] : Les supercondensateurs sont essentiellement utilisés pour le stockage d'énergie dans les domaines de l'automobile (voitures électriques), du ferroviaire (stockage de l'énergie de freinage) et les énergies renouvelables (éolien et solaire notamment).
Horizon 2020 :
- Condensateurs - lithium - ion (FHI) : en essai au Japon.
La configuration de la batterie
Le choix de la configuration
Les accumulateurs sont bien souvent câblés en série afin d'obtenir la tension de batterie souhaitée. Pour augmenter le courant disponible, il est également possible de recourir à un montage en parallèle des cellules.
Le propre de la batterie d'accumulateur est donc d'augmenter la tension et/ou le courant disponible afin de correspondre aux caractéristiques d'une alimentation donnée.
La combinaison des deux techniques peut être faite en :
- en plaçant en parallèle plusieurs blocs de cellules en séries
- en plaçant en série plusieurs blocs de cellules en parallèles
Notation série (S) et parallèle (T)
Afin de simplifier les descriptions de montage des batteries d'accumulateurs, une notation usuelle est employée :
- Une batterie de 6 cellules en série est notée 6S
- Une batterie de 2 cellules en parallèles est notée 2T
- Une batterie de 2 blocs en parallèle de 6 cellules en série est notée 2T6S
- etc.
Utilisations
- Les accessoires des véhicules routiers sont alimentés en électricité par des batteries d'accumulateurs (souvent de type plomb-acide) lorsque le moteur du véhicule n'est pas en marche. Le but premier de la batterie est de fournir l'intensité et la tension nécessaire au démarreur lors du démarrage du véhicule (l'alternateur est la principale source d'énergie électrique du véhicule une fois le moteur en marche). La tension de cette batterie est couramment de 12 volts[13] sur les automobiles, 24 volts sur les camions (et peut-être de 42 volts pour la prochaine génération de véhicules).
- Dans les alimentations sans interruption, elles stockent l'énergie permettant de suppléer pendant quelques minutes à quelques heures une coupure de courant ;
- Elles permettent le démarrage du groupe diesel d'une alimentation de secours ;
- Les batteries sont utilisées dans de nombreux appareils électroniques autonomes par exemple les téléphones mobiles, les baladeurs numériques, etc.
- Pour la traction des véhicules électriques, des batteries souvent de techniques autres que le plomb et d'une tension supérieure sont utilisées, afin de limiter le courant électrique à transporter.
- Les batteries solaires sont des batteries optimisées pour un fonctionnement avec des panneaux photovoltaïques[14].
- Dans son concept de troisième révolution industrielle, Jeremy Rifkin propose de maximiser les énergies renouvelables et en minimiser les coûts en utilisant les batteries de véhicules comme moyen de stockage itinérant d'électricité provenant de source d'énergie intermittente[15],[16].
Charge des batteries
Indicateurs de charge
La mise en charge des batteries est une opération primordiale pour que les batteries conservent leurs caractéristiques initiales[17].
On peut évaluer dans certains cas le niveau de charge d'une batterie en mesurant sa tension à vide (sans charge).
Dans le cas de techniques plus récentes, comme le NiMh ou le Lithium, des méthodes plus élaborées sont nécessaires pour vérifier le niveau de charge, ce qui nécessite l'utilisation de chargeurs adaptés. Pour ces techniques, les chargeurs évaluent le taux de charge en surveillant l'évolution de la tension de charge et en prenant en compte le courant de charge et le temps, (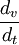 ou
ou 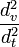 ).
).
Pour une batterie au plomb de tension nominale 12 V :
- Une batterie bien chargée a une tension supérieure à 12,6 V ;
- Une batterie sous 12,4 V peut être mise en charge ;
- Une batterie à 11,7 V est totalement déchargée ou en mauvais état.
Pour une batterie lithium-polymère, chaque cellule a une tension nominale de 3,7 V :
- Une cellule bien chargée a une tension supérieure à 4,1 V ;
- Une cellule à 3 V doit être rechargée ;
- Une cellule sous 2,7 V est totalement déchargée ou en mauvais état et n'est souvent plus rechargeable.
Quand une batterie lithium-polymère est composée de plusieurs cellules (cas fréquent), et il est recommandé de ne pas avoir un écart de tension entre les cellules qui dépasse 0,5 V.
Précautions de mise en charge
- La charge de batteries en parallèle est déconseillée, car chaque batterie est spécifique et va évoluer différemment suivant son état de charge initial, son âge, ses caractéristiques intrinsèques. Il est donc important qu'une batterie en charge soit reliée uniquement à une source de courant afin de ne pas dépasser le courant maximum admissible.[réf. nécessaire]
- La charge en série doit être effectuée uniquement sur des batteries de mêmes caractéristiques et dans un état de charge identique[18].
- De manière générale, la charge des batteries de façon unitaire doit être privilégiée[18].
- La durée de charge peut être approximativement calculée en fonction du courant de charge et de la capacité de la batterie : pour une batterie neuve totalement déchargée : Capacité (en A.h) = Courant de charge (en A) x Temps de charge (en h).
- Le rendement de charge (énergie stockée / énergie injectée pour la charge de la batterie) est inférieur à 1, en particulier en raison de la résistance interne à la batterie ; ce rendement dépend de l'intensité de courant utilisée pour la charge, il décroît quand l'intensité croît.
- La capacité doit être divisée par les facteurs de dépréciations en température (DT) et en charge/décharge (Dch).
Par exemple DT=0,01053.T+0,73671 pour des batteries plombs. (DT>1 si T>25 °C ; DT<1 si T<25 °C). De même, Dch =20/30 par exemple si le courant nominal est de 20 A alors que le courant de décharge réel est de (30 A) (cas des charges rapides).
Test des batteries 12 V
Pour tester une batterie au plomb 12v (6S), la première chose à faire est de vérifier sa tension à vide qui devrait être comprise entre 12,4 et 12,6 volts ( À 12,4 volts la batterie est à 75 % de charge). Il faut aussi vérifier les bornes de la batterie (qui ne doivent pas bouger) et si la batterie est gonflée (si la batterie est gonflée la raison en est probablement que la batterie est restée à des températures basse alors quelle était déchargée), la présence de fissures et la continuité entre les bornes (qui pourrait être expliquée par la présence de fuite d’électrolyte, de calcium ou d'autres substances conductrices).
- Si la tension de la batterie est inférieure à 12,4 volts, le second test à faire est le test d'acceptation de la charge qui consiste à vérifier si la batterie est capable de se recharger. Pour commencer il faut brancher un voltmètre à la batterie, brancher un chargeur, régler le chargeur entre 1 et 25 ampères et activer le chargeur pendant 3 à 5 minutes. La tension ne devrait jamais dépasser 15,5 volts. Si la batterie passe ce test sans dépasser 15,5 volts la batterie est bonne pour être rechargée, sinon la batterie est sulfatée ;
- Si la batterie passe le test d'acceptation de la charge elle peut passer au test de décharge rapide. Pour le test de décharge rapide il faut brancher une résistance en carbone à la batterie, installer une pince ampèremétrique sur le câble positif ou négatif de la résistance carbone (reliée à la batterie) et un voltmètre à la batterie. Il faut ensuite faire monter l'intensité jusqu'à ce que la pince ampèremétrique affiche la moitié du CCA (Cold Cranking Ampere) de la batterie pendant un maximum de 15 secondes (pendant le test la batterie doit être à 21 °C). La tension de la batterie ne doit pas descendre sous 9,6 volts pendant le test. Ce test permet de savoir si la batterie sera capable de faire tourner par exemple un démarreur par temps froid tout en gardant une tension suffisante pour alimenter les autres composants du véhicule.
Régénération de batterie
Les batteries plomb ouvert (chariots élévateur, nacelles, etc.) ont une durée de vie limitée à environ 1500 cycles[réf. nécessaire]. Lors du stockage et de la restitution de l'énergie au cours de cycles d'utilisation normaux, des cristaux de sulfate s'accumulent graduellement sur les électrodes, empêchant la batterie de fournir efficacement du courant. Les cristaux "étouffent" en fait la batterie. Même une charge de désulfatation n'empêche pas toujours que l'on doive remplacer la batterie après quelques années.
La sulfatation est une des causes de vieillissement d'une batterie au plomb qui est restée déchargée pendant un certain temps avant la recharge, mais il y a aussi un autre facteur de vieillissement qui est la transformation au cours des cycles de charge/décharge de la matière active de l'électrode positive. Celle-ci est constituée de dioxyde de plomb PbO2 qui cristallise sous 2 formes différentes (α-PbO2 et β-PbO2) dont une forme est constituée de petits cristaux, elle se transforme au cours des cycles en l'autre forme dont les cristaux sont plus gros, ce qui génère un gonflement de l'électrode qui se désagrège.
Recyclage des batteries
Les batteries au plomb peuvent être recyclées : même après sa mort, la plupart de ses composants peuvent être réutilisés, comme le plastique, l'acide et les plaques de plomb. Au sein de l'usine de recyclage, le plastique du boîtier sera ainsi séparé du plomb des plaques et de l'acide de l'électrolyte. Ensuite, le plomb est fondu dans un four et réutilisé pour fabriquer de nouvelles plaques.
Le plastique de son côté est également fondu et sert à confectionner de nouveaux boîtiers. Enfin, l’acide sulfurique est contrôlé, car il causerait de graves dommages s’il se retrouvait dans l’atmosphère. Il va servir lui aussi ultérieurement lors de la fabrication de batteries neuves.
Ainsi donc, tout est recyclé dans les batteries et les pertes dans l’environnement sont très faibles, mais elles doivent être déposées dans des endroits prévus à cet effet : les mairies, décharges, des magasins spécialisés dans l'automobile ou le matériel industriel ou certains ferrailleurs (contre rémunération) peuvent s'en charger. Au Québec, les écocentres (centres municipaux de recyclage) offrent généralement ce service gratuitement[19].
Notes et références
- ↑ Cyril Valent, A quoi correspond le nombre de cellules d'une batterie ?, sur le site 01net.com du 30 novembre 1999
- ↑ batterie Sur le site larousse.fr
- 1 2 Une auto électrique révolutionnaire pourrait être produite au Canada dès 2008..., Sur le site nanoquebec.ca - Page introuvable le 24 avril 2012 - idem le 10 aout 2012
- ↑ IBM s'implique en lithium air Sur le site electronique.biz
- ↑ diaporama complet sur le fonctionnement et différents exemples récents de batteries et accumulateurs, une ressource École Normale Supérieure - DGESCO
- ↑ Page introuvable le 24 avril 2012 Sur le site .nanoquebec.ca
- ↑ (en) R.M. Dell et D.A.J. Rand, Understanding batteries, The Royal Society of Chemistry, 2001 (ISBN 0-85404-605-4)
- ↑ Batteries : le Zinc-Argent succèdera au Lithium-Ion en 2007 ? Sur le site pcinpact.com
- ↑ États-Unis : l'autonomie des batteries lithium-ion doublée !, sur le site ecologie.caradisiac.com
- ↑ Les voitures 'écolos' du 40e Tokyo Motor Show Sur le site enerzine.com
- ↑ (en) Lithium-air batteries offer three times the energy density Sur le site gizmag.com
- ↑ Les batteries EEStor trouvent leur première application Sur le site fr.gizmodo.com du 2007/01/23]
- ↑ 6 volts sur certains anciens modèles encore en circulation.
- ↑ : durée de vie, propriétés électriques et anticorrosion, entretien, sur le site surtec.fr
- ↑ Hermans, Y., Le Cun, B., & Bui, A. (2011). Modèle d'optimisation basé sur le Vehicle-to-grid pour limiter l'impact des pics de consommation électrique sur la production.
- ↑ Dargahi, A., Wurtz, F., Ploix, S., Gaaloul, S., Le, X. H. B., Delinchant, B., ... & Tollenaere, M. (2012). Exploitation de la capacité de stockage de véhicule électrique dans la gestion optimale du flux énergétique de bâtiments: Contribution à la convergence transport/habitation.
- ↑ Charge des batteries d'accumulateur au plomb, sur le site inrs.fr
- 1 2 La charge d'une batterie devant partir du courant maximum admissible quand elle est complètement déchargée pour finir par le courant de maintient lorsqu'elle est complètement chargée
- ↑ http://www.recyc-quebec.gouv.qc.ca/client/fr/accueil.asp
Voir aussi
Articles connexes
- Batterie oléo-pneumatique
- Tesla Powerwall
- SCiB
Liens externes
- Cours détaillé sur les batteries au plomb, sur le site photovoltaique.guidenr.fr
- Maintenance et utilisation d'une batterie de voiture, sur le site forum-auto.com
- Voir un schéma détaillé d'une batterie d'automobile, sur le site infovisual.info
- Les accus rechargeables, théorie et pratique, sur le site ni-cd.net
- [PDF]Comment choisir la bonne batterie, sur le site jade-technologie.com
- Réaliser une banque de batterie, sur le site batterie-et-manutention.fr
- Remplacer une batterie de voiture, sur le site batterievoiturepro.com
- infos générales sur une batterie de voiture, sur le site batterie-voitureinfos.com
- Portail de l’électricité et de l’électronique
- Portail de la chimie
- Portail de l’énergie